原发性心脏平滑肌肉瘤1例及影像学分析*
尹闻科,宋晓艳
(1.川北医学院病理教研室,四川南充 637000;2.川北医学院附属医院病理科,四川南充 637000;3.四川省南充市东方医院 637000)
平滑肌肉瘤属于平滑肌组织起源的肉瘤,常见好发部位包括子宫、腹膜后、腹腔及四肢和躯干。原发于心脏的平滑肌肉瘤极其罕见,国内外仅有少量个案报道,该肿瘤发展迅速,预后差,临床表现缺乏特征性改变。本文报道1例原发性心脏平滑肌肉瘤,从病理特点、免疫表型、影像学改变及临床资料综合分析并复习相关文献,以提高对本病尤其是影像学早期诊断重要性的认识。
1 资料与方法
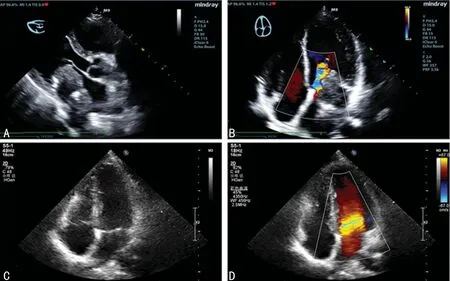
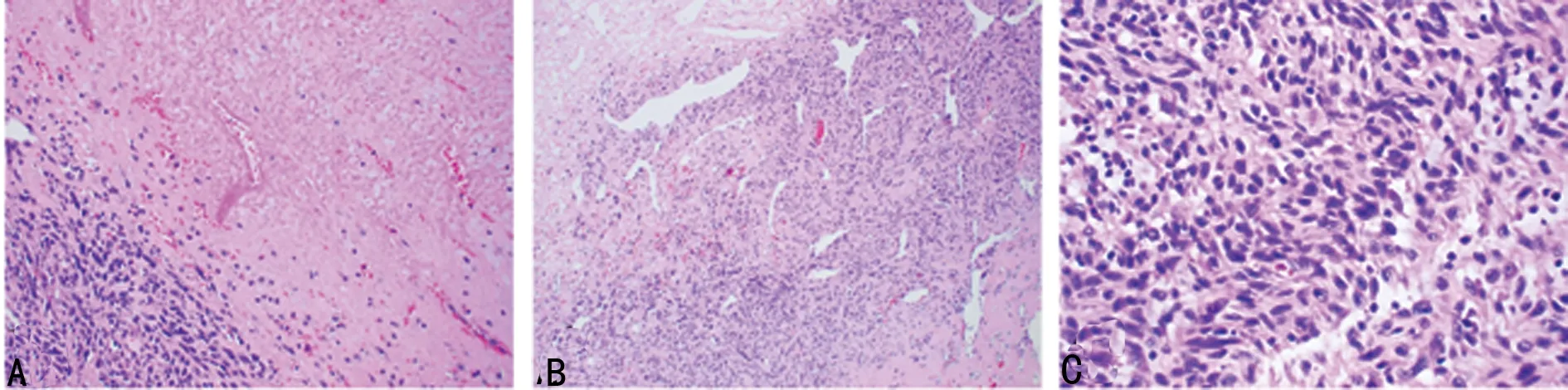
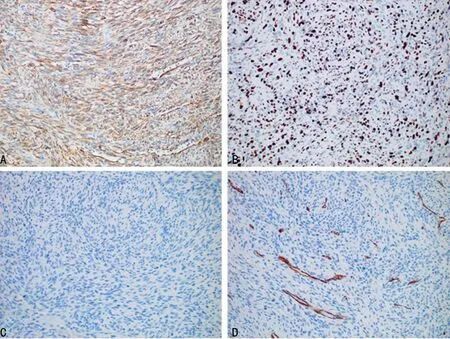
1.1一般资料 患者,男,43岁,心悸伴疲乏4+年,加重伴活动后气促,发绀4+d,于2018年5月收入本院。专科检查:心浊音界正常,心律齐,P2 1.2方法 手术切除肿瘤,并行影像学检查,病理标本肉眼观察,显微镜下观察及免疫组化染色检查。术后病理诊断:心脏平滑肌肉瘤,法国癌症中心联合会(FNCLCC)分级:2级(肿瘤分化2分,有丝分裂计数1分,肿瘤坏死1分)[1],美国癌症联合会(AJCC)分期ⅡA期(T2bN0M0)。 2.1超声检查结果 术前超声心动图显示:应用迈瑞彩超成人心脏模式下,经左心室长轴切面扫查,于左心房内见一大小约65 mm×43 mm的以中低回声为主的实性团块,并附着于左心房后壁及二尖瓣后叶,形态较规则,边界尚清,该团块基底较宽并与二尖瓣后叶粘连,致二尖瓣开放受限,开口径约5 mm,最窄处开口面积约0.9 cm2(图1A)。术前彩色多普勒血流图显示:二尖瓣口见花色血流,最大血流速度:2.51 m/s(图1B)。左心房肿瘤摘除术后1个月复查超声心动图显示:各心房心室内径正常,左心房内未见明显肿块影像,各瓣膜形态、回声、开闭正常(图1C)。术后彩色多普勒血流图显示:各瓣口血流未见明显异常(图1D)。 A:术前超声心动图;B:术前彩色多普勒血流图;C:术后超声心动图;D:术后彩色多普勒血流图 图1超声检查结果 2.2病理检查结果 肉眼观:肿块大小7.2 cm×4.3 cm×3.2 cm,切面灰白实性质韧,局灶可见出血、坏死及囊性变(图2)。镜下观:肿瘤细胞呈编织状排列,伴有明显凝固性坏死灶(图3A),可见血管外皮瘤样排列区域(图3B),肿瘤细胞呈短梭形,异型性明显,胞质丰富偏嗜酸性核居中,可见小核仁,核两端平钝成雪茄样,核分裂象易见(约5个/10 HPF),可见病理性核分裂象(图3C)。免疫表型:肿瘤细胞均弥漫表达平滑肌肌动蛋白(SMA)(图4A)和结蛋白(Desmin),Ki-67增殖指数约50%(图4B),白细胞分化抗原(CD)34、CD68、B细胞淋巴瘤-2(Bcl-2)、信号传导及转录激活因子-6(STAT-6)、转导蛋白样分裂增强因子-1(TLE-1)、细胞角蛋白(CK)、S-100、肌浆蛋白(Myogenin)、肌调节蛋白(MyoD1)、细胞角蛋白5/6(CK5/6)、钙视网膜蛋白(Calretinin)均阴性(图4C、D)。患者随访4个月病情无复发,复查超声心动图正常。 图2 肿瘤大体观 A :HE(×100);B:HE(×200);C:HE(×400) 图3肿瘤细胞镜检结果 A:SMA瘤细胞阳性;B:Ki-67瘤细胞阳性率约50%;C:S-100瘤细胞阴性;D:CD34瘤细胞阴性,血管阳性 图4肿瘤细胞免疫组织化学结果(SP×200) 心脏平滑肌肉瘤临床极其罕见,发病率不到心脏恶性肿瘤的1%[2]。有研究表明,肿瘤可能起源于心脏间充质组织[3-4],肿瘤的好发人群为中老年人群,女性发病率略高于男性,由于肿块的压迫和浸润,患者心功能不全的症状和体征通常比较明显,如心悸、气急、发绀及心音改变和心脏杂音的出现,严重情况下可出现心律失常,心力衰竭[5]。超声心动图检查对于心脏平滑肌肉瘤的诊断具有重要的价值,可筛查出直径3 mm的肿瘤[6]。良性肿瘤如黏液瘤呈息肉状、分叶状或不规则状,基底部一般带蒂,瘤体活动度好,舒张期通过房室瓣进入心室,收缩期回纳进入心房,可导致房室流出道或流入道梗阻的症状和体征;恶性肿瘤如平滑肌肉瘤体现为肿瘤基底部宽,与房室壁接触面广,浸润性生长,形态不规则,无蒂,活动度差,常合并心包积液[7]。而部分心脏平滑肌肉瘤(包括本例)影像学改变不典型,极易导致误诊。有报道显示,心脏良性肿瘤尤其黏液瘤多发生于左心房,常带细蒂,形态规则卵圆形,瘤体活动度大,经过房室瓣口时甚至可变形常表现为均匀一致的较高回声(细胞丰富区域)或分布不均的低回声伴分隔(胶冻状区域)[8];若肿块回声不均、衰减明显及后方衰减,且肿块广基,生长迅速且伴有心包积液时,要考虑恶性肿瘤的可能[9]。本例患者影像学改变不典型,病史较长,且专科检查未发现心脏增大或心包积液产生的证据,仅闻及舒张期杂音,但追问患者病史发现其病情加重的时间为2个月,且超声心动图显示中低回声团,肿块分布于二尖瓣后叶及左心房后壁,并与二尖瓣后叶粘连致二尖瓣开放受限,基底部较宽,且活动幅度小,术中所见也证实肿块与左心房后壁关系密切并已累及心内膜。但此种影像学改变需与心房内附壁血栓伴机化鉴别,后者常因血栓形成时间较长,伴肉芽组织增生甚至纤维化玻璃样变性(玻变)、钙化,导致肿块声影基底部与心壁接触面较大,活动度差,呈高低混杂性回声,类似恶性肿瘤影像,但心房内附壁血栓伴机化的患者一般有风湿性心瓣膜病或房颤病史,且病史较长,左心房多见,低回声区强度较低(新鲜血栓),高回声区强度较高(玻变及钙盐沉积)[10]。因此对于类似本例影像学改变不典型的心脏平滑肌肉瘤患者,在进行超声心动图和彩色多普勒血流筛查时,应重点观察肿块内部回声、活动度,基底边缘生长情况结合专科检查及病史甚至病理检查综合考虑,方能做出正确的诊断。 心脏平滑肌肉瘤多发生于心腔,呈结节状外生性生长,基底部呈广基形态伴浸润,极少发生于心壁及室间隔肌层内;发现时肿瘤直径一般为6 cm左右[11],切面灰白,灰红实性质韧,可见坏死及囊性变区域;镜下富含嗜酸性细胞质,呈束状排列,细胞核呈梭形,末端钝圆似雪茄烟样,核深染,染色质粗,核仁明显,具有明显的核异型性,核分裂指数高,核分裂象一般大于或等于5个/10 HPF,通常坏死明显,可能出现上皮样肿瘤细胞,甚至破骨细胞样多核巨细胞[12],可伴出血、囊性变、黏液样变及玻变。免疫组织化学标记显示,肿瘤细胞表达平滑肌相关标志物肌特异性肌动蛋白(MSA)、SMA,肌源性相关标志物Desmin均呈阳性表达。本例免疫组织化学结果符合上述特点。 诊断心脏原发平滑肌肉瘤,需首先排除其他部位的转移性平滑肌肉瘤,询问病史及CT和MRI扫描有助于鉴别转移性平滑肌肉瘤,鉴别诊断时应注意:(1)滑膜肉瘤。肿瘤呈双相性结构,梭形肿瘤细胞体积较小,存在密集区与水肿区交替出现的现象,免疫组织化学标记CK、CK7、上皮膜抗原(EMA)、波形蛋白(Vimentin)、Bcl-2、TLE-1阳性,可查见SS18/SSX融合基因。(2)恶性孤立性纤维性肿瘤:肿瘤细胞异型明显,核分裂象多见(>4个/10 HPF),血管外皮瘤样分支血管,肿瘤细胞密集区与稀疏区交替出现,可见瘤细胞间玻变胶原纤维[13],然而心脏平滑肌肉瘤也可伴有血管外皮瘤样区域[14-15],免疫组织化学CD34、Bcl-2、CD99、STAT-6阳性。(3)恶性外周神经鞘瘤。肿瘤与神经有一定关联,肿瘤细胞长梭形或短梭形呈束状排列,细胞核呈锥型或逗点样,可见玻变区域,肿瘤内多见厚壁血管,部分肿瘤存在异源性成分,免疫组织化学S-100、CD57、SOX-10阳性。(4)心房黏液瘤:肿瘤富含蛋白多糖基质,细胞排列稀疏,呈梭形或星形,细胞无异形,肿瘤基质奥辛蓝染色阳性,免疫组织化学CD34、S-100、Calretinin阳性。其他诊断如低分化癌、横纹肌瘤、恶性黑色素瘤可通过形态及免疫组织化学得到鉴别。本例患者术前检查及询问病史均未发现其他部位恶性肿瘤,结合形态及免疫组织化学CK、STAT-6、TLE-1、S-100、MyoD1、Calretinin等均阴性,SMA及Desmin均阳性,最终诊断为原发性心脏平滑肌肉瘤。 有研究表明,心脏平滑肌肉瘤存在TP53及PTEN基因突变,MYOCD基因扩增,导致AKT-mTOR信号通路激活引起肿瘤细胞过度增殖[16]。也有学者研究发现,采用舒尼替尼治疗可有效缓解患者的心力衰竭和胸腔积液等症状,提示心脏平滑肌肉瘤的发生可能与受体酪氨酸激酶通路激活有关,但具体机制尚需进一步研究[17]。 心脏平滑肌肉瘤恶性程度高,病情进展迅速,临床治疗主要依靠手术切除,但通常难以彻底清除,且肿瘤浸润影响心功能,导致临床预后差,中位生存时间6个月[18]。有报道术后联合放疗及化疗可提高生存率[5];然而有报道通过超声检查早期将肿瘤筛查出来,也有个别患者生存期超过2年[18]。因此对于心脏肿瘤,超声检查至关重要,对于肿瘤进行超声影像学分析及评估,加上后续病理分析,使病情得到及时正确的诊断,患者的临床获益将极大提升。2 结 果

3 讨 论

