中药逐水饮对小鼠Lewis肺癌胸腔积液模型积液生成及Th17免疫平衡的影响∗
刘晓芳 金昌凤 魏一强 赵 静 孙素芹 高 磊 李义君
(1.黑龙江中医药大学,黑龙江 哈尔滨 150036;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨 150000)
恶性胸腔积液(MPE)约占全部胸腔积液的38%~53%,其中约40%MPE是由肺癌、淋巴癌、乳腺癌等恶性肿瘤胸膜转移引起,是肿瘤扩散或病情进展至晚期的常见并发症之一,临床MPE的发生往往预示预后不良[1-2]。大量胸腔积液可造成患者胸闷、胸痛、呼吸困难、气促等症状,严重者可危及生命,因此积极有效地控制MPE对改善肿瘤患者临床症状,提高生存质量,延长生存期十分重要。目前,MPE治疗方法较多,但采用手术等方法会引起晚期及老年患者不能耐受,且短期内复发率仍然很高,同时化疗药物毒副作用也较大[3-4]。中医药可通过作用于MPE形成的多个环节抑制MPE形成,具有一定安全性和治疗疗效,是近年来临床治疗恶性肿瘤并发症的手段之一[5]。中药逐水饮由党参、黄芪、白术、葶苈子等药物组成,具有泻肺利水、消除积液、益气健脾等作用。本研究体外建立小鼠Lewis肺癌胸腔积液模型,观察中药逐水饮对小鼠MPE生成及Th17细胞免疫平衡的影响,探讨其治疗MPE的可能作用机制。现报告如下。
1 材料与方法
1.1 实验动物 雄性C57BL/6小鼠,70只,SPF级,12周龄,体质量15~25 g,由黑龙江中医药大学实验动物中心提供,许可证号:SYXK(黑)20160013。
1.2 试药与仪器 1)试药:中药逐水饮,组成:黄芪20 g,人参15 g,葶苈子20 g,瓜蒌皮20 g,大枣15 g,桑白皮15 g,百部15 g,苦参20 g,莪术15 g,白花蛇舌草20 g,夏枯草10 g,甘草15 g。水煎煮2次,浓缩配制为生药含量1g/mL药液。小鼠Lewis肺癌瘤株,上海研生实业有限公司提供。胎牛血清,HyClone公司,批号20170619;生药含量1 g/mL DMEM培养基,HyClone公司,批号20170619;RPMI1640培养基,上海玉博生物科技有限公司,批号20170725;台盼蓝染色液,北京索莱宝科技有限公司,货号C0040;顺铂注射液,规格:每支10 mg,齐鲁制药有限公司,批号20160309;FIcoll分离液,北京索莱宝科技有限公司,批号20170309;枸橼酸钠,南京化学试剂有限公司,批号080560059;佛波酯,北京索莱宝科技有限公司,货号P6741;离子霉素,美国Sigma公司,批号I-0634;FITC标记的CD4抗体(批号20170503)、PE标记的RORγτ抗体(T17)(批号20170416)、Alexa647标记的Foxp3抗体(Treg)(批号20170328)购于北京奥维亚生物技术有限公司;白细胞介素17(IL-17)(批号ab83708)、白细胞介素23(IL-23)(批号ab23305)、转化生长因子β1(TGF-β1)(批号ab86349)试剂盒购于Abcam公司。2)仪器:HH-6数显恒温水浴锅,上海析达仪器有限公司;RCO3000TVBA CO2培养箱,REVCO公司;DYS-107三目生物显微镜,上海点应光学仪器有限公司;MS-TS精密天平,梅特勒-托利多国际贸易(上海)有限公司;FACSCalibur流式细胞仪,BD公司。
1.3 细胞传代及Lewis肺癌单细胞悬液制备 取小鼠Lewis肺癌瘤株,快速放入37℃水浴锅中复温,转移至新的无菌离心管中,轻轻吸打使细胞均匀分散,800 r/min离心5 min,弃上清,加入适量含有10%胎牛血清的新鲜DMEM培养基,重悬,制成细胞悬液。取细胞悬液加入250 mL培养瓶中,放入培养箱培养,待细胞80%~90%融合时进行传代,3~4 d传代1次。取第3代细胞,接种于小鼠腋背部皮下。取接种10~14 d的小鼠,处死,剥离肿瘤组织,取生长良好的瘤组织,用生理盐水反复冲洗后,用无菌玻璃杵子将瘤块碾碎成单细胞悬液,经150目筛网过滤后,将细胞悬液转移至无菌离心管中,1500 r/min离心5 min,弃上清,使用0.9%氯化钠溶液洗涤2次。加入0.9%氯化钠溶液重悬细胞,台盼蓝染色检测活性细胞>90%,调整细胞浓度为2×106个/mL。
1.4 动物分组及小鼠Lewis肺癌胸腔积液模型建立70只小鼠去除胸前毛发,75%乙醇常规消毒,随机选取56只小鼠经胸前皮下短时间内注射0.2 mL上述细胞悬液建立Lewis肺癌胸腔积液模型,给药1次[6]。造模成功后,随机分为模型组、逐水饮组、顺铂组、逐水饮+顺铂组,每组14只。另取14只小鼠皮下短时间内注射0.2 mL 0.9%氯化钠溶液作为正常对照,给药1次。
1.5 干预方法 正常对照组正常喂养,不做任何处理。Lewis肺癌胸腔积液模型小鼠建模后第3日起开始给药。模型组正常喂养,不给予任何药物。逐水饮组:参考范一平等方法[7],将27 g/(kg·d)生药药液调整至0.2 mL给予小鼠灌胃,每日1次。顺铂组:将顺铂注射液用9 L 0.9%氯化钠注射液稀释后,以6 mg/(kg·d)胸腔灌注,隔3日1次。逐水饮+顺铂组:27 g/(kg·d)生药药液,调整至0.2 mL给予小鼠灌胃,每日1次,同时给予胸腔灌注顺铂6 mg/(kg·d),隔3日1次。各组连续给药10 d。
1.6 样本采集 于建模后第14日行胸部CT检查,观察胸腔积液生成情况。给药结束后(即建模后第14日),每组取8只小鼠处死。眼球取血,一部分1 mL血样,经2000 r/min离心后收集血清-80℃保存;另一部分1 mL血样,以体积比1∶1加入PBS溶液稀释,使用FIcoll分离液分离单个核细胞。同时收集MPE,测量MPE体积。取适量MPE,离心后,弃上清,加入PBS溶液重悬,使用FIcoll分离液分离单个核细胞;另取适量MPE,以体积比9∶1加入3.8%枸橼酸钠抗凝,离心取上清保存。每组剩余6只小鼠用于观察生存率。
1.7 观察项目 1)胸壁转移瘤计数、转移瘤质量:由两位经验丰富的医师,在解剖显微镜下计数前、侧、后胸壁转移瘤个数,然后剥离胸壁转移瘤,称质量。2)流式细胞术检测MPE及外周血中Th17、Treg细胞百分比:离心收集MPE单个核细胞和外周血单个核细胞,加入RPMI1640培养基重悬,调整细胞浓度为2×106个/mL,分别加入2 μL佛波酯和伊屋诺霉素混合液、1 μL离子霉素混匀,置于37℃,5%CO2培养箱中培养4 h。取200 μL细胞悬液,加入FITC标记的CD4抗体、PE标记的RORγτ抗体(Th17)、Alexa647标记的Foxp3抗体(Treg)及其相应同型抗体,4℃避光染色30 min。使用含2%胎牛血清的PBS溶液洗涤1次,然后加入200 μL PBS溶液重悬,并转移至流式检测管。使用FACSCalibur流式细胞仪(BD公司)检测各种荧光素强度,Flow-Jo7.6.5软件分析Th17细胞和Treg细胞占CD4+T细胞的百分比。3)MPE及外周血中IL-17、IL-23、TGF-β1因子水平:取血清和MPE上清,采用酶联免疫吸附法(ELISA)检测血样和MPE中IL-17、IL-23、TGF-β1表达水平。操作步骤严格参照试剂盒说明书进行。
1.8 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,多组间比较采用方差分析检验,两组间比较采用两独立样本t检验,计数资料用百分数表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组胸腔解剖及CT检查结果 见图1,图2。建模后第14日,各组小鼠行胸部CT检查,结果正常对照组小鼠肺野清晰,胸膜光整,而模型组可见大量胸腔积液生成,顺铂组、逐水饮组和逐水饮+顺铂组胸腔积液减少(见图1)。处死小鼠,剖开胸骨,暴露胸壁,正常对照组小鼠可观察到双肺色白,胸壁光滑,而模型组小鼠明显可见血性胸腔积液(见图2,白色箭头所示为血性胸腔积液)。
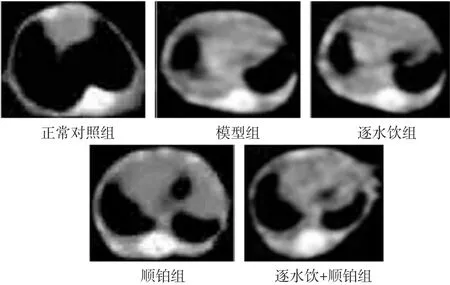
图1 各组小鼠胸部CT扫描图
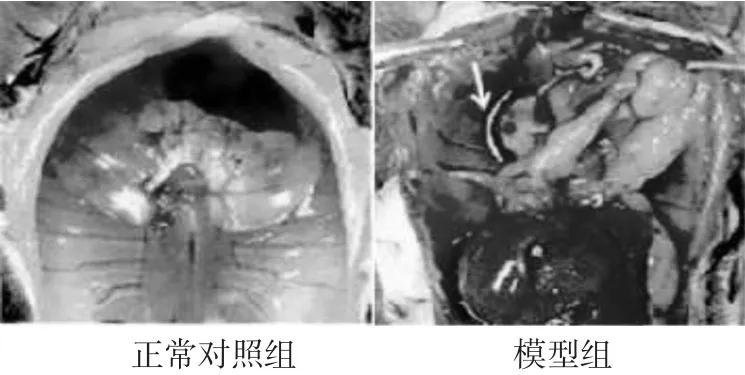
图2 小鼠胸腔解剖图
2.2 各组小鼠MPE体积、胸壁转移瘤数、转移瘤质量及生存期比较 见表1。与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组小鼠MPE体积减小(P<0.05),胸壁转移瘤数目减少(P<0.05),转移瘤质量减轻(P<0.05),生存期延长(P<0.05);逐水饮组和顺铂组小鼠MPE体积、胸壁转移瘤数目、转移瘤质量和生存期比较差异无统计学意义(P>0.05);与逐水饮组和顺铂组比较,逐水饮+顺铂组小鼠MPE体积、胸壁转移瘤数目、转移瘤质量和生存期变化更加明显(P<0.05)。
表1 各组小鼠MPE体积、胸壁转移瘤数、转移瘤质量及生存期比较(±s)
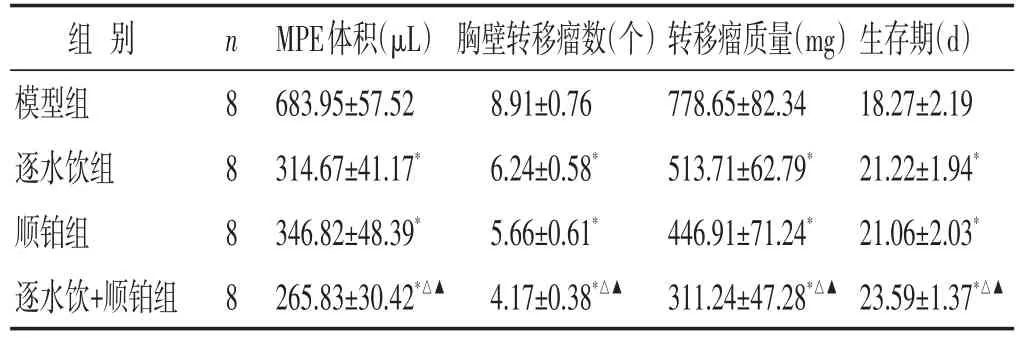
表1 各组小鼠MPE体积、胸壁转移瘤数、转移瘤质量及生存期比较(±s)
与模型组比较,∗P<0.05;与逐水饮组比较,△P<0.05;与顺铂组比较,▲P<0.05
组别模型组逐水饮组顺铂组逐水饮+顺铂组n 8 8 8 8 MPE体积(μL)683.95±57.52314.67±41.17*346.82±48.39*265.83±30.42*△▲胸壁转移瘤数(个)8.91±0.766.24±0.58*5.66±0.61*4.17±0.38*△▲转移瘤质量(mg)778.65±82.34513.71±62.79*446.91±71.24*311.24±47.28*△▲生存期(d)18.27±2.1921.22±1.94*21.06±2.03*23.59±1.37*△▲
2.3 各组MPE及外周血中Th17、Treg细胞百分比比较 见图3~图4,表2。与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组小鼠MPE和外周血中Th17细胞百分比升高(P<0.05),MPE中Treg细胞百分比降低(P<0.05);逐水饮组和逐水饮+顺铂组小鼠MPE和外周血中Th17细胞百分比高于顺铂组(P<0.05),Treg细胞百分比低于顺铂组(P<0.05);逐水饮+顺铂组小鼠MPE和外周血中Th17、Treg细胞百分比与逐水饮组比较差异无统计学意义(P>0.05);各组小鼠MPE中Th17、Treg细胞百分比均高于其外周血中Th17、Treg细胞百分比(P<0.05)。
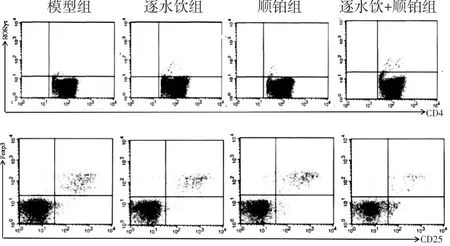
图3 各组小鼠MPE中Th17、Treg细胞比例流式图
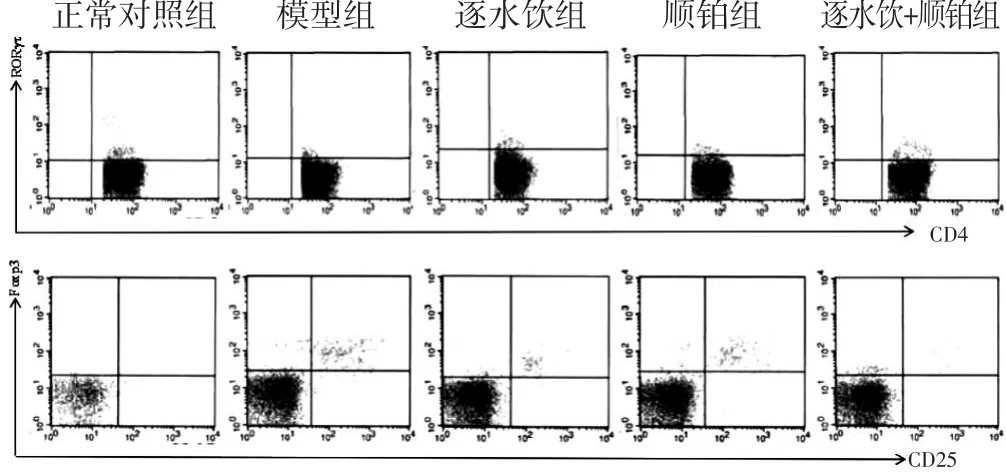
图4 各组小鼠外周血中Th17、Treg细胞比例流式图
表2 各组小鼠MPE及外周血中Th17、Treg细胞百分比比较(±s)
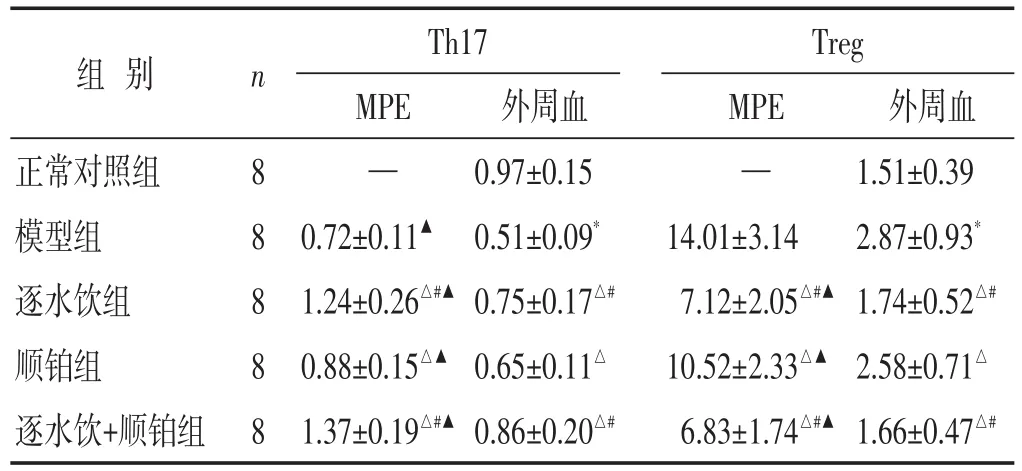
表2 各组小鼠MPE及外周血中Th17、Treg细胞百分比比较(±s)
与正常对照组比较,∗P<0.05;与模型组比较,△P<0.05;与顺铂组比较,#P<0.05;与本组外周血比较,▲P<0.05。下同。
组别正常对照组模型组逐水饮组顺铂组逐水饮+顺铂组n 8 8 8 8 8 Th17 MPE—0.72±0.11▲1.24±0.26△#▲0.88±0.15△▲1.37±0.19△#▲外周血0.97±0.150.51±0.09*0.75±0.17△#0.65±0.11△0.86±0.20△#Treg MPE—14.01±3.147.12±2.05△#▲10.52±2.33△▲6.83±1.74△#▲外周血1.51±0.392.87±0.93*1.74±0.52△#2.58±0.71△1.66±0.47△#
2.4 各组MPE及外周血中IL-17、IL-23、TGF-β1因子表达水平比较 见表3。与正常对照组比较,模型组外周血中IL-17、IL-23水平降低(P<0.05),TGF-β1水平升高(P<0.05);与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组MPE和外周血中IL-17、IL-23水平升高(P<0.05),TGF-β1水平降低(P<0.05);逐水饮组和逐水饮+顺铂组MPE和外周血中IL-17、IL-23水平高于顺铂组(P<0.05),TGF-β1水平低于顺铂组(P<0.05);逐水饮组和逐水饮+顺铂组MPE和外周血中IL-17、IL-23、TGF-β1水平比较差异无统计学意义(P>0.05)。
表3 各组小鼠MPE及外周血中IL-17、IL-23、TGF-β1因子表达水平比较(pg/mL,±s)
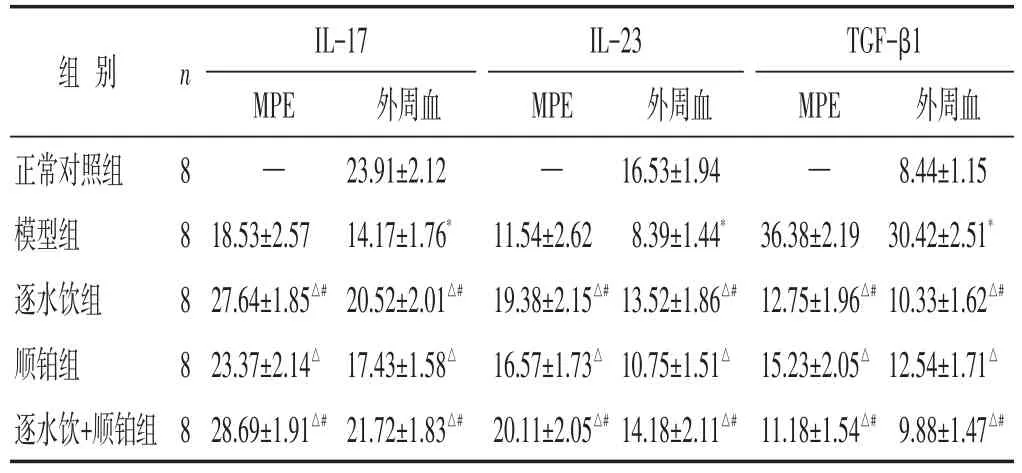
表3 各组小鼠MPE及外周血中IL-17、IL-23、TGF-β1因子表达水平比较(pg/mL,±s)
组别正常对照组模型组逐水饮组顺铂组逐水饮+顺铂组n 8 8 8 8 8 IL-17 MPE—18.53±2.5727.64±1.85△#23.37±2.14△28.69±1.91△#外周血23.91±2.1214.17±1.76*20.52±2.01△#17.43±1.58△21.72±1.83△#IL-23 MPE—11.54±2.6219.38±2.15△#16.57±1.73△20.11±2.05△#外周血16.53±1.948.39±1.44*13.52±1.86△#10.75±1.51△14.18±2.11△#TGF-β1 MPE—36.38±2.1912.75±1.96△#15.23±2.05△11.18±1.54△#外周血8.44±1.1530.42±2.51*10.33±1.62△#12.54±1.71△9.88±1.47△#
3 讨 论
MPE为胸膜直接受累或肺癌、乳腺癌、淋巴瘤、消化系统恶性肿瘤等转移至胸膜而引起胸膜腔液生成过快和(或)吸收减慢,导致液体积聚于胸膜腔[8]。约有5%~10%的MPE找不到原发肿瘤灶,一旦出现则预后不良,中位生存期仅为4个月[9-10]。中医药治疗MPE,可通过趋化免疫炎性细胞、调节整体免疫功能、抑制化学性胸膜炎形成等多种途径发挥抗肿瘤、抑制MPE形成,疗效确切、作用温和、毒副作用小,为肿瘤晚期及年老体弱患者的MPE治疗提供了更多选择[11]。
中医学认为,MPE归属“悬饮”“支饮”范畴,津液失布,邪流胸胁,阻滞三焦,水饮积结,发为胸腔积液,以行气利水、化瘀散结兼顾护正气为主要疗法[12]。本研究结果显示,与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组小鼠MPE体积、胸壁转移瘤数目减少,转移瘤质量减轻,生存期延长,说明逐水饮和顺铂对MPE和肿瘤生长均具有一定抑制作用。逐水饮+顺铂组小鼠MPE体积、胸壁转移瘤数目、转移瘤质量和生存期与逐水饮组和顺铂组比较有明显差异,提示逐水饮和顺铂联用对肿瘤和MPE的抑制作用更加明显。化疗药物能直接杀死或抑制肿瘤细胞增殖,但副作用明显,部分患者耐受性较差,结合中药逐水饮扶正祛邪,可减轻其毒副作用,改善患者耐受性,促进胸腔积液消退[13-14]。研究也证实中药口服汤剂(如宣肺逐饮方、温肺化饮方、葶苈甘遂逐水饮等)联合顺铂胸腔灌注治疗肺癌MPE的疗效较单用顺铂更佳[15]。
MPE的产生、发展与其微环境密切相关,其中免疫细胞在MPE微环境中起重要作用,机体细胞免疫主要由CD4+辅助性T细胞和CD8+细胞毒T细胞介导,已有研究表明MPE中Th17/Treg细胞失衡提示预后不良[16-18]。本研究观察各组小鼠MPE和外周血Th17细胞、Treg细胞水平,结果各组小鼠MPE中Th17、Treg细胞百分比均高于其外周血。与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组小鼠MPE和外周血中Th17细胞百分比升高,逐水饮组和逐水饮+顺铂组小鼠MPE和外周血中Treg细胞百分比降低。说明模型组小鼠MPE的微环境中Treg细胞较Th17细胞占优势,可能因为小鼠直接胸腔接种,肿瘤细胞生长过快,免疫功能受到明显抑制,Treg细胞升高较Th17细胞更加明显,使Th17/Treg平衡偏向Treg细胞,而逐水饮可逆转Th17/Treg细胞失衡状态。TGF-β是决定初始CD4+T细胞向Th17细胞或Treg细胞分化的关键细胞因子[19]。本研究观结果显示,与模型组比较,逐水饮组、顺铂组和逐水饮+顺铂组MPE和外周血中Th17细胞相关细胞因子IL-17、IL-23水平升高,Treg相关细胞因子TGF-β1水平降低。说明逐水饮可抑制TGF-β1分泌,促进Th17细胞分化及IL-17、IL-23表达,从而促进肿瘤免疫反应,消除胸腔积液。
综上所述,中药逐水饮具有一定抑制小鼠胸腔积液的作用,且与化疗药物联合应用时作用更加明显。小鼠MPE微环境中Th17细胞失衡,逐水饮能够促进Th17细胞分化及相关细胞因子表达,纠正微环境中Th17细胞失衡,减轻MPE微环境免疫抑制状态,增强对肿瘤的免疫作用,发挥治疗MPE作用。

