蟾龙镇痛膏对骨癌痛大鼠脊髓MAPK信号通路的影响∗
侯公瑾 柏正平 曾普华△ 潘敏求 蒋益兰 黄惠勇
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省中医药研究院,湖南 长沙 410006;3.抗肿瘤中药创制技术湖南省工程研究中心,湖南 长沙 410006)
恶性肿瘤已经成为严重威胁人类健康的一大疾病,癌性疼痛是中晚期癌症患者常见的症状,其中60%~80%的患者会发生癌性疼痛[1],而晚期患者中90%承受着中重度疼痛及爆发性疼痛[2],严重影响患者日常生活、睡眠、精神心理等。世界卫生组织WHO提倡“三阶梯止痛疗法”有效改善了癌性疼痛的治疗状况,但部分因药物治疗带来的副作用同样让人难以忍受。蟾龙镇痛膏是湖南省中医药研究院附属医院肿瘤科院内制剂,由湖南省名中医柏正平教授通过检索大量古今文献[3],结合全国名老中医潘敏求教授治疗癌性疼痛临床经验确立[4]。前期临床使用发现其对轻中度癌性疼痛具有较好疗效。本研究建立骨癌痛大鼠模型并以蟾龙镇痛膏进行干预,探讨蟾龙镇痛膏对大鼠的镇痛作用,并基于丝裂原活化蛋白激酶(MAPK)信号通路探讨可能的镇痛机制。
1 材料与方法
1.1 细胞与动物 实验用Walker256乳腺癌细胞株购于上海沪震生物科技有限公司。SPF级雌性SD大鼠50只,7周龄,体质量(200±10)g,购于长沙市天勤生物技术有限公司,合格证号:SCXK(湘)2014-0011。
1.2 试药与仪器 1)试药:蟾龙镇痛膏(湖南省中医药研究院附属医院药剂科制备;由蟾皮、生川乌、雄黄、芒硝、乳香、没药、血竭、醋延胡索、明矾、龙葵、冰片组成,外贴凝胶膏药,院内制剂生产批号20171212-02);扶他林(双氯芬酸二乙胺乳胶剂,北京诺华制药有限公司,国药准字H19990291)。磷酸化38蛋白(p-p38 MAPK)抗体(美国CST,货号#4511);磷酸化细胞外信号调节激酶(p-ERK MAPK)抗体(美国CST,货号#4370);β-actin抗体(美国Proteintech,货号60008-1-Ig);BCA蛋白定量试剂盒(美国Thermo Scientific,货号23227)。2)仪器:PVDF膜(美国Bio-RAD,货号1620177);电泳仪(美国Bio-RAD,货号164-5050);电泳槽(中国北京六一,货号DYCZ-24EN);转膜仪(中国北京六一,货号DYCZ-40A);电动玻璃匀浆器(日本新芝,货号DY89-1);台式冷冻离心机(中国深圳黑马,货号TGL-18R);热板测痛仪(中国浙江宁海白石电子医药仪器厂,货号GJ8402-0021);Von frey纤毛机械刺激针(美国North Coast,货号12775-99)。
1.3 分组与造模 将50只雌性大鼠随机分为空白组、模型组、蟾龙镇痛膏常规剂量组、蟾龙镇痛膏高剂量组和扶他林组,每组10只,除空白组外其他各组进行造模。造模用Walker256乳腺癌细胞悬液(细胞浓度为4×104个/mL),参照Medhurst[5]报道的方法建立骨癌痛大鼠模型。采用10%水合氯醛(300 mg/kg)对大鼠进行腹腔麻醉,仰卧位固定于操作台上,止血钳夹取四肢无反应后取1 mm微型骨钻于右侧后肢白色髌韧带下方胫骨上段部位打孔,刺入骨髓腔后用5 μL微量取样器注入含有Walker 256乳腺癌细胞悬液4 μL,注射完毕后用无菌骨蜡封闭钻孔,生理盐水冲洗,缝合伤口,消毒伤口后撒青霉素预防感染。对造模后的大鼠进行疼痛阈值评估验证造模是否成功。
1.4 给药方法 造模14 d后开始外敷相应药物:蟾龙镇痛膏常规剂量组(蟾龙镇痛膏0.56 g/kg)、蟾龙镇痛膏高剂量组(蟾龙镇痛膏1.12 g/kg)、扶他林组(双氯芬酸二乙胺乳胶剂0.08 g/kg)。蟾龙镇痛膏外敷大鼠背部中央去毛皮肤,医用橡皮胶带环周固定2圈,保证每日接触8 h以上;扶他林外涂大鼠背部中央去毛皮肤;每日10∶00给药1次,连续21 d。空白组、模型组不作任何干预。于温度(22±1)℃,湿度50%,12 h光照12 h黑暗环境饲养,自由摄食饮水。
1.5 标本采集与检测 1)大鼠胫骨HE染色。实验结束后,脊椎脱臼法处死大鼠取右侧胫骨,固定于4%多聚甲醛液体中,24 h后用10%EDTA(pH7.2),4℃脱钙处理;30 d后取大鼠右侧胫骨上端部位进行切片,60℃烤片12 h;将切片于二甲苯溶液中,放置3次,每次20 min。然后依次在100%、100%、95%、85%和75%乙醇,每级放置5 min。再用蒸馏水浸洗5 min;苏木素染10 min,蒸馏水冲洗,缓冲液返蓝;伊红染3~5 min,蒸馏水冲洗;梯度酒精(95%~100%)脱水,每级5 min。取出后于二甲苯溶液中放置2次,每次10 min,用中性树胶封片,于显微镜下观察组织形态。2)大鼠热痛觉缩足反射潜伏期(PWL)。实验开始后,每7天测试1次,测试时将热板测痛仪温度设定为55℃后将大鼠置于测试平台上,参照Yao[6]报道的方法,记录大鼠出现舔后足的时间为PWL,上限值为20 s以避免烫伤大鼠皮肤,取3次平均值,每次测试间隔5 min。持续至造模后35 d。3)大鼠机械痛觉缩足反射阈值(PWT)。实验开始后,每7天测试1次,测试时将大鼠放入底部为金属筛网的有机玻璃笼中适应5 min后,参照Chaplan[7]报道的方法,用Von Frey测痛纤丝垂直刺激大鼠后足底部中央皮肤,使纤丝弯曲至大鼠出现缩足反射,若未出现发射则更换更大强度测痛纤丝。从0.6 g开始,每个强度的刺激为5次,每隔15 s进行一次机械刺激,将出现缩足表现3次以上的最小Von Frey纤维强度记录为PWT,上限值为15.0 g。持续至造模后35 d。4)蛋白质印迹(Western blotting)法检测大鼠脊髓pp38、p-ERK表达。实验结束后,将大鼠处死,取脊髓L4~L6段取0.025 g,加入200 μL(含蛋白酶抑制剂)RIPA裂解液,置冰浴中匀浆机匀浆15~20 s,静置30 min,12000 r/min离心,4℃,15 min,将离心后的上清分装转移到0.5 mL的离心管中100℃加热5 min,BCA蛋白含量测定。将大鼠脊椎用液氮研磨后加入RIPA置于冰上裂解,并将裂解后的蛋白样品转移至100℃水浴加热5 min使蛋白变性。蛋白定量,统一总蛋白上样量为40 μg。聚丙烯酰胺凝胶电泳后将gel转移至PVDF膜上,恒流200 mA湿转105 min。将转膜后的PVDF膜封闭室温1h(封闭液:PBST+5%脱脂奶粉),分别加pp38、p-ERK抗体(兔抗鼠)按说明书,1∶1000稀释,4℃过夜。弃一抗,用含有0.05%Tween-20的缓冲液(PBS-T)洗膜3次,10 min/次,加入二抗(1∶5000稀释),室温孵育1 h。弃二抗,PBS-T洗去多余抗体,3次,10 min/次,加入发光显示液体,曝光。电泳条带经Image J软件处理,分析空白组、模型组条带与各对照组条带面积、灰度比值。
1.6 统计学处理 应用SPSS18.0统计软件。计量资料以(±s)表示,比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠胫骨病理HE染色比较 见图1。空白组组织结构未见异常,模型组镜下可见骨髓腔内充满大量肿瘤细胞,细胞结构、形态、大小差异明显,细胞核、质比异常,周围骨质结构部分缺失,骨小梁结构破坏,部分骨皮质可见肿瘤细胞,提示大鼠胫骨接种Walker256细胞建立骨转移模型成立。
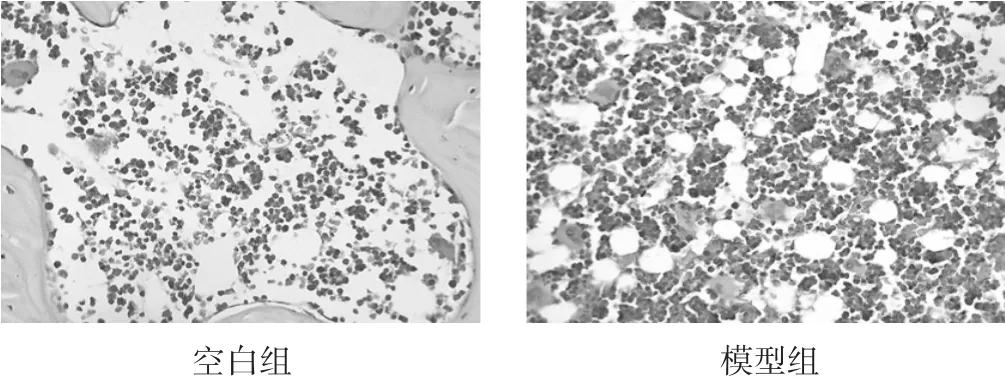
图1 胫骨病理比较(HE染色,400倍)
2.2 各组大鼠疼痛行为学比较 见表1~表2。造模后模型组、蟾龙镇痛膏常规剂量组、高剂量组PWL、PWT较空白组明显下降,提示大鼠疼痛阈值降低,骨癌痛大鼠模型造模成功;药物干预后蟾龙镇痛膏正常组、蟾龙镇痛膏高剂量组、扶他林组PWL、PWT较模型组上升(P<0.05),提示药物干预能提高大鼠疼痛阈值;蟾龙镇痛膏常规剂量组、高剂量组、扶他林组组间差异无统计学意义(P>0.05)。
表1 各组大鼠热痛觉缩足反射潜伏期(PWL)比较(s,±s)
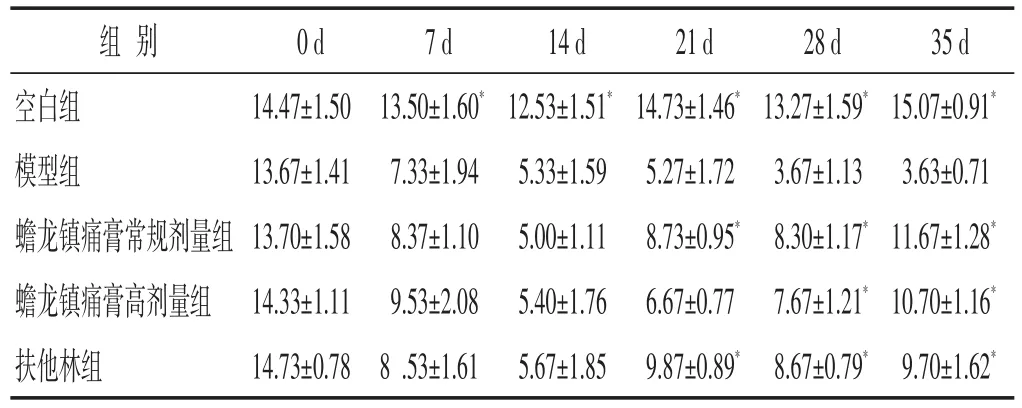
表1 各组大鼠热痛觉缩足反射潜伏期(PWL)比较(s,±s)
与模型组比较,∗P<0.05。下同
组别空白组模型组蟾龙镇痛膏常规剂量组蟾龙镇痛膏高剂量组扶他林组0d 14.47±1.5013.67±1.4113.70±1.5814.33±1.1114.73±0.787d 13.50±1.60*7.33±1.948.37±1.109.53±2.088.53±1.6114d 12.53±1.51*5.33±1.595.00±1.115.40±1.765.67±1.8521d 14.73±1.46*5.27±1.728.73±0.95*6.67±0.779.87±0.89*28d 13.27±1.59*3.67±1.138.30±1.17*7.67±1.21*8.67±0.79*35d 15.07±0.91*3.63±0.7111.67±1.28*10.70±1.16*9.70±1.62*
表2 各组大鼠机械痛觉缩足反射阈值(PWT)比较(s,±s)

表2 各组大鼠机械痛觉缩足反射阈值(PWT)比较(s,±s)
组别空白组模型组蟾龙镇痛膏常规剂量组蟾龙镇痛膏高剂量组扶他林组0d 11.22±2.9312.86±2.2512.24±2.6811.20±1.6411.82±1.027d 11.60±1.42*6.62±2.897.64±1.596.12±1.817.34±2.5814d 11.24±1.78*4.24±1.084.40±2.784.84±2.204.86±1.4921d 11.26±2.84*3.84±1.338.72±1.48*9.86±2.29*9.52±2.77*28d 12.46±1.59*3.54±2.8811.52±2.67*9.22±2.34*10.14±2.91*35d 12.86±1.63*4.52±1.5312.14±1.13*12.46±2.86*11.08±1.56*
2.3 各组大鼠脊髓p-p38、p-ERK表达比较 见图2,图3,表3。模型组p-p38、p-ERK表达较空白组、蟾龙镇痛膏常规剂量组、蟾龙镇痛膏高剂量组和扶他林组明显上升(P<0.05),提示骨癌痛大鼠模型中MAPK信号通路中p-p38、p-ERK大量激活,药物干预后,能够抑制p-p38、p-ERK的表达,其中ERK2较ERK1更明显。
3 讨论
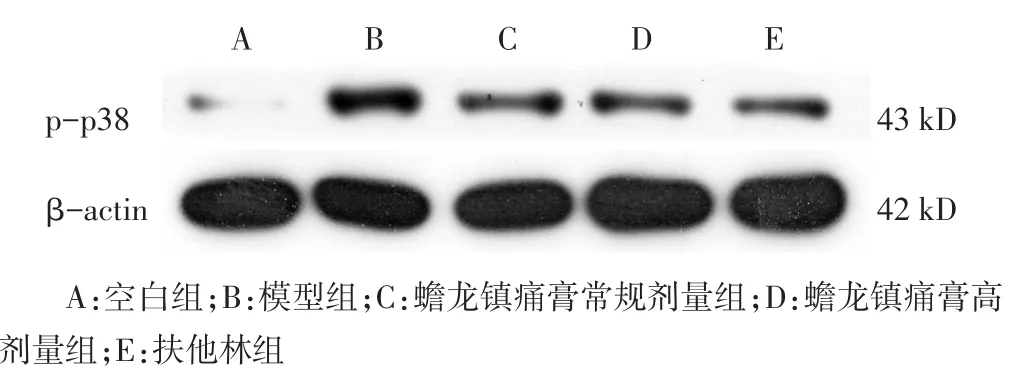
图2 各组大鼠脊髓p-p38灰度图

图3 各组大鼠脊髓p-ERK灰度图
表3 各组大鼠脊髓p-p38、p-ERK表达比较(s,±s)
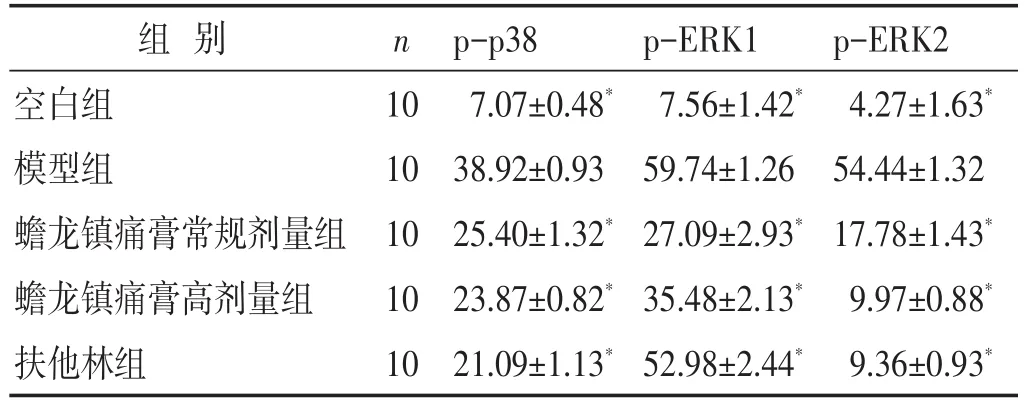
表3 各组大鼠脊髓p-p38、p-ERK表达比较(s,±s)
组别空白组模型组蟾龙镇痛膏常规剂量组蟾龙镇痛膏高剂量组扶他林组n 1010101010 p-p387.07±0.48*38.92±0.9325.40±1.32*23.87±0.82*21.09±1.13*p-ERK17.56±1.42*59.74±1.2627.09±2.93*35.48±2.13*52.98±2.44*p-ERK24.27±1.63*54.44±1.3217.78±1.43*9.97±0.88*9.36±0.93*
近年来研究发现MAPK信号通路在癌性疼痛的产生发展过程中具有重要作用[8-9]。在各种伤害性疼痛产生过程中p38/MAPK大量活化,引起磷脂酶A2产生花生四烯酸,诱导细胞外前列腺素E2增加,刺激神经元引起疼痛[10];在脊髓中p38/MAPK信号通路可以通过激活核因子κB(NF-κB)影响基因转录,促使小胶质细胞释放IL-1β、TNF-α、IL-6,激活神经元上相应受体,引起疼痛在中枢的传递[11]。有文献表明,ERK/MAPK通路参与了痛觉超敏的过程,引起疼痛效应的放大[12],在注射完全弗氏佐剂形成的关节炎模型中,使用MEK(ERK上游激酶)抑制剂PD98059可以明显减轻关节炎模型痛觉超敏[13]。本实验中发现,骨癌痛大鼠模型中p-p38、p-ERK1/2表达明显上升,提示了其在骨癌痛的发生发展中扮演了重要角色,而使用蟾龙镇痛膏、扶他林干预后,大鼠痛阈下降,脊髓p-p38、p-ERK1/2表达下降,提示了蟾龙镇痛膏和扶他林可以抑制脊髓p-p38、p-ERK1/2的活化。
临床上目前对癌性疼痛的治疗主要采用WHO提倡的“三阶梯”止痛疗法,其有效降低了癌痛患者的症状[14]。扶他林属于第一阶梯非甾体抗炎镇痛药,可以抑制前列腺素合成,从而降低炎性介质的释放,临床上对于各种类型疼痛具有比较好的疗效,对于轻中度骨癌痛也有一定疗效[15],但也有诸多不良反应,如肝肾功能损伤、恶心呕吐、皮肤过敏、消化道溃疡、出血等。第二、三阶梯阿片类镇痛药物也同样有恶心呕吐、便秘、呼吸抑制等不良反应,同时具有明显的药物依赖作用,随着病情的进展,常常会引起剂量的不断增加[16]。中医学自古就有各种治疗疼痛的记载,包括中药内服法、外治法、针刺法、艾灸法等多种治疗方式,其中外治法也包含外用膏药、擦剂、穴位敷贴等多种形式,在临床中运用较多。外用膏药可以避免内服药对集体的刺激[17],效果也较内服法更加明显[18],在临床适用于肿瘤患者,具有简便实用、疗效可靠、安全性高的特点。
蟾龙镇痛膏以性味辛温,行气通络止痛的雄黄、生川乌、血竭、醋延胡索为君药;其中雄黄辛温散结止痛,川乌性热味苦,可增强温通的疗效,麻醉止痛;血竭活血止痛,散瘀生新;延胡索性温,味辛苦,与诸药性味相合,是止痛专用药,四药合用,可温阳散结、行气止痛。蟾皮、芒硝、龙葵等化痰散结、利水消肿、解毒止痛,能化络脉痰浊之邪,达到通络止痛的目的。辅以乳香行气通络、活血止痛,没药散瘀止痛;加用冰片、明矾辛香的药物,芳香走窜,增强皮肤渗透效果以利透皮吸收,也是止痛良药,可清热止痛,消肿定痛,并中和诸多温燥药物,以达更好的治疗功用,又可助其他药物吸收扩散,上述组成使本方寒热并用,通络止痛,更具解毒散结功效,以透皮药物为引药直达病痛之所,共奏解毒散结,活血行气,通络止痛之功效。
本研究初步证实蟾龙镇痛膏对骨癌痛大鼠具有提高疼痛阈值的作用,同时可降低脊髓p-p38、p-ERK1/2表达。其镇痛作用的机制可能与抑制脊髓MAPK信号通路中p38、ERK1/2活化有关,为探索蟾龙镇痛膏镇痛作用机制奠定了一定基础,同时为临床应用蟾龙镇痛膏治疗癌性疼痛提供了依据。临床治疗癌性疼痛应通过中西医结合综合治疗的方式,重视辨证与辨病相互结合才能获得较好的效果。但蟾龙镇痛膏组方药物较多,其有效成分及镇痛机制仍需进一步通过实验探索证实。

