基于α-突触核蛋白原纤维的帕金森氏疾病模型的研究进展
罗海玉,吴正存,马开利
(1.中国医学科学院&北京协和医学院,医学生物学研究所,药物安全性评价研究中心,昆明 650118;2.中国医学科学院&北京协和医学院,医学灵长类研究中心&神经科学中心,北京 100005)
帕金森氏病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,发病率仅次于阿尔兹海默症[1],其主要的临床症状表现为运动功能障碍和静止性震颤,并且常伴随有抑郁和睡眠障碍等非运动症状[2]。一旦发病,将对患者的身心造成严重损害,同时,给整个家庭带来巨大的经济和精神负担。PD的主要病理学表现为中脑多巴胺能神经元死亡和纹状体损失,主要的病理学标志为中脑黑质致密部形成的路易小体(Lewy bodies,LBs)[1, 3]。LBs是黑质致密部可见部分的一种球状包涵体,主要成分为部分中空的放射状淀粉样纤维,而该淀粉样纤维的主要成分为α-突触核蛋白(α-synuclein,AS)[3]。
1988年,Maroteaux等人[4]在电鲟体内首次发现了AS的存在,并且确定了其位于突触前末梢和核周。随后,AS被证实是LBs的主要成分并且与PD的发生有密切的关系,并且越来越多的研究将AS作为了PD致病机制研究中的关键蛋白。近年来,有大量研究表明,异常聚集的AS具有类朊病毒样的传播特性,其能够在神经元细胞之间进行传播,导致脑内更多AS聚集体的产生,最终造成大脑中负责运动区域的神经元死亡[5-6]。于是,研究者们将AS原纤维接种于原代神经元细胞,发现诱导产生了大量包涵体并且发现其磷酸化水平明显升高[7]。同时,利用AS原纤维建立的PD动物模型能诱导产生大量类LBs的包涵体,与PD病人的病理特征相类似[8]。更重要的是,相比于传统的神经毒性模型和过表达AS的转基因模型,利用AS原纤维建立的PD模型,所诱导产生的内源性AS的水平更接近于人类的生理水平并且其病理变化更类似于人类的病症[8]。因此,利用AS原纤维建立PD模型,将有望成为研究体内PD样LB病理学的通用造模方法。因此,本文就基于AS原纤维的帕金森氏疾病模型的研究进展进行综述。
1 AS的结构及传播
1.1 AS的结构
AS是一种由140个氨基酸残基组成的蛋白质,分子量约为14 × 103。AS具有独特的结构(如图1),其中1 ~ 60号残基为N-末端(氨基端),介导了AS与脂质膜的结合[9];60 ~ 95号残基为NAC结构域,该区域被认为是检测AS聚集的重要指标[10]。1 ~ 95号残基共同组成了脂质结合结构域,包括了7个11-mer(11个氨基酸残基)的重复序列,KTKGEV为其共有序列,与载脂蛋白类似,形成两个α-螺旋、三个转角[9-10]。所有与突触核蛋白病相关的已鉴定的突变位点都位于该区域:A30P、E46K、H50Q、G51D、A53E和A53T[11]。AS的96 ~ 140号残基为C-末端(羧基端),是高度酸性的不规则卷曲结构,也是各种翻译后修饰的靶标[12]。C-末端是AS与各类蛋白质、离子、聚阳离子相互作用的部位,同时也调节了AS的膜结合,以及保护AS免于聚集[13]。
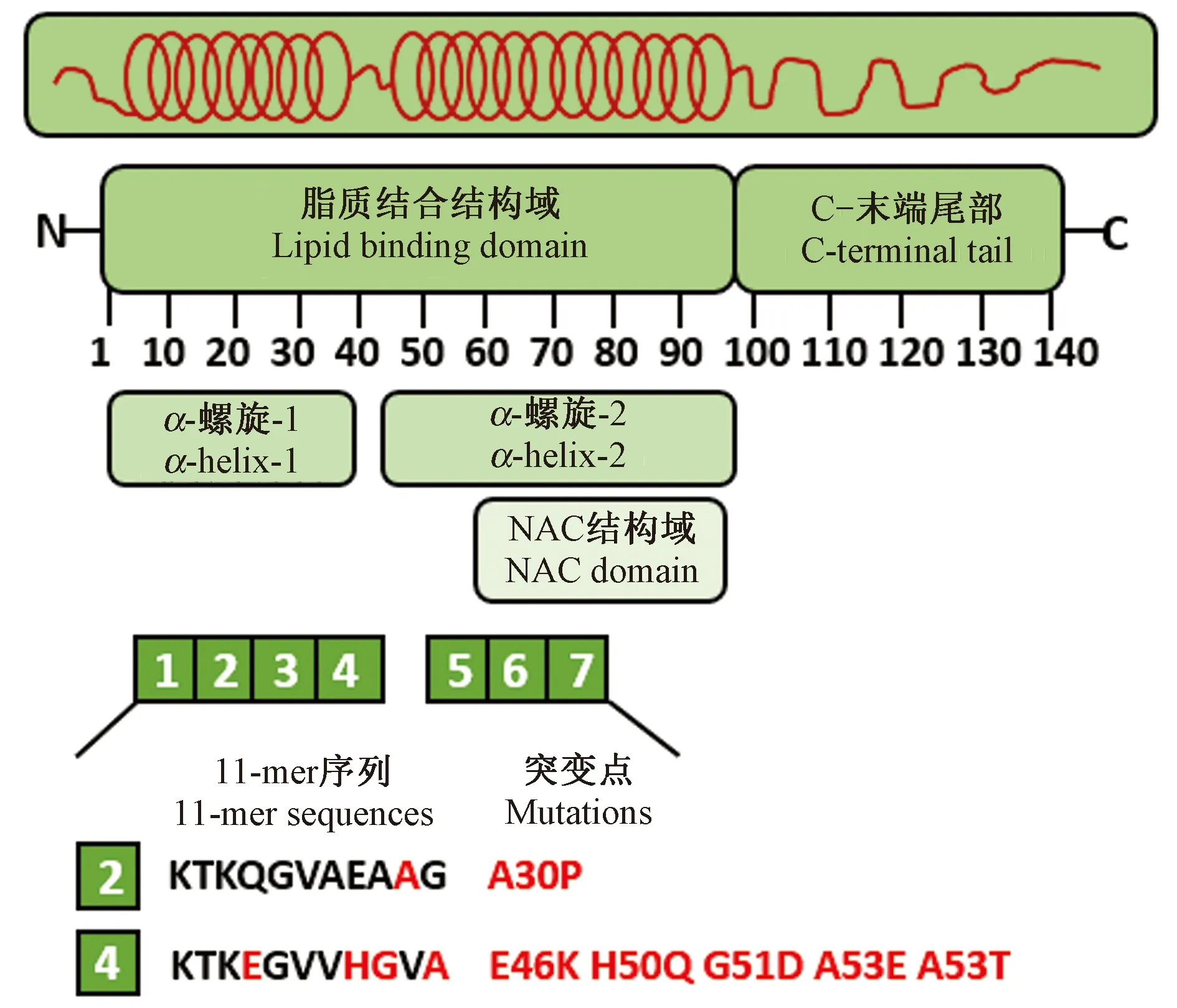
注:在与脂质膜结合后,AS的N-末端结构域折叠成两个两亲性螺旋;AS的C-末端尾部不会促进膜结合。脂质结合结构域可以分成七个高度保守的11-mer序列。α-螺旋-2包含易聚集的NAC结构域。AS的所有疾病相关突变位于第二和第四11-mer伸展中。图1 AS的结构域示意图Note. Upon binding to the lipid membrane, the N-terminal domain of AS folds into two amphipathic helices; the C-terminal tail of AS does not promote membrane binding. The lipid binding domain can be divided into seven highly conserved 11-mer sequences. α-Helix-2 contains a cluster of NACs that are susceptible to aggregation. All disease-associated mutations in AS are located in the second and fourth 11-mer stretches.Figure 1 Schematic diagram of the AS domains
1.2 AS在体内的生理病理构象及传播
正因为AS的结构特性,导致了其在体内的构象容易发生改变(如图2),AS的异常构象对于PD病理学的传播和神经元功能障碍来说至关重要。AS本质上是一种无序的蛋白质,正常生理状态下是自然伸展的单体形式,但是不同的环境条件会影响其构象的可塑性。AS单体在体内以两种状态存在,即可溶状态(天然非结构化)和膜结合状态(部分螺旋构象)。当体内环境改变时,天然非结构化的单体可以通过部分折叠的成核结构转化为寡聚体,寡聚体最终会转化为高度有序的β-折叠淀粉样蛋白原纤维,但目前寡聚体的转化机制尚不清楚[14]。天然非结构化蛋白质也会形成无序结构,这导致了其他无序聚集体的形成[15]。AS的这种聚集倾向正是导致PD的主要原因之一。另外,高度有序的AS原纤维具有类朊病毒样传播特性,会形成原纤维种子,在神经元细胞之间进行传播[16]。
AS会在体内传播的首次报道来自于一位有22年PD病史的患者,为了减轻纹状体多巴胺的损失,其在1993年接受了6.5 ~ 9周龄的胚胎干细胞移植[17]。2008年,也是其移植手术的14年后,研究者们在其中脑黑质内新移植的神经元细胞中检测出了LBs[17-18]。随后,研究者们在小鼠体内对这一现象进行了验证,发现注射了AS原纤维的小鼠脑内出现了大量具备PD病理特征的LBs样包涵体[19]。已有研究表明,原纤维种子从一个细胞到另一个细胞的传播可通过直接穿透、内吞作用或受体介导的转运等多种方式发生[20-21]。最新研究表明,原纤维的生长和传播在AS介导的细胞凋亡和细胞死亡中发挥着核心作用,研究如何抑制原纤维的生长传播对PD和其他神经系统退行性疾病的治疗有重要意义[22-23]。然而,驱动原纤维种子传递和增殖的生理化学条件以及控制体内聚集体生长和扩增速率的因子至今仍不清楚。
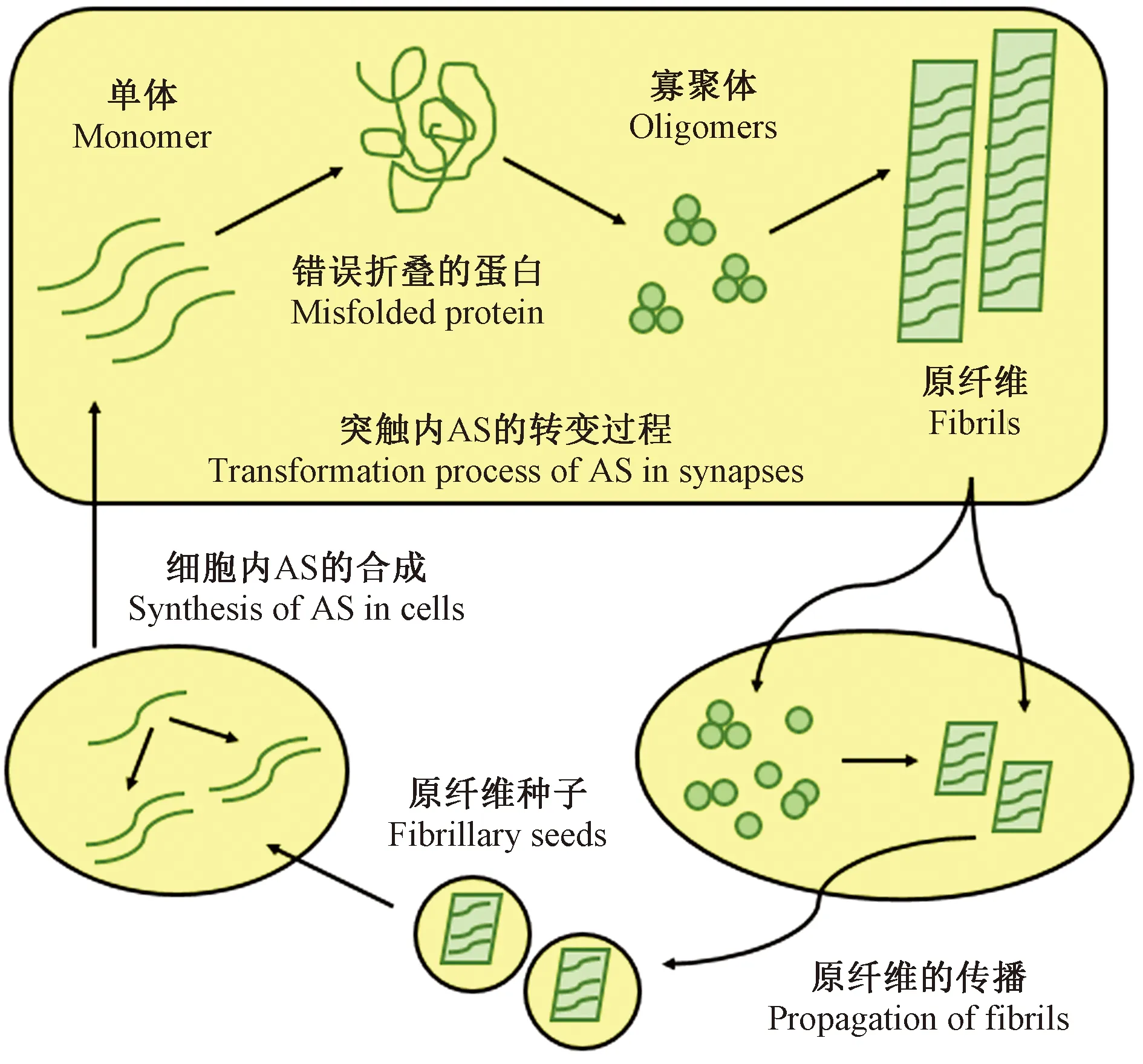
注:正常生理状态下,细胞溶质中的AS是自然伸展的单体形式。在与突触小泡结合后,AS发生错误折叠,N-末端残基变为螺旋结构。病理状态下,错误折叠的AS发生聚集形成具有细胞毒性的寡聚体,同时,AS会转化为含β-折叠的原纤维,最终形成淀粉样蛋白原纤维。AS原纤维会形成原纤维种子,在神经元细胞之间进行传播,促进细胞内可溶性AS的合成。图2 AS在体内的生理病理构象及传播过程Note. Under normal physiological conditions, the cytosolic AS naturally occurs in the monomeric form. After binding to synaptic vesicles, AS misfolds and the N-terminal residue becomes a helical structure. Under pathological conditions, misfolded AS aggregates to form cytotoxic oligomers and is converted to β-sheet-containing fibrils, eventually forming amyloid fibrils. AS fibrils form fibril seeds that propagate between neuronal cells and promote the synthesis of soluble AS in cells.Figure 2 Physiological and pathological conformation and propagation of AS in vivo
2 基于AS原纤维的PD模型的研究进展
2.1 基于AS原纤维的细胞模型
基于AS原纤维的传播特性,尤其能诱发一系列接近人生理病理的PD特征,采用AS原纤维制备各种细胞、动物模型成为了PD造模中的一大热点。2009年,Luk等[24]首次将外源性的重组AS原纤维添加到过表达AS的哺乳动物细胞系内(QBI-HEK-293和SH-SY5Y),建立了AS原纤维的细胞模型,发现触发了细胞内可溶性的AS发生聚集,同时磷酸化和泛素化水平都上调。该AS原纤维的细胞模型概括了PD病人脑中LBs的关键特征。相比于传统的PD神经毒性模型和过表达AS的腺相关病毒系统模型[25-26],AS原纤维的PD细胞模型的优点是可以在培养的原代神经元中产生类似真正的路易体和路易神经突的包涵体。2011年,Volpicelli-Daley等[27]将外源性的AS原纤维接种于原代神经元细胞,发现诱导了路易体病变,并最终导致了突触功能障碍和神经元死亡。随后,其又发现AS原纤维会被神经元摄取,最终导致内源性的AS发生聚集并形成LBs,所产生的包涵体首先在轴突当中形成,然后逐渐扩散到体细胞和树突当中[28]。更加有趣的是,AS原纤维也能被星形胶质细胞摄取(胞吞作用),并且能够在原代神经元细胞和星形胶质细胞之间进行传播,对细胞造成毒性作用[29]。在接种外源性AS原纤维的原代神经元细胞中,外源性的AS原纤维诱导了内源性表达的AS形成包涵体,与人类的PD病理特征非常相似。同时,最新研究表明,AS原纤维对原代神经元的细胞毒性程度强于细胞系的毒性作用[30]。
由于AS原纤维独特的传播特性以及其能够作为高效建立PD细胞模型的全新材料,越来越多的研究者开始对其进行深入的研究。2019年,Tanaka等[31]发现当AS发生自发聚集时,会形成不同结构的多态性原纤维;而将AS进行接种时,则会产生具有传播特性的原纤维种子。在AS原纤维的PD细胞模型中,当原纤维接种于原代神经元7 d后,发现神经元中自发性的Ca2+瞬变的频率和幅度都会减小[32],并且当神经元还未死亡时,轴突中的内含物便会选择性地损害携带TrkB受体和LC3阳性自噬体内体的轴突运输,导致轴突转运功能损伤[33]。该研究提示,神经毒性和突触功能相关指标的监测可以作为PD风险防范的临床前的诊断方式之一。
但是,AS原纤维究竟是通过什么途径在细胞内发挥功能的,仍不清楚。最近,有研究者发现,小胶质细胞的自噬是由AS原纤维持续积累引起的溶酶体损伤引起的[34]。最新研究发现,内化的AS原纤维会导致溶酶体活性受损,但对蛋白酶体活性和线粒体在受体细胞中的稳态不会造成影响[35]。与此相反,也有大量研究表明,AS原纤维会优先与线粒体结合,最终导致线粒体功能障碍[36-37]。这些研究结果提示,或许可以将细胞器作为介入的靶点,进一步研究AS原纤维在PD中的作用机制。
2.2 基于AS原纤维的动物模型
正如上文所提到的,AS原纤维的PD细胞模型可以诱导产生类LBs和路易神经突的包涵体。随后,研究者们将AS原纤维定位注射于小鼠(以及大鼠)脑内,发现小鼠的海马、皮质、中脑以及其他的大脑区域的神经元中都出现了类LBs的包涵体[38-39],这可帮助我们更好地去研究不同神经元群体的功能。因为不需要转基因过表达人AS,所以相比于传统的过表达AS的腺相关病毒系统模型[26],利用外源性的AS原纤维建立PD动物模型的优点是可以直接利用基因敲除或转基因小鼠研究任何我们感兴趣的基因对聚集体形成的影响。
至今,越来越多的研究者通过实验证实了该模型的有效性和可操作性。Paumier等与Suzukake等[38, 40]将超声后的AS原纤维注射到小鼠(和大鼠)的纹状体、SNpc、内嗅皮质,甚至是小鼠(和大鼠)的肌肉中,发现无论注射部位如何,AS包涵体不仅会在注射部位形成,同时也会出现在远离注射部位的其他脑区,并且注射后4周,可检测到小鼠30%的TH阳性神经元发生了损失(大鼠50%),另外,即使当原纤维仅注射在纹状体的单侧且AS包涵体仅出现在注射侧时,另外一侧也能检测出神经元损伤和功能障碍[38]。
利用这一模型,Tran等[41]发现使用针对病理性AS的抗体可以防止AS的扩散和毒性作用的产生。他们的研究发现,在接受原纤维注射的小鼠中,注射单克隆抗体减少了病理性AS的产生,并且SNpc中的多巴胺能神经元损失减少,运动行为也得到了改善[41]。因此,基于AS原纤维的PD动物模型的这些实验证明了免疫疗法有可能成为预防PD的全新疗法。基于以上研究结果,Luan等[42]将AS原纤维模型用于研究慢性咖啡因的治疗效果,发现慢性咖啡因治疗降低了pSer129的聚集、神经元细胞的死亡以及小胶质细胞、星形胶质细胞的激活,并且还发现该治疗可以选择性地逆转由AS诱导以及分子伴侣介导的自噬缺陷。这些发现提示了一种与环境因素相关的通过靶向自噬途径来治疗PD的新型药理学疗法。2019年,Bieri等[43]使用AS原纤维的PD模型,对与AS聚集有关的修饰物进行了与PD相关的风险基因的靶向遗传筛选,发现LRRK2和GBA基因的表达下调,会促进小鼠原代神经元中的AS发生聚集;并且,在过表达与PD连锁的LRRK2突变基因的小鼠中检测到了AS的聚集。同时,也有研究者发现内源性LRRK2蛋白的减少,会降低该PD模型中AS包涵体的形成[44]。这些研究揭示了LRRK2蛋白在PD中的重要作用,并且提供了一种潜在的PD治疗策略。
3 结语
总而言之,开发PD模型的目的是为了了解疾病是如何发展,以及如何采取有效的措施减缓或阻止疾病的发生。PD的AS原纤维模型概括了PD的许多特征:神经元丢失、具有生物化学和形态学特征的包涵体、类LBs和路易神经突、整个大脑的病理学扩散以及运动行为缺陷等[45-46]。另外,相比于传统的PD神经毒性模型和过表达AS的腺病毒系统模型,PD的原纤维模型表现出了显著的优越性[45, 47]。因此,基于AS原纤维的PD模型大大提高了我们对PD的理解。

