高频右心房起搏建立犬心房颤动模型和植入式心电监测器的评估
赵璐露,华宝桐,陈丽玲,蒲里津,代荣俗,徐永玄,郭 涛,赵 玲*
(1.昆明医科大学第一附属医院,昆明 650032; 2.昆明医科大学,昆明 650500;3.云南省阜外心血管病医院,昆明 650106)
心房颤动是临床上最常见的快速性心律失常,由于心房丧失了有效的舒缩功能,导致患者生活质量下降、继发导致心力衰竭、心律失常性猝死和缺血性脑卒中等疾病[1],其具有很高的发病率及死亡率[2],已成为严重威胁人类健康的慢性非传染性心血管流行病。随着基础和临床研究的不断深入,心房颤动的诊治能力得到显著提高,发生和发展机制也逐渐被阐明,但房颤的诊疗仍不容乐观,导致了对房颤机制及新疗法的研究迫在眉睫。为了更好更全面的深入研究心房颤动的发生机制,稳定的心房颤动动物模型的建立对于研究心房颤动的机制以及治疗方法有重要的意义。
本研究中通过心房快速起搏的方法建立稳定的慢性心房颤动的动物模型,在建立模型的过程中,借助SelectSecure系统,将直径仅为4.1 Fr的细双极实心电极导线3830主动固定电极建立心房快速起搏系统[3],同时运用植入式心电监测器,检测、记录心房颤动的发生,提高高频起搏建立心房颤动模型的效率。
1 材料和方法
1.1 实验动物
12只SPF级成年比格犬,年龄为7~12个月,雌雄不限,体质量12~16 kg,由昆明医科大学实验动物中心提供(购自重庆市中药研究院实验动物研究所[SCXK (渝)2012-0006])。动物饲养于昆明医科大学动物实验中心比格犬饲养动物房[SYXK (滇) K2015-0002],常规饮食,光照保持昼夜节奏各12 h,温度控制在20℃~25℃,相对湿度控制在50%~70%。本研究获得昆明医科大学动物实验伦理审查委员会审核批准(伦理批准号:KMMU2018022,批准时间:2016年1月)。遵循国家卫生研究院实验动物护理和使用概述的指导原则,按照实验动物使用的3R原则给予人道的关怀。
实验用比格犬随机分为空白对照组(6只)和心房颤动模型组(AF组,6只),所有的犬在术前使用电推剪备皮,备皮部位包括双侧颈部、双侧腹股沟区、前胸部、腰背部L2~3区及四肢。
1.2 主要试剂与仪器
戊巴比妥钠(美国Fluka公司进口分装);甲醛(上海生工生物);戊二醛(上海生工生物)。房颤模型起搏器(中国陕西秦明公司);8631起搏系统程控仪(中国陕西秦明公司);SelectSiteTM鞘管系统(美国美敦力公司,C304 S-59);SelectSecureTM电极导线(美国美敦力公司,3830-59 cm);植入式心电监测器Reveal LINQ(美国美敦力公司);Vivid q型彩色多普勒心脏彩色超声诊断仪(美国GE公司);体表12导心电图仪(美国Marquet);普通光镜Olympus-CX31(日本奥林巴斯公司);电镜(日本株式会社)。
1.3 实验方法
1.3.1 建立犬右心房快速起搏系统
对进行心房颤动模型制备的实验犬(AF组)进行常规备皮后,侧卧于导管床上,给予鼻导管维持低流量吸氧,以3%戊巴比妥钠30 mg/kg静脉麻醉,以每小时2 mg/kg维持麻醉。在手术过程中,持续监测体表标准肢体导联心电图,心率,血压氧饱和度等生命体征指标。在无菌操作下,穿刺右侧颈外静脉,送入配套长100 cm的“J”型导引钢丝至下腔静脉,将SelectSiteTM鞘管系统组装完成,沿导引导丝送入右心房,而后导引导丝缓慢地移除,鞘管使用肝素水进行冲洗,将直径仅为4.1 Fr的细电极导线准确插入止血阀,推送电极导线至螺旋进入鞘管顶端的黑色Mark标记处,旋转3830螺旋电极,将其在高位右心房处定位并固定鞘管,缓慢推进电极导线直至螺旋环超出导管2~3 cm并接触到心房肌壁,以顺时针的方向将电极导线旋转3~4圈,X线透视下确认导线固定,测试起搏电极参数(包括阈值、脉宽、感知、阻抗等),参数满意后撤出鞘管并固定电极导线;将电极与起搏器连接,将埋藏式高频率(频率90~810次/min)房颤模型起搏器埋藏于颈前外侧的囊袋内(图1)。确认生命体征正常后,术后注射青霉素800 000 U 3 d,预防感染。空白对照组实验犬不建立犬右心房快速起搏系统。
1.3.2 心房颤动动物模型的建立
术后进行心房颤动模型的建立,运用体外起搏器系统程控仪将高频房颤模型起搏器程控为AOO起搏模式,设置起搏器的输出、脉宽,均为所测阈值的两倍。将起搏器的基础刺激频率从90次/min起始设置,观察实验犬呼吸、心率、饮食等基本状况,是否出现心衰的相关症状及其他异常征象,当实验犬呼吸急促,听诊心率快,不思饮食,四肢冰凉等情况时,多考虑实验犬出现心衰症状。根据实际情况,持续性或间断性地进行右心房高频起搏,逐步调整起搏刺激频率,每次增加幅度为10~20次/min,每周分别描记一次标准肢体导联心电图,程控心脏起搏器起搏状态,结合植入式心电监测器Reveal LINQ追踪器所记录数据,高频起搏直至关闭房颤模型起搏器起搏功能后,可在不需要心房程序性刺激诱发下,通过所记录的标准肢体导联心电图,当心电图表现为P波消失,代之以大小、形态及时限均不规则的颤动波,心室律不规整时,提示出现心房颤动[4],判定房颤模型建立成功,持续时间大于15 min的房颤定义为持续性房颤[4]。
1.3.3 Reveal LINQ追踪器的植入
AF组实验犬植入心电监测器Reveal LINQ。实验犬呈仰卧位,常规在前胸部消毒,进行铺巾,定位于胸部第四至第五肋间,于胸部正中线左缘2 cm,与胸部正中线呈45°夹角,定位成功后,利多卡因进行局部麻醉,以特质手术刀切开皮肤,使用分离工具分离皮下组织形成植入通路,最后以植入心电监测器配套注射工具注入心电监测器Reveal LINQ(图2)。术后进行程控,设置追踪器工作参数,将“AT/AF Detection”设置为“AF Only”,记录AF负荷。
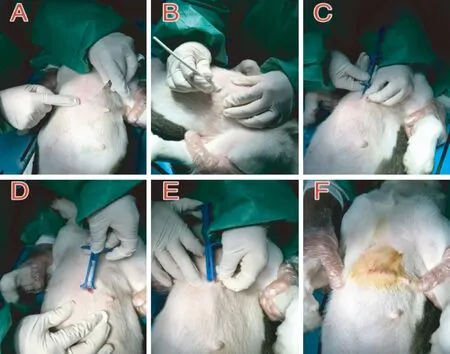
注:A:实验犬仰卧于手术台上,将植入部位定位于胸部第四至第五肋间,正中线左缘2 cm;B:以特质手术刀切开皮肤;C:使用分离工具分离皮下组织;D:使用分离工具分离皮下组织后形成植入通路;E:用配套注射工具注入植入式心电监测器Reveal LINQ;F:成功植入心电监测器Reveal LINQ。图2 Reveal LINQ追踪器的植入Note. A, The experimental dog was supine on the operating table. The implantation site was located between the fourth and fifth ribs of the chest, 2 cm from the left margin of the median line. B, A skin incision was made with a special scalpel. C, The subcutaneous tissues were separated with a separating tool. D, An implantation pathway was formed after the subcutaneous tissues were separated by a separating tool. E, The implanted ECG monitor, Reveal LINQ, was injected with matching injection tools. F, The Reveal LINQ was successfully established.Figure 2 The implantation of Reveal LINQ
1.3.4 超声心动图的检查
入选实验的比格犬在术前均进行超声心动图的检查(采用心脏彩色超声显像仪,探头发射频率2.5 MHZ),AF组的实验犬分别在房颤模型成功建立后、处死前进行超声心动图检查;对照组实验犬均进行同期超声心动图检查。在心尖四腔切面测量双心房面积,取3~5个心动周期测量参数,取平均值。
1.3.5 处死实验犬并采集组织标本
处死两实验组实验犬后,于其胸部正中线,逐层开胸,取出心脏,分离采集左心房组织标本备检。进行形态学光镜观察的标本以10%甲醛固定,制作石蜡切片;进行形态学电镜观察的标本以2.5%戊二醛固定,用于电镜切片观察,进行免疫组化检测的标本用4%多聚甲醛固定。
1.4 统计学方法
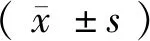
2 结果
2.1 实验整体情况
整个实验中共纳入12只犬,在建模过程中死亡2只,其余10只实验犬完成实验。AF组实验犬均成功植入高频率房颤模型起搏器建立房颤模型系统,并均植入心电监测器Reveal LINQ。在AF组建立房颤模型过程中,有2只实验犬在建模过程中猝死,根据Reveal LINQ追踪器数据提示,发生室性恶性心律失常。空白组6只犬均存活。
2.2 心房颤动建模中房颤诱发时间及建模成功率
AF组成功植入高频率房颤模型起搏器,在可无需心房程序性刺激,自身出现心房颤动(图3)。建立成功诱发出心房颤动的时间为(10.63±2.13)周;房颤模型建立成功时,在AOO起搏模式下,高频房颤模型起搏器心房刺激频率为(588.75±11.26)次/min。
2.3 植入式心电监测器动态追踪记录房颤负荷的比较
通过运用植入式心电监测器Reveal LINQ动态追踪记录房颤负荷,用以监测心房颤动的发生的房颤的负荷变化。房颤负荷的定义是AT/AF的总发作时间。当程控为“AF Only”时,AT/AF时间报告的是AF事件时长,即当Reveal LINQ追踪器程控为“AF Only”时,房颤负荷的定义为AF的总的发作时间[5](图4)。
在建立的心房颤动模型中,运用该植入式心电监测器动态追踪记录房颤负荷,结合描记标准肢体导联心电图结果提示,有3只实验犬为阵发性心房颤动,1只实验犬房颤负荷可达99.9%,同时行体表心电图检查,为心房颤动心电图表现,提示该实验犬运用快速心房起搏的方式成功建立心房颤动模型,且呈持续性房颤。

注:A、B:实验犬术前心电图,窦性心律;C、D:通过快速心房起搏建立心房颤动模型;E、F:在心房颤动模型建立中,当高频房颤模型起搏器心房刺激频率为500次/min时,关闭起搏器后,心电图呈窦性心律,心动过速,P波高尖;G、H:心房颤动模型建立成功,心电图表现为P波消失,代之以大小、形态及时限均不规则的颤动波,心室律不规整。图3 心房颤动模型建立过程心电图及建模成功后心电图Note. A and B, Electrocardiograms were performed before the operation of the experimental dogs, showing a sinus rhythm. C and D, Atrial fibrillation models were established by rapid atrial pacing. E and F, In the establishment of the atrial fibrillation model, the atrial stimulation frequency of the pacemaker in the high-frequency atrial fibrillation model was 500 beats per min. After closing the pacing function of the pacemaker, ECG showed a sinus rhythm, tachycardia and peaked P waves. G and H, Atrial fibrillation models were successfully established. The electrocardiogram showed that the P wave disappeared and was replaced by an irregular tremor wave with an irregular size, shape and time limit, and an irregular ventricular rhythm.Figure 3 ECG during and after the establishment of the atrial fibrillation model

图4 植入式心电监测器Reveal LINQ记录房颤事件报告Figure 4 Atrial fibrillation events recorded by the implantable ECG monitor, Reveal LINQ
2.4 超声心动图检测实验犬左心房及右心房面积比较
采用心脏彩色超声显像仪,探头发射频率2.5 MHZ对入选实验的比格犬进行超声心动图的检查,经心尖四腔测量左、右心房收缩末期心房面积(图5)。
注:A:对左心房面积的测量;B:对右心房面积的测量。图5 超声心动图测量左心房及右心房面积Note. A, Measurement of the left atrial area. B, Measurement of the right atrial area.Figure 5 The areas of the left atrium and right atrium were measured by echocardiography
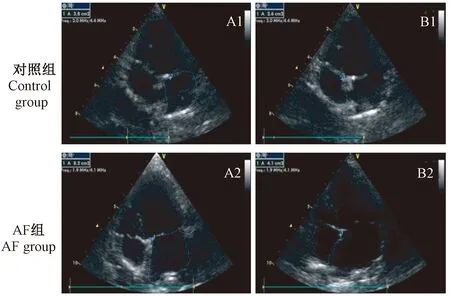
经配对t检验,心房颤动建模成功后,AF组实验犬在房颤模型成功建立后与建模前相比较,左心房面积明显增大[(8.20±0.83) cm2与(3.80±0.08) cm2相比,P<0.05];右心房面积增大[(4.52±0.44) cm2与(2.75±0.96) cm2相比,P<0.05](表1)。
经配对t检验,AF组实验犬在房颤模型成功建立后与对照组相比较,左心房面积明显增大[(8.20±0.83) cm2与(3.72±0.15) cm2相比,P<0.05];右心房面积增大[(4.52±0.44) cm2与(2.78±0.18) cm2相比,P<0.05](表2)。
2.5 左心房心肌形态学观察
2.5.1 左心房心肌病理结构的改变
在HE染色切片上,对照组中左心房心肌细胞结构完整,排列整齐,细胞核清晰,规则的纤维网填充与整个心肌细胞;间质内成纤维细胞形状规则数量适中。AF组中,心肌细胞增大,排列紊乱,细胞核大小不规则,核出现异型改变,部分细胞出现明显坏死,空泡变性及颗粒样变性,细胞间质疏松,出现心肌纤维化,有炎症细胞的浸润(图6)。
2.5.2 左心房心肌超微结构的改变
左心房心肌细胞电镜结果提示对照组左心房肌细胞的肌原纤维节的排列是有序的,核膜内染色质结构表现为正常;AF组左心房肌细胞超微结构明显异常,肌原纤维节出现了严重的退化,细胞核出现严重的固缩的现象,同时还可见有细胞的凋亡,内质网出现肿大征象,伴随着部分肌丝的崩解,肌纤维表现出杂乱无序(图7)。
3 讨论
心房颤动是临床上最常见的一种心律失常,已成为一种心血管流行性疾病[6-7]。对心房颤动机制的深入研究需要基于心房颤动动物模型进行研究。文献报道,目前在疾病状态下的在体动物房颤模型依据不同的制备方法,可根据实施建模方法的不同分为药物房颤模型[8-10]、创伤房颤模型、电刺激房颤模型、缺血房颤模型、基因工程房颤模型等。在上述的各种房颤模型的建立方法中,高频心房起搏具有房颤诱发率高,持续时间长,制作方法不复杂,可重复性强,对动物损伤小,可较贴近临床状况等特点。
Wijffels等[11]于1995年首次报道了在建立持续性房颤模型时,是通过运用快速心房起搏的方法制作的,将起搏电极置于右心耳,300~600次起搏4~6周制备持续性房颤模型。通过该模型的建立,可动物模型发生心房电重构改变,心房异质性增加,继而导致房颤易于诱发。Tan等[12]研究报道快速心房起搏最初可诱发出阵发性房颤;当继续进行心房快速起搏,将会发展成为持续性房颤。
表1 心房颤动建模前与心房颤动建模后左、右心房面积的比较

表2 两组间左、右心房面积的比较
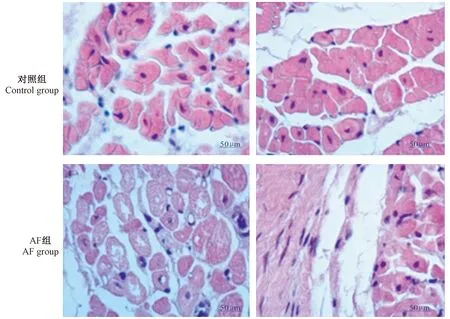
注:对照组两图显示左心房心肌细胞结构完整,排列整齐,细胞核清晰,规则的纤维网填充与整个心肌细胞。AF组左图显示左心房心肌细胞间质疏松,明显的空泡变性及颗粒样变性;AF组右图显示左心房心肌细胞有明显细胞间质纤维化改变。图6 光镜观察两组实验犬左心房心肌细胞病理结构的改变(HE染色,× 200)Note. Those two pictures of the control group showed that the left atrial myocardial cells in the control group were well organized, with clear nuclei and regular fibrous reticulum filling with intact myocardial cells. The left picture of the AF group showed a larger intercellular space, obvious vacuolar degeneration and granular degeneration of the left atrial myocardial cells, and the right picture of the AF group showed obvious interstitial fibrosis of the left atrial myocardial tissue.Figure 6 Pathological changes in atrial myocardial cells observed under light microscopy. HE staining

注:对照组两图显示左心房心肌细胞的肌原纤维节的排列是有序的,核膜内染色质结构正常。AF组两图显示左心房心肌细胞超微结构明显异常,肌原纤维节出现了严重的退化,细胞核出现严重的固缩的现象,有细胞的凋亡,内质网出现肿大征象,伴随着部分肌丝的崩解,肌纤维表现出杂乱无序。图7 电镜观察两组实验犬左心房心肌细胞超微结构改变(× 6000)Note. The two pictures of the control group showed normal arrangement of myofibrillar seqments of the left atrial myocytes and normal chromatin structure in the nuclei. The two pictures of the AF group showed abnormal ultrastructure of the left atrial myocytes in the AF group , as the myofibrillar segments showed serious degeneration, obvious karyopycnosis, cell apoptosis, endoplasmic reticulum delatation disintegration of some muscle filaments, and dissarangement of myofibrils.Figure 7 Ultrastructural observation of the cardiomyocytes of left atria in the two groups of experimental dogs
本研究选用高频心房起搏建立心房颤动模型,在无需心房程序性刺激的情况下,自身出现心房颤动,在建模过程中运用可操控性较强的系统将直径仅为4.1 Fr的细双极电极导线3830主动固定电极精准地植入实验犬右心房建立快速起搏系统,是建立心房颤动模型的一个创新亮点,它可提高在植入过程中电极导线在心房植入的成功率,能更好的选取起搏部位。
本研究所用的植入式心电监测器,是一种用于记录皮下心电图,可自动激活或由患者激活的植入式监测系统。本研究的另一创新亮点是,首次运用该植入式心电监测器在房颤模型建模过程中检测AF的发生及持续时间,可实时、精确地检测AF并进行长程监测,保证了实验数据的客观性和准确性,其装置内存,可自动记录检测到的心律失常事件,并将心律失常事件图进行存储,便于回顾、收集、分析心律失常事件心电图。在高频心房刺激建立房颤模型的动物实验中,运用植入式心电监测器,提高了在无心房程序性刺激诱发房颤的情况下动态检测房颤的效率。
心房颤动时,发生呈快速而无规律的心房活动,细胞内钙内流增加出现钙超载,心房收缩功能受到影响,心房内负荷及压力增大,最终心房肌纤维被拉伸,使得心房被动性扩大[13],这一改变为促进房颤的发生提供了结构与病理生理基础[14]。本研究通过超声心动图测量左心房、右心房面积,提示经过右心房快速起搏建立房颤模型后,左、右心房面积增大,心房的扩大提示实验犬心房肌结构发生重构,这一结构的改变正是心房颤动结构重构的一个重要标志[13]。心房结构重塑是指心房肌的间质组织增生或者纤维化增多,细胞膜的稳定性下降,部分细胞器的结构、形态及数量出现变化[15]。通过对心房颤动模型犬及空白对照实验犬进行左心房组织切片形态学观察提示心房颤动实验犬心房结构发生了重构。
本研究中,在犬心房颤动模型建立中创新性地运用了先进的导管操控系统及精细的电极导线,使房颤模型的建立高效、安全;采用体内心脏追踪器追踪房颤发作情况,为建立房颤模型提供了精确、高效的完整记录。在后续的研究中,将进一步对心房颤动实验犬的蛋白质组学进行深入研究,以期初筛出可能具有指导意义、敏感性高、特异性好的蛋白质生物分子标记物,同时对应收集临床标本,将所筛选的目标差异表达蛋白在人体临床标本中,检测验证其表达情况,分析其与临床表型的关联性,期望可为临床治疗提供特异性高的蛋白质生物分子标记物,为长远的临床治疗提供动态监测预后的新靶点。

