GLP-1受体激动剂利拉鲁肽对糖皮质激素性骨质疏松大鼠的疗效和作用机制研究
杨丽娜 杨靖 李娜 潘天荣 钟兴
安徽医科大学第二附属医院内分泌科,安徽 合肥 230601
骨质疏松症是一种以骨量减少、骨微结构破坏、骨脆性增加和骨折危险性上升为特征的代谢性骨疾病。随着世界人口老龄化的进程进一步加深,骨质疏松症的发病率越来越高。由于在骨质疏松的基础上发生骨折的风险增加,全球范围内估计,与骨质疏松相关的骨折发生率在老年妇女中约为40%,男性约为13%[1]。其所导致的疼痛和骨折严重影响了患者的生活质量,而且给家庭和社会造成了极大负担,因此骨质疏松已成为世界性难题。糖皮质激素由于其抗炎和免疫抑制作用,在临床上得到广泛运用。皮质类固醇治疗过程中引起骨保护素(OPG)与核因子κB受体激活因子(RANK)配体(RANKL)之间的比例发生改变,导致在前3~6个月时骨吸收增加,使其发生骨质疏松并增加骨折的风险的不良反应特别突出[2],糖皮质激素性骨质疏松已跃居至继发性骨质疏松的首位[3]。
而糖皮质激素也可以通过拮抗胰岛素来影响糖代谢过程。近年来,有研究表明骨代谢和糖代谢之间可能存在相互关联。有研究显示GLP-1受体激动剂对绝经后骨质疏松具有骨保护作用。但是,关于糖皮质激素诱导的骨质疏松研究较少,因此本研究将讨论利拉鲁肽作为一种新型降糖药物,对糖皮质激素性骨质疏松骨代谢的作用与机制。
1 材料和方法
1.1 实验动物
清洁级8周龄雄性SD大鼠30只,约(220+10)g,购自安徽省实验动物中心。饲养环境:标准鼠笼分笼饲养,每笼5只,温度维持在20~25 ℃,相对湿度45%~50%,通风环境良好,每周更换两次墊料,自由进食鼠粮和水,饲养期间每周测一次体重,根据体重调节药物剂量。
1.2 实验干预药物及试剂
地塞米松(石药银湖制药有限公司,批号H14022567,规格1 mL:5mg);利拉鲁肽(丹麦诺和诺德公司,批号J20160037,规格3 mL:18 mg);清洁级大小鼠粮采购于江苏省协同医药生物工程有限责任公司。
1.3 动物分组及造模给药
所有SD雄性大鼠适应性喂养一周后,测其空腹血糖,随机分为3组,每组10只:①对照组给予0.1 mL生理盐水肌肉注射;②地塞米松组按照1 mg/kg[4]剂量配得地塞米松溶液肌肉注射,每周两次;③利拉鲁肽干预组给予地塞米松溶液每周两次注射的同时,给予利拉鲁肽200 μg/(kg·d)[5]皮下注射。利用地塞米松连续干预3月建立糖皮质激素性骨质疏松大鼠模型,并同时给予利拉鲁肽皮下注射干预至实验结束。利拉鲁肽组死亡两只。处死大鼠前测定大鼠空腹血糖,收集大鼠血清、双侧股骨及第五腰椎。双侧股骨及第五腰椎用生理盐水纱布包裹后置于-20 ℃冰箱内。
1.4 Micro-CT测量骨密度、骨组织微结构、重建图像
将左侧股骨及腰椎室温下解冻后固定于样品固定器内,行Micro-CT(SCANCO uCT 80)扫描。扫描条件为:电压50 kV,电流200 μA,扫描方式 360°旋转,图像平面分辨率1024×1024,像素点尺寸15 μm×15 μm,层间距15 μm。扫描完成后,进行组织结构重建。得到重建图像后,使用自带软件定量分析得到骨微结构参数:BMD、TMD、Tb.N、Tb.Th、BV /TV、Tb.Sp、Conn.D。
1.5 股骨生物力学检测
右侧股骨在室温下解冻后,进行三点弯曲试验,加载速度为2 mm/min,计算机记录载荷-位移曲线,然后读出最大载荷和弹性模量。
1.6 血清骨转换代谢指标检测
用试剂盒检测大鼠血清的TrACP、CTX-I、ALP、OC水平,试剂盒采购于上海源叶生物科技有限公司。严格按照试剂盒说明书进行操作。
1.7 统计学处理
2 结果
2.1 大鼠的生长情况和FBG变化
干预12周后,地塞米松组大鼠体重较对照组显著下降,差异有统计学意义(P<0.05);利拉鲁肽组大鼠体重与地塞米松组相比,差异无显著差异。各组大鼠FBG干预前后差异均无统计学意义,见表1。


项目对照组地塞米松组利拉鲁肽组F值P值体重/g448.96±3.91353.55±3.24∗341.57±4.3424.72<0.01血糖 /(mmol/L)3.86±0.843.85±0.584.34±0.591.270.30
注:与对照组比较,*P<0.05;与地塞米松组比较,#P<0.05。
2.2 Micro-CT 3D图、2D切面图及骨微观参数
Micro-CT通过对感兴趣区域三维重建,得到结果如图1所示。股骨及腰椎2D切面图如图2所示。腰椎骨微观参数见表2,股骨骨微观参数见表3。与对照组相比,地塞米松组大鼠股骨和腰椎骨小梁数目减少、形态变细、连续性下降、排列不规则、间距增宽。利拉鲁肽干预组的骨小梁变粗变密、骨的连续性好、排列规则成网状结构,提高了骨小梁的体积分数,并降低骨小梁间距。

图1 左侧股骨及腰椎微型CT 3D图变化A1:股骨对照组;B1:股骨地塞米松组;C1:股骨利拉鲁肽组;A2:腰椎对照组;B1:腰椎地塞米松组;C1:腰椎利拉鲁肽组。Fig.1 Changes in micro-CT 3D images for the left femur and the lumbar vertebrae

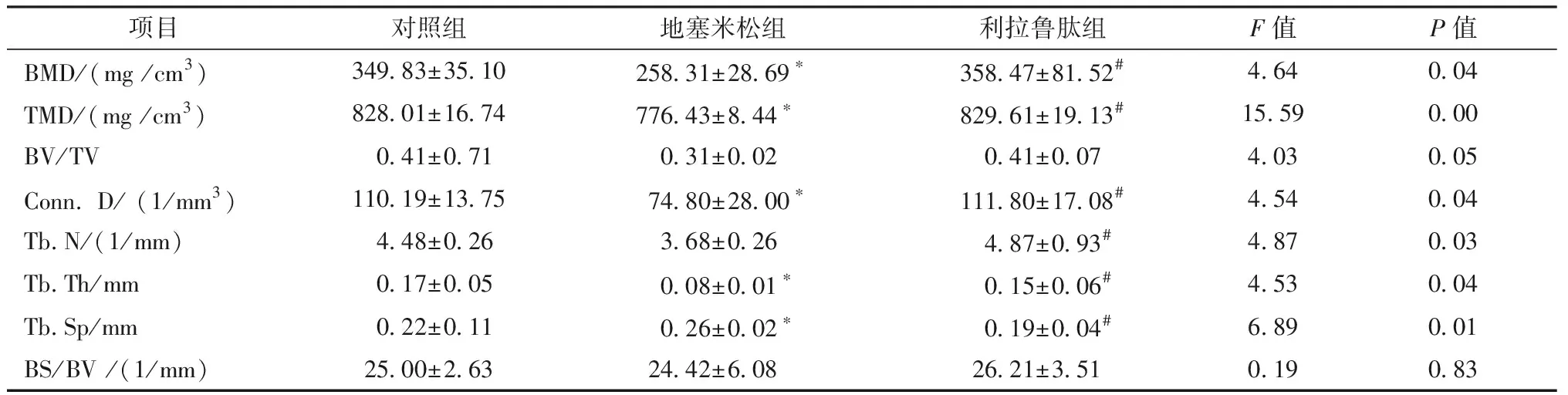
项目对照组地塞米松组利拉鲁肽组F值P值BMD/(mg /cm3)349.83±35.10258.31±28.69∗358.47±81.52#4.640.04TMD/(mg /cm3)828.01±16.74776.43±8.44∗829.61±19.13#15.590.00BV/TV0.41±0.710.31±0.020.41±0.074.030.05Conn. D/ (1/mm3)110.19±13.7574.80±28.00∗111.80±17.08#4.540.04Tb.N/(1/mm)4.48±0.263.68±0.264.87±0.93#4.870.03Tb.Th/mm0.17±0.050.08±0.01∗0.15±0.06#4.530.04Tb.Sp/mm0.22±0.110.26±0.02∗0.19±0.04#6.890.01BS/BV /(1/mm)25.00±2.6324.42±6.0826.21±3.510.190.83
注:与对照组比较,*P<0.05;与地塞米松组比较,#P<0.05。
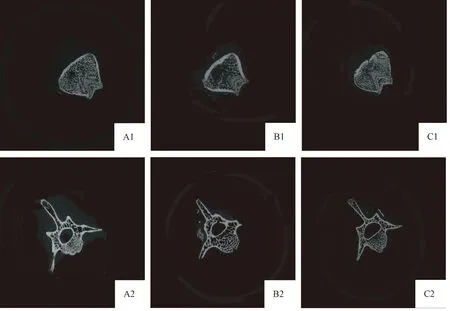
图2 左侧股骨及腰椎微型CT 2D切面图变化A1:股骨对照组;B1:股骨地塞米松组;C1:股骨利拉鲁肽组;A2:腰椎对照组;B2:腰椎地塞米松组;C2:腰椎利拉鲁肽组。Fig.2 Changes in the micro-CT 2D sectional images of the left femur and lumbar vertebrae

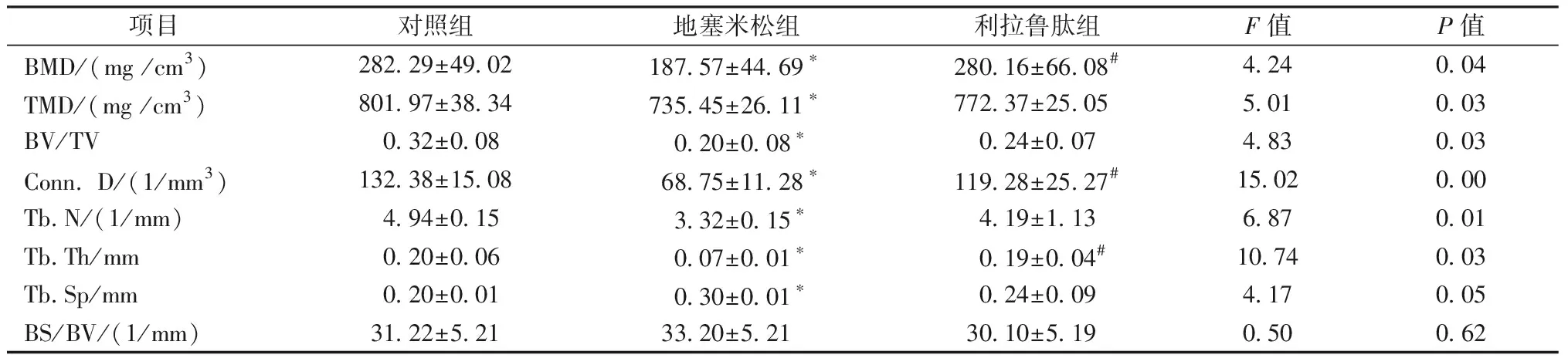
项目对照组地塞米松组利拉鲁肽组F值P值BMD/(mg /cm3)282.29±49.02187.57±44.69∗280.16±66.08#4.240.04TMD/(mg /cm3)801.97±38.34735.45±26.11∗772.37±25.055.010.03BV/TV0.32±0.080.20±0.08∗0.24±0.074.830.03Conn. D/(1/mm3)132.38±15.0868.75±11.28∗119.28±25.27#15.020.00Tb.N/(1/mm)4.94±0.153.32±0.15∗4.19±1.136.870.01Tb.Th/mm0.20±0.060.07±0.01∗0.19±0.04#10.740.03Tb.Sp/mm0.20±0.010.30±0.01∗0.24±0.094.170.05BS/BV/(1/mm)31.22±5.2133.20±5.2130.10±5.190.500.62
注:与对照组比较,*P<0.05;与地塞米松组比较,#P<0.05。
2.3 股骨生物力学变化
股骨三点弯曲实验表明,利拉鲁肽干预组的最大载荷和弹性模量均高于地塞米松组,各组间比较差异有统计学意义(P<0.05),见表4。


项目对照组地塞米松组利拉鲁肽组F值P值弯曲载荷/N167.24±28.25102.03±12.40∗139.41±1.16#10.110.01弹性模量/MPa7295.1±835.954262.5±830.86∗5789.5±470.60#12.850.01
注:与对照组比较,*P<0.05;与地塞米松组比较,#P<0.05。
2.4 血清ALP、OC、TrACP、CTX-I变化
与对照组相比,地塞米松组大鼠血清骨形成指标ALP、OC 指标显著下降,骨吸收指标TrACP、CTX-1指标显著升高。与地塞米松组相比,利拉鲁肽组大鼠血清骨形成指标ALP、OC 指标显著升高,差异有统计学意义(P<0.05),骨吸收指标TrACP、CTX-1指标显著下降,差异有统计学意义(P<0.05),见表5。
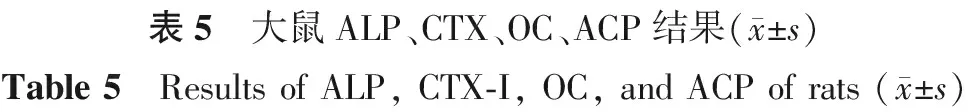

项目对照组地塞米松组利拉鲁肽组F值P值ALP/(ng/mL)59.86±4.2740.07±2.45∗57.59±1.02#101.24<0.001ACP/(μmol/L)43.49±4.2151.65±4.93∗44.48±1.63#10.540.001CTX/(pg/mL)10.35±3.39193.31±43.42∗21.52±3.41#142.82<0.001OC/(pg/mL)337.20±36.78239.97±30.26∗311.28±17.71#23.34<0.001
注:与对照组比较,*P<0.05;与地塞米松组比较,#P<0.05。
3 讨论
骨质疏松是一种高发病率的骨代谢性疾病,据估算2006 年我国骨质疏松症患者已近7 000万,骨量减少者超过 2亿人[6]。而糖皮质激素性骨质疏松已跃居继发性骨质疏松的首位。我国上海及浙江地区风湿性免疫病患者的GIOP患病率达39%,国外亦有研究数据表明,长期接受糖皮质激素治疗患者中,超过10%诊断骨折[7]。因此,GIOP的研究越来越受到重视。当前治疗上以抗骨吸收药物为主,如双膦酸盐和降钙素,而促进骨形成的药物很少。因此,寻找骨质疏松新的治疗药物显得尤为必要。
利拉鲁肽是人工合成的胰高血糖素样肽1受体激动剂,目前临床上作为一种新型的2型糖尿病降糖药物使用。近年来一项囊括16项RCTs的Meta分析表明,利拉鲁肽作为降糖药在治疗糖尿病病人时,病人发生骨折的风险降低(OR=0.38)[8]。此Meta分析显示利拉鲁肽可能同时对骨代谢和糖代谢产生正面影响。此外,Iepsen等[9]的一项随机对照研究显示:在37位体重指数大于34 kg/m2的肥胖妇女中使用利拉鲁肽持续皮下注射52周后,骨形成增加16%,并且有效的避免了低热量饮食造成的骨量丢失。另外,受体敲除动物实验也表明GLP-1在骨代谢中必不可少,敲除GLP-1R的雄性小鼠进行三点弯曲实验、定量X射线显微摄影、Micro-CT等检查,结果显示缺失GLP-1R的动物的最大载荷,断裂载荷,刚度显著降低,骨皮质和骨外径降低,骨强度下降[10]。动物实验模型表明,卵巢去势骨质疏松小鼠模型中,GLP-1受体激动剂利拉鲁肽和艾塞那肽分别干预4周后和去势小鼠相比,利拉鲁肽及艾塞那肽都可以明显改善骨小梁体积、厚度和数量,增加其连接性,以利拉鲁肽作用更为明显[11]。以上研究说明了GLP-1受体激动剂与骨代谢有着密切关系。但未见有GLP-1受体激动剂与GIOP的相关报道。
骨代谢评价包括两个主要方面:骨量和骨质量。骨量最常用的有效指标为骨密度。同时骨密度也是诊断骨质疏松的必要条件。微型CT是一种非侵入性的对骨质的微观结构评估手段,其不仅可以进行三维立体重建从而精确、直观的观察,还可以对松质骨骨小梁及皮质骨形态进行骨结构参数测量,为骨质疏松程度提出准确的定性及定量资料[12]。本研究通过微型CT测量得到地塞米松组的大鼠股骨和腰椎骨密度明显下降,证明造模成功。而利拉鲁肽可提高GIOP大鼠股骨和腰椎的骨密度。骨质量包括分子水平的骨材料构成、组织水平的骨显微构筑和骨微结构的完整性。Mansur等[13]的研究表明,链脲霉素造模的糖尿病小鼠在利拉鲁肽干预21 d后,处死行微型CT检查,发现糖尿病小鼠的BV/TV、Tb.N呈下降趋势,但差异无统计学意义。利拉鲁肽干预后无明显变化。考虑与药物作用时间过短,尚未对于骨微观参数造成影响。有研究[14]表明,利用艾塞那肽-4干预卵巢去势骨质疏松大鼠模型16周后,行微型CT检查发现其股骨和腰椎的BV/TV、Tb.N、Tb.Th、Tb.Sp、Conn.D较地塞米松组明显上升,与本实验的结果相符合,利拉鲁肽干预下GIOP大鼠后,大鼠的BV/TV、Tb.N、Tb.Th、Conn.D与地塞米松组相比呈上升趋势,提示骨小梁微结构得到改善。
骨生物力学中骨结构力学指标测试是评价骨质疏松性骨骼骨折风险最为直接的方法,是骨强度、骨结构、骨量的综合体现,而单纯的骨组织形态学观察、骨密度测定并不能全面反映骨质量,以力学性能指标评价干预治疗骨质疏松药物的疗效是其他测定方法无法取代的[15]。本课题进行的股骨三点弯曲实验提示地塞米松组大鼠的最大载荷和弹性模量是明显低于对照组的,而利拉鲁肽干预后,可以明显改善大鼠骨组织的抗骨折能力。这与既往文献报道缺乏GLP-1受体的小鼠的骨生物力学指标明显下降相一致[16]。
血清CTX-1是骨中I型胶原的降解产物,它的特异结构保护其不受肾脏降解,在血清中稳定性好。检测血清CTX-1的含量能特异性反应破骨细胞的吸收活性。TrACP主要由破骨细胞释放产生的非胶原蛋白,它和胶原代谢产物一起被分泌到细胞外,故TrACP与骨吸收水平成正相关。有研究[17]表明,利拉鲁肽干预4周,可降低2型糖尿病大鼠血清CTX-1以及TrACP水平。与本实验研究结果符合,提示利拉鲁肽可抑制破骨细胞活性,通过减少骨量丢失起到保护骨组织作用。成骨细胞可分泌骨特异性碱性磷酸酶,是总碱性磷酸酶的重要组成部分,可反映骨形成的状态。OC是骨基质中含量最丰富的标志物,由成骨细胞释放到细胞外,反映骨形成状态。有研究表明,GLP-1受体表达在成骨细胞中且增加1型胶原蛋白表达和碱性磷酸酶活性,促进骨的合成代谢[18]。此外,Sun等[19]的研究发现,给予一种非肥胖且自发在出生早期出现高血糖的GK大鼠皮下注射利拉鲁肽4周后,大鼠不仅骨密度得到提升,其骨形成标志物OC、ALP、collagen 1的表达也显著增高。与本动物实验上述实验结果相一致。提示利拉鲁肽可能促进成骨细胞活性,增加促进骨的形成起到保护骨组织的作用。
综上所述,利拉鲁肽能提高骨密度和骨强度,改善骨组织微结构,机制可能与促进骨形成和抑制骨吸收有关。本实验后续将进一步研究利拉鲁肽影响GIOP的机制。

