注射催产素对小鼠骨密度和成骨细胞分化影响的实验研究
刘璇 鲁荐 刘一鸣
1.东南大学医学院,江苏 南京 210009 2.南京市第一医院,江苏 南京 210006
随着人口老龄化进程加快,由骨质疏松症诱发的骨折将是社会面临的一大公共健康问题,并在绝经后妇女人群中显得尤为严重。绝经后骨质疏松症是原发性骨质疏松症中最常见的类型,多在绝经后5~10年发病,是困扰女性健康的严重疾病之一。
催产素(oxytocin,OT)是一种垂体后叶激素,其主要生理功能包括促进分娩期子宫收缩[1]、哺乳期排乳[2]和影响社会行为[3]。近年来,研究发现成骨细胞和破骨细胞均表达催产素受体,催产素对骨代谢具有直接调节作用,它能促进成骨细胞分化和骨形成功能、促进破骨细胞分化但抑制骨吸收功能,生理状态下它的整体作用是促进骨形成和骨量累积,并且催产素参与调节妊娠期母体的骨重建,从而揭示了催产素新的生理功能[4-5]。最近,有研究者报道绝经后妇女骨质疏松的发生与其体内低催产素水平有关,而在低血清雌激素水平的妇女体内高骨密度与高催产素水平有关[6],该机制可以通过催产素对骨代谢的影响来解释。
然而,以往的一些研究多是基于体外细胞培养实验,本研究采用2月龄雌性C57/B6小鼠,行双侧卵巢切除术建立小鼠骨质疏松模型,并给予催产素腹腔注射,分别从骨密度、细胞分化、分子水平鉴定小鼠骨代谢水平,进一步深入探究催产素对骨代谢的调控作用。
1 材料和方法
1.1 实验分组
所有实验小鼠均由东南大学医学院动物实验中心购置并饲养(SPF 级),实验方案已通过实验动物伦理委员会批准,在实验的执行过程中一切按照伦理准则进行。选取同批次健康的2月龄雌性C57/B6小鼠15只[平均体重(25±1)g],随机分成3组(每组5只): ①对照组(C),②造模组(OVX),③造模+催产素注射组(OVX+OT)。造模期每天按照对照组摄食量给予其他组定量食物(动物专用普通级饲料,不添加含豆类的原料,其中钙含量10 g/kg),自来水自由摄取。
1.2 动物造模
根据前期研究经验和结果[4-5],本实验动物造模方法如下:所有小鼠经腹腔注射戊巴比妥麻醉(给药浓度为40 mg/kg),逐层切开皮肤、肌层,进入腹腔,找出双侧卵巢。OVX组、OVX+OT组小鼠行双侧卵巢切除术,结扎输卵管和血管,将卵巢完整切除,逐层缝合;C组小鼠仅切除卵巢周围部分脂肪(其质量略同卵巢组织),不切除卵巢。术后所有小鼠均常规腹腔注射青霉素(5万U/d)预防感染,持续3d。参照前期研究中的注射量[4],术后1周起OVX+OT组每天腹腔注射催产素5μg(以生理盐水0.2 mL溶解),C组和OVX组每天注射0.2 mL生理盐水,共注射8周。
1.3 骨灰度测量
采用东南大学生物医学工程学院的Hiscan骨灰度测量仪检测小鼠左股骨和腰椎L4~6骨灰度。每次开机首先进行Quality Control,调节电压为50 mV和电流50 mA,并进行机器预热30 min后方可开始测量。将麻醉的小鼠取俯卧位四肢展开,固定在仪器配套的粘胶托盘上,再将托盘放置到仪器扫描平台上进行全身扫描。扫描结束后,通过仪器分析软件Image J测量腰椎L4~6、左股骨的骨灰度(骨灰度值越高,则骨密度越低)。
1.4 小鼠骨髓细胞的分离和培养
催产素注射8周后,采取断颈法处死小鼠,立刻提取各组小鼠骨髓细胞,利用含1 mmol/L 2-磷酸抗坏血酸镁(L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate, A2P)的α-15全培养液(αMEM + 15% FBS + 1% penicillin-streptomycin)诱导其向成骨细胞分化,且进一步设外加催产素组进行细胞培养(参照前期研究中的10-8mol/L作用浓度[4-5])。细胞培养分组(共6组): ①C组,②OVX组,③OVX+OT组,④C组+OT(10-8mol/L),⑤OVX组+OT(10-8mol/L),⑥OVX+OT组+OT(10-8mol/L)。
1.5 ALP染色
随着骨髓基质细胞向成骨方向分化,逐渐形成成纤维细胞集落形成单位(colony forming unit-fibroblasts, CFU-f),即成骨细胞前体细胞,具有高碱性磷酸酶活性。实验中,当细胞培养至第12天使用Sigma公司的ALP试剂盒(86R-1KT)进行碱性磷酸酶染色,以鉴定成骨细胞的分化状况。染色后,可见 ALP 阳性的细胞集落呈紫红色,采用Matlab软件编程计算染色面积,对比分析各组染色结果。
1.6 Von Kossa染色
随着成骨细胞的分化成熟,形成成骨细胞集落形成单位(colony forming unit -osteoblasts, CFU-ob),大约培养至第21天,肉眼便可见白色的矿化结节。实验中,待细胞培养至28 d进行Von Kossa染色,以鉴定成熟成骨细胞的矿化。染色步骤如下:弃去培养板中的培养液,用10%甲醛室温下固定后加入5%硝酸银溶液,置于紫外灯下照射直至钙结节变为黑色,再用5%硫代硫酸钠水溶液处理和0.05%番红O复染,晾干后采用Matlab软件编程计算染色面积,对比分析各组染色结果。

图1 小鼠股骨和腰椎骨灰度测量Fig.1 Measurement of bone gray values of the femur and lumbar vertebra in mice
1.7 qPCR检测
细胞接种30 d后,进行qPCR检测成骨细胞分化水平。本实验进行目标基因表达差异分析(管家基因GAPDH作为参照),用罗氏SYBR Green Mix荧光染料定量检测,以鉴定催产素对成骨细胞分化的影响。实验过程如下:收集对数生长期的细胞,按106~107个细胞:1 mL Trizol的比例向其中加入Trizol(Invitrogen,15596-026)使细胞充分裂解,经沉淀、洗涤和溶解RNA后再进行反转录。反转录过程为30 μL反应体系:灭活DEPC水10.25 μL,MgCl2(25 mmol/L)6 μL,10×RT Buffer 3 μL,dNTP mix(10 mmol/L)3 μL,Oligo dT-Adaptor Primer(2.5pmol/mL))1.5 μL,样品RNA 4 μL,RNA酶抑制剂(40 U/μL)0.75 μL,AMV Reverse Transcriptase(5 U/μL)1.5 μL。反转录反应条件为:42 ℃ 30 min→99 ℃ 5min→5 ℃ 5min(1 Cycle),用以对反应产物cDNA进行扩增。qPCR(StepOne Plus, ABI)体系(共20 μL):罗氏 SYBR Green Mix 10 μL,上/下游引物0.6 μL(见表1),dd H2O 6.8 μL,cDNA 2 μL。扩增反应条件为:94 ℃预变性2 min,之后94 ℃变性45 s、58 ℃退火45 s、72 ℃延伸45 s,进行35个循环扩增,再以72 ℃延伸7 min。
表1成骨相关基因qPCR检测的引物序列
Table1The primer sequences for qPCR detection of osteogenesis-related genes

基因引物名称引物序列Osteopontinm-Osteopontin/A5’-ATG GTC ATC ATC GTC GTC C-3’m-Osteopontin/S5’-ATC TCA GAA GCA GCC TCT CC-3’Osterixm-Osterix/A5’-AAT AGG ATT GGG AAG CAG AAA G-3’m-Osterix/S5’-TAT GCT CCG ACC TCC TCA AC-3’Runx2m- Runx2/A 5’-CCG TCA GCG TCA ACA CCA TC-3’m-Runx2/S5’-CGT CAG CAT CCT ATC AGT TC-3’
1.8 统计学处理
所有数据均以平均值±标准差表示,采用SPSS软件统计单因素方差分析方法进行分析,组间比较采用Dunnett’s test检验,P<0.05表示差异具有统计学意义。统计结果的图形化由Prism绘图软件完成。
2 结果
2.1 催产素能缓解去势小鼠的骨丢失
骨质疏松症是一种骨骼退行性疾病,其特征为低骨密度和骨组织微结构劣化,从而增加骨折易感性。骨密度是骨矿物代谢中量化骨量的重要指标,是评价和判断骨质疏松症的金标准[7]。本研究分别于小鼠注射催产素前和注射8周后,测量小鼠腰椎L4~6和左股骨两处骨量丢失敏感部位的骨灰度(见图1),骨灰度值越高,骨密度越低。结果显示催产素注射8周后,OVX组小鼠的左股骨骨灰度较C组增加了18.3%(P<0.001),腰椎L4~6骨灰度较C组增加了15.2%(P<0.001),即OVX组小鼠股骨和腰椎的骨密度均显著降低,说明小鼠骨质疏松模型成功建立。与C组相比,OVX+OT组的左股骨骨灰度仅增加了4.0%(P<0.05),但其比OVX组则降低了12.1%(P<0.001);同样OVX+OT组的腰椎L4~6骨灰度仅比C组增加了4.8%(P<0.001),但比OVX组则降低了9.0%(P<0.001),即注射催产素明显提高了OVX+OT组小鼠的股骨和腰椎骨密度,有效地弥补了卵巢切除引起的骨量丢失,表明催产素促骨形成作用显著(图2和图3)。
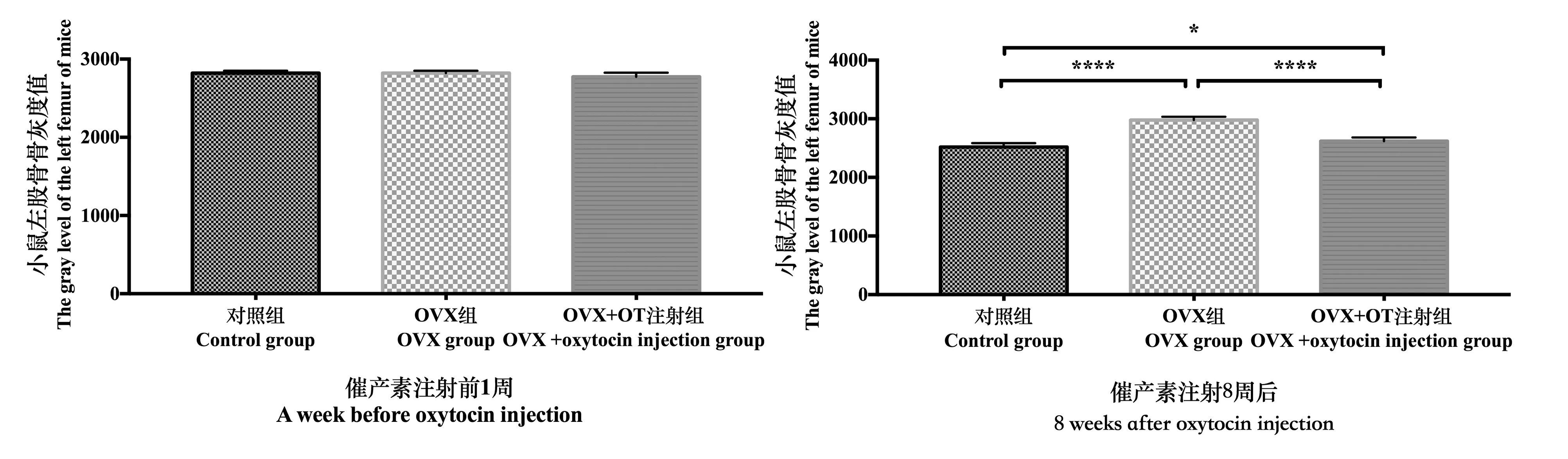
图2 催产素注射前和注射8周后小鼠左股骨骨灰度值比较(*P<0.05,****P<0.0001)Fig.2 Changes of bone gray values of the left femur of mice before and 8 weeks after oxytocin injection(*P<0.05,****P<0.0001)

图3 催产素注射前和注射8周后小鼠腰椎L4~6骨灰度值比较(***P<0.001,****P<0.0001)Fig.3 Changes of bone gray values of the lumbar vertebrae L4-L6 of mice before and 8 weeks after oxytocin injection (***P<0.001,****P<0.0001)
2.2 催产素促进成骨细胞的体外分化及矿化能力
成骨细胞起源于间充质干细胞(mesenchymal stem cell,MSC),它的主要特征包括高碱性磷酸酶活性,以及能够合成、分泌骨基质。进行ALP染色可反映成骨细胞分化情况,钙结节染色可以检测成熟成骨细胞的体外矿化能力。如图4所示的ALP染色结果,OVX组细胞集落最少,成骨细胞分化较C组差,染色面积降低了86.3%;OVX+OT组成骨细胞分化情况较OVX组好,染色面积比OVX组增加了322.5%。而加入催产素体外培养的3组细胞其分化趋势与以上未加催产素的3组一致,其中OVX组外加OT(10-8mol/L)培养后染色面积比C组外加OT(10-8mol/L)培养降低了52.3%,OVX+OT组外加OT(10-8mol/L)培养后染色面积较OVX组外加OT(10-8mol/L)培养增加了67.9%。且外加催产素的3组均比其相应未加催产素组分化更好,如C组外加OT(10-8mol/L)培养后染色面积增加了43.4%,OVX组外加OT(10-8mol/L)培养后染色面积增加了398.3%,OVX+OT组外加OT(10-8mol/L)培养后染色面积增加了98.0%。Von Kossa染色结果显示,OVX组细胞集落和钙结节较C组明显少且小,染色面积降低了75.3%;OVX+OT组细胞集落和钙结节较OVX组多,染色面积增加了62.3%。同样,细胞外加催产素培养后其细胞集落和钙结节生长均比未加入催产素的几组好,如C组外加OT(10-8mol/L)培养后染色面积增加了12.8%,OVX组外加OT(10-8mol/L)培养后染色面积增加了9.7%,OVX+OT组外加OT(10-8mol/L)培养后染色面积增加了66.5%,且外加催产素3组间的变化趋势与未加催产素组一致, 其中OVX组外加OT(10-8mol/L)培养后染色面积比C组外加OT(10-8mol/L)培养降低了76%,OVX+OT组外加OT(10-8mol/L)培养后染色面积较OVX组外加OT(10-8mol/L)培养增加了146.4%(图5)。以上染色结果均表明,小鼠注射催产素和细胞体外培养外加催产素均能促进成骨细胞的分化和成熟成骨细胞的体外矿化。
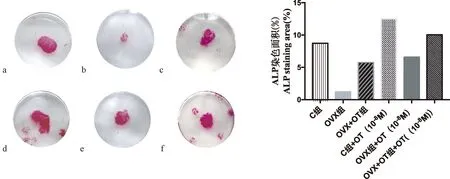
图4 催产素促进成骨细胞的ALP活性a:C组, b:OVX组, c:OVX+OT组, d:C组+OT(10-8mol/L), e:OVX组+OT(10-8 mol/L), f:OVX+OT组+ OT(10-8 mol/L)Fig.4 Oxytocin promoted ALP activity of osteoblastsa: C group, b: OVX group, c: OVX+OT group, d: C group +OT (10-8 mol/L), e: OVX group+OT (10-8 mol/L), f: OVX+OT group + OT (10-8 mol/L)

图5 催产素促进成熟成骨细胞的体外矿化a: C组, b:OVX组, c:OVX+OT组, d:C组+OT(10-8 mol/L), e:OVX组+OT(10-8 mol/L), f:OVX+OT组+OT(10-8 mol/L)Fig.5 Oxytocin promoted osteoblast mineralization in vitro a: C group, b: OVX group, c: OVX+OT group, d: C group +OT (10-8 mol/L), e: OVX group+OT (10-8 mol/L), f: OVX+OT group + OT (10-8 mol/L)
2.3 催产素促进成骨相关基因的表达
实验采用qPCR检测了催产素注射对成骨细胞分化标志物骨桥蛋白(osteopontin, OPN)、Runx2(runt-related transcription factor 2)和锌指转录因子Osterix表达的影响。OPN是反映成骨细胞分化成熟的重要标志[8];Runx2又称矮小相关转录因子2,它能诱导成骨细胞分化和增加未成熟成骨细胞的数目,从而促进成熟骨形成[9];Osterix也在促进成骨细胞分化和新骨形成过程中起重要作用[10]。qPCR结果显示,OVX组成骨相关基因OPN、Runx2和Osterix的 mRNA水平明显低于C组(P<0.001),再次验证了骨质疏松小鼠模型成功建立。OVX+OT组成骨细胞OPN、Runx2和Osterix的 mRNA水平明显高于OVX组(P<0.0001),特别是OPN表达比OVX组增加了3.9倍,Osterix表达较C组增加了0.5倍,较OVX组则增加了15.5倍,说明注射催产素能够使3种成骨相关标志物的mRNA表达显著增加,这也与小鼠骨密度测定、细胞染色结果相一致,即催产素能够促进小鼠体内骨合成代谢作用(如图6)。

图6 催产素促进成骨相关基因OPN,Runx2和Osterix的表达(* P<0.05, ** P<0.01, *** P<0.001, **** P<0.0001)Fig.6 Oxytocin promoted the expression of osteogenesis-related genes OPN, Runx2, and Osterix (*P<0.05, ** P<0.01, *** P<0.001, **** P<0.0001)
3 讨论
随着近年来研究者们先后揭示了人的成骨细胞和破骨细胞上均存在催产素受体,以及一些骨质疏松症相关疾病和生理过程中常伴有催产素水平的改变,Dursun等[11]提出了催产素可能与骨质疏松症相关的推测。研究者前期通过成骨细胞的体外培养与相关检测鉴定也证明,催产素通过上调BMP-2来调控成骨细胞特异性转录因子Schnurri-2、Osterix、激活转录因子(activating transcription factor 4,ATF4)的表达,从而促进成骨细胞的分化及其矿化功能[4]。
然而,以往的一些研究结果多是基于体外细胞培养实验,直到2007年,Elabd等[12]对骨质疏松模型大鼠行肌肉注射催产素,一组为大剂量短期作用(40μIU/kg,持续6周),一组为低剂量长期作用(8μIU/kg,持续12周),其血清生化检测、骨组织形态学检测对比结果均显示催产素能够促进成骨细胞增殖及其骨形成功能,这也是首次从在体水平上探索了催产素对骨重建的调节作用。本实验通过长期(8周)催产素注射和监测来完善催产素调节骨代谢的认识,分别从骨密度、细胞分化、分子水平鉴定催产素对骨代谢的调控作用。研究结果表明,骨质疏松造模小鼠的骨量明显低于假手术对照组小鼠,而催产素腹腔注射能够提高骨质疏松造模小鼠的骨密度,通过提高成骨相关基因OPN、Runx2和Osterix的表达促进成骨细胞的分化和体外矿化,这进一步提示注射催产素能够促进骨质疏松造模小鼠的骨合成代谢。最近,有研究者通过组织学检测证明了皮下注射催产素能促进去势大鼠股骨干骺端移植骨的整合以及缓解骨质疏松造成的骨量丢失[13];Cheng等[14]研制了一种负载催产素的SBA-15多孔颗粒,通过体外细胞系共培养检测ALP及I型胶原表达以及体内兔颅骨缺损移植检测钙沉积,证明了该材料在体内外均具有良好的促骨修复功能,以上文献报道均与本研究结论一致。
绝经后骨质疏松症是原发性骨质疏松症中最常见的类型,其主要原因是由于卵巢功能衰退引起的雌激素分泌不足。激素替代治疗为治疗骨质疏松症的首选方案[15],雌激素可通过雌激素受体、细胞因子、细胞凋亡和骨保护素等多条途径促进成骨细胞的骨形成,抑制破骨细胞的骨吸收,从而达到治疗骨质疏松的目的。雌激素与催产素在很多系统中的相互作用已经被广泛研究报道。如雌激素能够使去势大鼠血浆中的催产素浓度升高[16],上调垂体、下丘脑、子宫的催产素受体mRNA表达[17-18],从而增加这些脏器对催产素的敏感性。研究者前期实验结果也提示,外源性雌激素可能增加外周催产素生成,或上调成骨细胞催产素受体的表达,提高骨骼对催产素的敏感性,催产素可能又同时调节雌激素受体的表达和活性,从而两者协同促进骨形成和抑制骨吸收。而当催产素受体敲除后,雌激素与催产素两者间的相互调节作用减弱,导致雌激素对骨密度的影响不显著,从而降低雌激素的骨合成代谢作用[19]。Colaianni等[20]最新研究报道了人和鼠的成骨细胞均能分泌催产素,并且受到雌激素激活MAPK的调控,进一步研究发现17-雌二醇能够通过促进催产素受体表达和催产素产生起到促进骨代谢的作用,并且在雌激素作用下,催产素能够成为自身分泌的“受体”来刺激自分泌产生更多的催产素,以进一步放大雌激素的成骨调节作用,并提出雌激素诱导的催产素反馈径路在成骨代谢中起到重要作用[21]。另外,最新临床研究也表明,在绝经后妇女人群中,合并骨质疏松者其体内血浆催产素水平明显低于相应正常人群,并且低催产素水平与低骨转换水平有关[6]。由此可见,催产素在雌激素调节骨代谢过程中的作用不可忽视。结合上述实验动物和临床病例研究结果,可以推测血浆催产素水平可作为血清标志物为绝经后骨质疏松临床诊断提供依据,催产素也有望应用于骨质疏松临床治疗。但绝经后骨质疏松症为多因素性疾病,激素间的相互作用的深入阐明将进一步指导临床激素补充的合理应用。
此外,妊娠后期母体内催产素水平的升高参与调节母体的骨重建以实现母子间的钙转移,胎儿的骨骼发育也具有催产素敏感性[5],这也揭示了催产素新的生理功能,显示了其在特殊时期对骨代谢调节的重要生理意义。除催产素之外,目前人们已发现雌激素、甲状旁腺素、糖皮质激素等多种激素都参与调节妊娠期和哺乳期母体的骨重建[22-24]。但是,对于这些激素对骨代谢的相互协同关系还有待进一步研究,仍可能存在其他未知的骨代谢相关激素和调节因子参与调节妊娠期和哺乳期母体的骨重建,这将需要研究者们去发掘。在这些代谢相关疾病如甲亢、糖尿病等引起的骨质疏松症中,常伴有血浆催产素水平的改变[25-26],近年来也陆续有人开展了催产素与糖尿病、肥胖等疾病相关性的实验研究[27],对于催产素在其中发挥的骨代谢调节作用,以及血浆中的催产素水平能否辅助作为骨质疏松症评估、预测和监控的标志物,值得进一步深入探索。
4 结语
近年来,随着研究人员深入探究催产素对骨代谢的影响[28-30],进一步丰富了垂体-骨轴理论[31-33],让人们对垂体激素的功能有了全新认识,为骨质疏松症和其他骨代谢疾病的防治提供了新的思路和诊疗方案。已有研究证明催产素能够促进骨合成代谢作用,重组催产素及其类似物有望应用于骨质疏松临床治疗,值得注意的是,关于催产素其作用于人体的安全剂量和有效的给药方案以及患者个体化治疗方案的确定还有待系统临床研究。

