基于微流控芯片的乳腺癌肿瘤干细胞富集*
王少熙, 阴 玥, 胡晨霞
(1.西北工业大学 微电子学院,陕西 西安 710072;2.西北工业大学深圳研究院,广东 深圳 518057;3.广州中医药大学 中医学院,广东 广州 510006)
0 引 言
目前,BCSCs研究已成为肿瘤研究领域热点,然而对肿瘤干细胞生长或分化的微环境研究却鲜有相关资料,现有研究多集中于生理学方面微环境模拟,研究方法多具有低通量,较差空间和时间控制性,实验重复性较差等缺陷[1~4]。不同的微环境机械因素如剪切力或基底硬度不同、不同生化信号刺激如细胞与细胞之间旁分泌及细胞自分泌类型和细胞所处空间结构的不同、传统二维培养与肿瘤干细胞真实体内三维环境不同,都将对肿瘤干细胞的富集培养和分化产生不同影响;此外传统方法所需过多的试剂耗材和细胞量限制了同时对多种肿瘤干细胞的研究及大批量药物筛选。因此,受材料、空间、时间等因素的限制,传统处理细胞的方法难以满足肿瘤干细胞研究的需要[5]。
微流控芯片(microfluidic chip)或称为芯片实验室(Lab on chip),是把化学和生物等领域中所涉及的样品制备、反应、分离、检测等基本操作单元集成到一块几平方厘米(甚至更小)的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以取代常规化学或生物实验室的各种功能的一种技术平台[6]。2004年,美国Business 2.0杂志在封面文章中把其列为“改变未来的七种技术之一” 。2006年7月,《Nature》杂志发表了一期题为“芯片实验室”的专辑,从不同角度阐述了芯片实验室的研究历史、现状和应用前景,并认为,芯片实验室可能成为“这一世纪的技术”[7]。由于微通道的尺寸与细胞尺寸相当,可以通过微流控芯片对细胞的研究深入到单细胞甚至亚细胞器水平,比传统的对整群细胞进行分析的手段更加准确,对研究细胞内分子相互作用有极其重要的意义。与传统试验方法比较,微流控芯片具有分析速度快、高通量、成本低以及精度高等特点;芯片制作材料多为二甲基硅氧烷(polydimethylsiloxane,PDMS),具有可塑性好、透明便于观察、透气性好却不漏水、良好生物兼容性、无毒、不导电以及具有极佳的热稳定性和化学惰性特点[9]。针对干细胞微环境因素,采用微流控芯片具有如下明显优势:1)微流控芯片可进行三维培养和干细胞微环境模拟及调控。微流控芯片可构建出与细胞尺度匹配的三维空间,并调控细胞生长所需的时间长短;能够模拟体内肿瘤干细胞三维状态下的生长状况及与微环境中其他细胞相互作用,实现肿瘤干细胞微环境的三维培养,三维培养状态下的细胞生长状态良好,能够真实地反映肿瘤干细胞的生物学特征,为微流控芯片技术在医学和生物学研究方面提供了一个新思路。2)微流控芯片能构建肿瘤干细胞微环境中的基质材料硬度、密度、空隙率等,更为真实地反映肿瘤干细胞与物理微环境的相互作用。3)微流控芯片将生化因素整合入三维细胞微环境中;模拟微环境中的细胞因子、生长因子等对肿瘤干细胞的影响,以及能制造浓度梯度、转移模型、细胞分离及迁移、药物的开发及新的治疗方式探索[9,10]。
综上分析,采用微流控芯片富集培养BCSCs微球体模型,研究微流控芯片体外模拟和调控BCSCs培养的最佳微环境;设计不同的微流控芯片平台,研究抗肿瘤化合物对BCSCs的抗肿瘤效应及作用机制;应用微流控芯片高通量、低成本筛选靶向杀伤BCSCs药物研究等对提高乳腺癌治疗效果具有重要意义。
1 芯片设计
1.1 芯片设计
乳腺癌肿瘤干细胞微流控培养的核心是实现芯片内悬浮三维培养。本项目采用多层结构设计,顶层和底层包含微通道,中间层为细胞悬浮阵列,构建形成单细胞捕获结构阵列。中间层细胞悬浮阵列的每个位置对应顶层一个单细胞捕获结构,当细胞遇到捕获结构,则会在压力场作用下缓慢落入悬浮捕获阵列中,而阵列的每个悬浮位置只能容纳单细胞,由此构建成单细胞悬浮阵列,单细胞悬浮阵列形成芯片的BCSCs培养腔。芯片结构如图1所示。
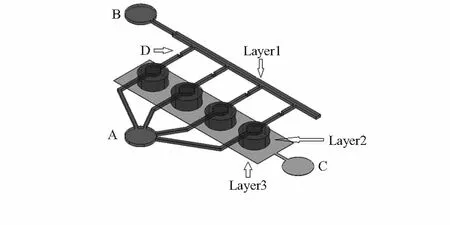
图1 微流控芯片结构示意
图1中,A、B和C为输入输出连接口,D为阀。载有乳腺癌肿瘤干细胞的培养液从Layer1的A口注入,同时关闭D阀,当肿瘤干细胞被Layer 2的腔体阵列捕获后,关闭A 注入口以及打开D 阀。其中,Layer 2的单个腔体阵列直径为300 μm,高度为100 μm。然后细胞培养液可以从B 端口注入。Layer 1和Layer 3由通道组成,通道的尺寸为50 μm高,宽度为100~200 μm,具体形状根据不同的部位改变。其中D阀处高度为10 μm。端口C为废液出口。
1.2 芯片仿真
培养液注入的速度影响肿瘤干细胞的存活率,关键的参数是溶液对干细胞的剪切力。文献[11]提出细胞富集存活受到的剪切力最大不能超过50 μN/cm2,本文采用培养液低速注入方式,仿真结果如图2所示。
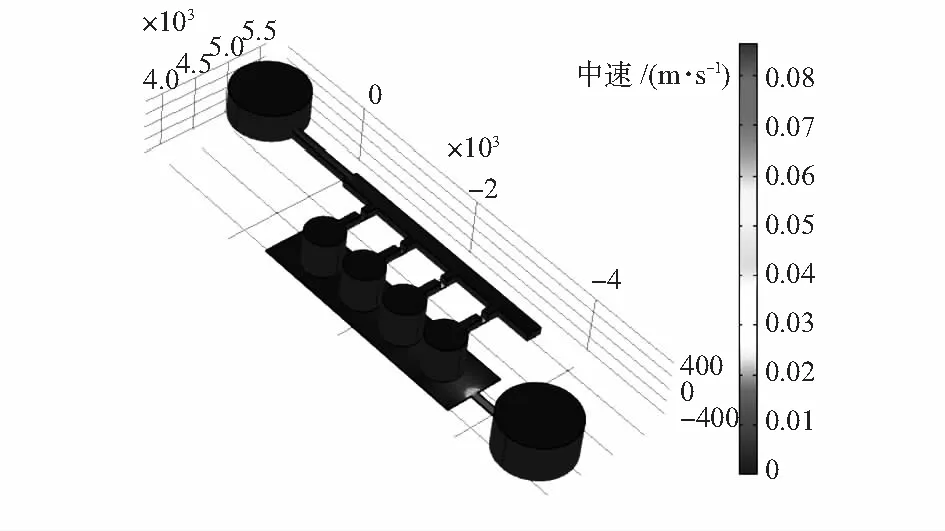
图2 芯片内培养液流速仿真结果
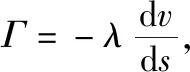
1.3 芯片制造
根据芯片结构设计模具,利用模具进行芯片制造。PDMS试剂采用美国道康宁公司的Sylgard 184,按照10︰1比例配置硅胶组分和固化剂,置入真空泵去泡15 min,然后灌胶到SU8模具上放置90 ℃烘胶台2 h。等PDMS层凝固后冷却并剥离,得到PDMS单层芯片。原理和步骤雷同可以得到所需要的3层芯片。最后采用表面真空等离子氧化处理进行层与层对准键合,得出最终的芯片样品,如图3所示。

图3 芯片最终样品示意(尺寸为3 cm×5 cm)
2 实验结果
首先进行人乳腺癌细胞系MCF—7及 MDA—MB—231肿瘤干细胞微球体的预培养,MCF—7细胞在无血清干细胞培养基,即含体积分数1 %双抗,2 %B27,20 ng/mL EGF和20 ng/mL bFGF的DMEM/F—12培养液(SFM)中培养过程中有部分细胞呈贴壁分化的状态,培养48h后,悬浮细胞逐渐形成较小的初始悬浮细胞团。在倒置显微镜下可见初始悬浮细胞团由几个至十几个正在分裂的新生细胞组成悬浮球,逐渐增大,且数量明显增多,呈类圆形,折光性增强,形态大小各异。第5天开始就可观察到典型的MCF—7肿瘤干细胞悬浮细胞球的出现。且细胞球经0.05 %胰蛋白酶消化为单细胞悬液后,仍能在SFM中生存并传代形成第2代肿瘤干细胞球,1 w传代一次,直至16代仍能继续生长增殖形成肿瘤球,成功建立MCF—7肿瘤干细胞培养法。悬浮球应用含FBS培养基分化培养后,仍能贴壁增殖,但细胞形态发生变化,由原来的上皮细胞铺路石样形态转为成纤维细胞样形态。MDA—MB—231悬浮球细胞聚集相对松散,目前正在完善悬浮球培养条件(如图4所示)。
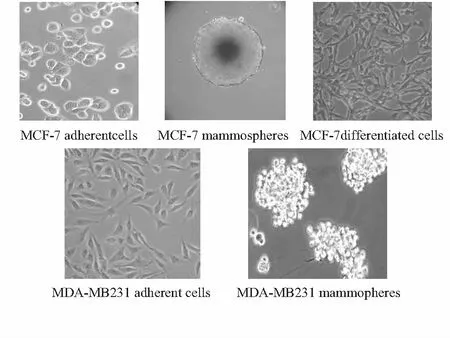
图4 MCF—7及 MDA—MB—231贴壁细胞及肿瘤干细胞球形态
将预培养的肿瘤干细胞球形态连同培养基注入上述所描述的芯片内,进行连续观察富集,结果如图5所示。

图5 乳腺癌肿瘤干细胞片内培育示意
图5所示微流控芯片环境下乳腺癌肿瘤干细胞的培养和富集情况,无血清培养基连续匀速提供,受到培养基动态流动的影响,单个乳腺癌肿瘤干细胞的位置有变化。在每隔2天进行实验观察,结果如图5所示。
3 结 论
采用生物兼容有机化合物二甲基硅氧烷,设计3层结构微流控芯片,包括细胞及培养液注入层、中间悬浮培养层和废液处理层。采用真空等离子氧化处理二甲基硅氧烷表面完成对准键合。基于此微流控芯片注入经预培养的干细胞球,实验结果证明乳腺癌肿瘤干细胞在微流控芯片内的富集效应。

