基于水化学和氮氧双同位素的地下水硝酸盐源解析
傅雪梅,孙源媛,苏 婧*,郑明霞*,席北斗,钱光人
基于水化学和氮氧双同位素的地下水硝酸盐源解析
傅雪梅1,2,孙源媛1,苏 婧1*,郑明霞1*,席北斗1,钱光人2
(1.中国环境科学研究院环境标准与风险评估国家重点实验室,北京 100012;2.上海大学环境与化学工程学院,上海 200444)
为定性及定量识别地下水中氮的污染来源,比例及迁移转化特征,对河北省张家口市宣化区洋河北岸主要供水区的地下水进行取样分析.基于土地利用类型,综合利用水化学分析方法耦合δ15N-NO3−,δ18O-NO3−双同位素示踪技术对研究区地下水硝酸盐污染来源,贡献率及迁移转化规律进行判断.研究结果表明:研究区氮污染以NO3−为主,12处采样点4次采样过程中约77%超出世界卫生组织标准(10mg/L)的限值,其污染在2018年8月(夏季)较为严重,空间浓度插值结果显示硝酸盐呈现出沿河及远岸点位浓度相对较低,中间较为稳定区域浓度较高的空间特征,并表现出不同土地利用类型上污染程度的差异性:旱地浓度最高,城镇次之.稳定同位素模型(SIAR)显示地下水硝氮污染来源中粪肥及生活污水占45.37%,土壤氮来源为41.39%,降水和化肥中NH4+来源占13.24%,与研究区以城镇和耕地为主的土地利用现状较为一致.此外,同位素特征值结果显示氮的迁移转化过程以硝化作用为主.文可为地下水氮的污染来源解析提供更加精准,全面的分析方法进而为污染的防治提供优先治理建议.
地下水;氮氧同位素;水化学;硝酸盐污染;SIAR
氮循环作为重要的物质循环体系已广泛参与到生物地球化学反应当中,随着人类活动的加剧,含氮化合物越来越多的释放到陆地环境中,而硝酸盐作为氮循环的重要组成之一,已成为地下水氮污染的主要形式[1].硝酸盐污染来源复杂,主要可分为来源于大气沉降,土壤有机氮等的自然源以及粪肥和生活污水,化肥,工业废水等的人为源[2],因此判断地下环境中硝酸盐污染的来源,比例及其迁移转化过程对氮污染防治具有重要的借鉴意义.
由于地下环境的隐蔽性和复杂性给地下水中氮的污染源解析工作带来诸多的困难,传统的判断地下水体中硝酸盐污染来源的方法是通过调查污染区土地利用类型并结合当地水化学特征来辨明污染源.随着研究的深入,扩散模型和受体模型应用到水体污染源解析领域,其中最常用的受体模型主要包括化学质量平衡法(CMB)[3]及多元统计法[4-5],其方法简便,但是得到的结果不够准确.而随着同位素技术的发展,利用硝酸盐中氮,氧同位素的特征值确定水体中硝酸盐的来源成为氮污染源解析的研究热点[6-7].张翠云[8],Johannsen等[9]利用氮,氧同位素识别了研究区硝酸盐污染的来源并对其迁移转化过程进行了判断.
虽然目前针对硝酸盐污染源解析问题已取得一定的研究成果,但总体上来说判断方法相对单一且较少对硝酸盐的污染来源进行量化.基于上述问题,本研究选取作为河北省张家口市宣化区工业及生活用水主要供水区的洋河北岸河漫滩为研究对象,基于土地利用类型,综合利用水化学分析方法耦合δ15N-NO3−,δ18O-NO3−双同位素示踪技术探究研究区地下水硝酸盐污染来源及迁移转化规律,并运用基于R统计软件的稳定同位素模型(SIAR)定量解析各硝酸盐污染来源的贡献率,旨在为地下水硝酸盐污染源解析提供更加精准,全面的分析方法进而为该区的氮污染防治提供优先治理借鉴.
1 材料与方法
1.1 研究区概况
研究区位于河北省张家口市宣化区洋河北岸,地处北纬40°30′~40°50′,东经114°50′~115°30′,属京,津都市圈和晋,冀,蒙经济圈.气候属中温带亚干旱气候,年降水量300~400mm,无霜期110~140d,年均气温7.7℃.
宣化区地处冀西北山间盆地至宣化盆地的北缘,是一个典型的新生代山间河谷断裂坳陷盆地,呈西北至东南方向展布,中心部位有洋河自西向东南穿流而过,盆地四周群山环抱,地势东北高,西南低,逐渐倾斜.平原,河川与山地,丘陵面积各半.第四系含水层沿洋河河谷带状平原最厚,向两侧山区逐渐变薄.以洋河为中心,两侧地形形态依次展示为河谷带状平原,山前斜地,中低山地3个地貌单元.第四系主要含水层分布于盆地中部-洋河冲积带状平原及洋河两侧各大支流在山前形成的规模不等的冲洪积扇地带,按含水层的岩性,结构,成因类型可分为山前冲洪积扇孔隙水与洋河带状平原孔隙水.地下水接受大气降水的垂直入渗补给,农田灌溉回渗补给和河流的入渗补给,另外还接受两侧山区向中部洋河的侧向径流补给.地下水径流方向主要从盆地南北两侧向盆地中部洋河流动,而后与洋河流动方向基本一致流出区外.地下水排泄主要为人工开采,潜水蒸发和地下径流排出盆地区外.农用地面积占全区土地面积的49.29%,建设用地占全区土地面积的24.73%,未利用地面积占全区土地面积的25.99%.
宣化区工业门类繁多,是张家口市冶金,机械和重化工基地,是河北省北厢地区重要的工业核心区,形成了以冶金,机械,造纸,装潢印刷,陶瓷,建材等为主体的工业体系.其次宣化区农业是典型的城郊型特色农业,形成了蔬菜,葡萄,规模化舍饲养殖“三大产业”.
1.2 样品采集与分析
为探究研究区地下水硝酸盐污染来源,于2017年11月,2018年3月,5月,8月,沿洋河北岸主要供水区周边进行实地调查和12处地下水样采集(其中11处为洋河周边采样点,1处为距洋河较远的对比点),采样点如图1所示,因氮的污染来源与采样点周边土地利用类型密切相关,为深入实际讨论研究区氮污染特征,通过资料收集与实地勘察详细刻画采样点周围土地利用类型,分别为:耕地(1,2,3,9,10,11,12号点位),城镇用地(5,7号点位),旱地(4,6,8号点位).距采样点较远的其他用地主要包括沙地,裸地,盐碱地等.地下水采样前先抽水 3min 左右,然后采用德国制造的多功能便携式测试仪Multi -340i/SET现场测定pH值,温度(T),溶解氧(DO),氧化还原电位(ORP),电导率(EC),用500mL 的塑料瓶采集水样装满并密封带回实验室按规定保存待测,分析水化学和同位素(δ15N和δ18O)指标.
在实验室条件下,利用离子色谱仪(戴安 ICS3000)测定 Cl-,SO42-等阴离子,NO3-的测定采用紫外分光光度法;NO2-采用a-萘胺比色法;NH4+采用纳氏试剂光度法.硝酸盐中δ15N,δ18O的测定利用特异性的反硝化细菌将硝态氮转化为 N2O,利用 Trace-Gas气体浓缩仪并结合 IRMS-100 连续流同位素比质谱仪.实验设置3组平行测试.同位素测试工作在中国农业科学院农业环境稳定同位素实验室完成.所有分析工作在一周之内完成.
1.3 稳定同位素源解析模型(SIAR)
为量化硝酸盐污染来源,选用基于贝叶斯方程的SIAR模型进行分析,该模型能够表征因为同位素分馏所引起的变异所产生的误差,并且它能够给出解析出的各个污染源的后验分布特征,最后得出的各污染源的贡献率为一个概率分布而非特定的值;且当有多个污染源时,该方法同样适用.模型表达如下:
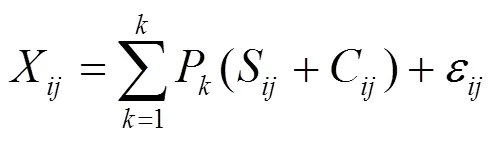
式中: Xij表示不同来源的第i种混合物的第j个同位素的值;Sjk表示第k种污染源的第J个同位素的值;Pk表示污染源中第k个来源的贡献比例;Cjk表示分馏系数;eij表示剩余误差,代表不同单个混合物之间不能确定的变量. 1.4 数据处理 本研究中利用ArcGIS10.2,Excel2016,Origin 2018, R语言对数据进行分析. 实验组部分章节采用病例讨论教学法。教学过程:(1)病例准备:课程讲授结束后安排1次病例讨论(3学时),提前2周将病例发给每位学生,提出需要讨论的内容。(2)分组讨论:将学生分组进行讨论,每组6~8人。(3)汇报结果:课堂上每组安排1名学生代表发言,汇报该组观点,然后由组内其他成员作补充,对发言进行纠正及点评。(4)教师点评:教师对病例分析的全过程进行总结归纳,对教学目标、重点、难点进行补充。(5)课后总结:要求学生根据病例中患儿的临床表现完成一份护理计划书。 2 结果与讨论 2.1 污染物时空分布特征 表1 研究区水化学指标及不同形态氮含量 Table 1 Hydrochemical indexes and nitrogen concentration in different forms in the study area 监测指标2017年11月2018年3月2018年5月2018年8月 T(℃)11.09±2.5111.67±3.1816.19±3.1216.28±2.78 DO(mg/L)6.3±1.397.45±1.745.79±2.444.84±1.58 NO3-(mg/L)13.18±6.6815.58±1017.23±8.0418.16±6.9 NH4+(mg/L)0.1±0.080.11±0.130.13±0.140.35±0.1 NO2-(mg/L)0.011±0.0070.011±0.0070.011±0.0070.004±0.013 Cl-(mg/L)124.96±77.2112.54±70.43118.07±66.48188.57±129.04 SO42-(mg/L)119.01±58.74120.55±48.14123.17±60.56186.4±83.76 EC(us/cm)1217.1±335.891047.5±398.31251.75±462.461204±484.56 δ15N-NO3−8.64±4.229.73±14.468.94±5.5110.38±5.87 δ18O-NO3−1.62±2.130.73±3.34-1.8±4.19-2.9±3.19 2.1.1 时间变化特征 研究区12处监测点位2017年11月,2018年3月,5月,8月各类理化指标:温度(T),溶解氧(DO),电导率(EC),硝酸盐氮(NO3-),氨氮(NH4+),亚硝酸盐氮(NO2-),氯离子(Cl-),硫酸根离子(SO42-)浓度统计结果见表1.可见12处地下水监测点位在2017年11月~2018年8月4次采样过程中硝酸盐浓度在3.3.6~30.37mg/L之间,平均浓度为16.04mg/L;超出世界卫生组织饮用水标准的限值[10] (10mg/L),超标率在77%左右,受人类活动影响,表现出随季节变化的特征,冬季浓度较低,夏季浓度较高,最高浓度出现在2018年8月,平均浓度为18.16mg/L,最低值出现在2017年11月,为13.18mg/ L.NH4+浓度在未检出~0.62mg/L之间,平均浓度为0.18mg/L,最高平均浓度出现在2018年8月,为0.35mg/L,最低值出现在2017年11月,为0.10mg/L,与NO3-变化趋势一致.NO2-浓度在未检出~ 0.047mg/L之间,平均浓度为0.009mg/L;冬季浓度较夏季浓度较高,与NH4+及NO3-的变化趋势相反,最低浓度出现在2018年8月,为0.004mg/L,其他月份平均浓度为0.011mg/L.“三氮”之间的时间差异一方面与研究区夏季温度高,随着温度的上升,降水量,人类生活用水量及农业化肥的施用量逐渐增大,伴随着大气降水,农田灌溉及河流入渗的地下水补给特征有关;另外与不同时期不同形式的无机氮在地层中的迁移转化有关.δ15N-NO3−值位于-2.75~ 56.69‰之间,2017年11月,2018年3月,5月,8月的平均值分别为8.64‰, 9.73‰,8.94‰,10.38‰,无明显随时间变化的趋势; δ18O-NO3−值位于-9.62~6.48‰之间,2017年11月, 2018年3月,5月,8月的平均值分别为1.62‰, 0.73‰, -1.8‰,-2.9 ‰,表现出持续降低的时间变化特征. 图2 研究区地下水指标浓度插值 Fig.2 Groundwater index concentration interpolation in the study area 2.1.2 空间变化特征 为直观的表现污染物的空间特征,基于ArcGIS浓度插值技术对研究区理化指标及同位素指标做空间变化分析,结果如图2所示,插值结果显示“三氮”表现出不同程度的空间差异性,其中NO2-, NH4+污染相对较轻,仅在沿河的11号点位浓度偏高,此外,NO3-,Cl-,SO42-,EC空间特征较为相似,均表现出沿河点位及远岸点位浓度相对较低,其他点位相对较高的特征,可能与河流影响及人类活动有关.而据研究表明,EC可作为地下水污染程度的判断标准,在无海水入侵的含水层地区,较高的EC说明该区地下水受到了污染[11].受人类活动的影响,水体中的Cl-污染来源主要有生活污水,农用化肥(如KCl等),人和动物的排泄物等.而高浓度的SO42-可能与工业废水,农业活动区施用的化肥有关.说明NO3-污染的来源很大程度上与人类活动的影响关系密切,来源于生活污水,农用化肥,人和动物的排泄物的可能性较大.且研究区采样点大部分位于人类活动较为密集的区域,因此受人类活动影响,这些导致地下水中Cl-,EC,SO42-浓度增加的污染源同时也是地下水中NO3-的污染源,因此初步判断该区地下水硝酸盐污染来源于人为源的可能性较大. δ15N-NO3−在8,9号点位平均浓度相对较低,分别为-0.77‰,0.58‰;7,11号点位浓度相对较高,分别为17.02‰,15.52‰,可能与污染源的混合来源有关. δ18O-NO3−在8号点位平均浓度相对较低,为-6.75‰;4,7,11号点位浓度相对较高,分别为3.14‰, 3.31‰,2.98‰,与δ15N-NO3−特征值表现出较为一致的空间变化特征. 图3 不同土地利用类型地下水指标浓度 Fig.3 Groundwater index concentration of different land use types 硝酸盐浓度及同位素的分布特征不仅表现为空间上的变化,土地利用类型的不同也影响其浓度的分布特征[12],如图3所示,具体表现为旱地(24.99mg/L)>城镇(13.84mg/L)>耕地(13.34mg/L),均超过世界卫生组织标准[10]的限值.其中土地利用类型为城镇地区的地下水硝酸盐浓度变化幅度较小,可能与其污染来源的单一有关;旱地区的地下水硝酸盐浓度最高,因其地面为不蓄水状态,在近表层土壤中硝氮质量分数较高[13],而耕地土地的截污能力较差,在农业发展过程中,化肥的大量使用会影响水质[14].此外,耕地及旱地区的地下水硝酸盐浓度变化幅度最大,由图1可知,其周围有较大范围的城镇用地,推断造成其污染的来源较为广泛.因此,推断研究区水力联系较为密切,不同的来源及其迁移转化影响地下水硝酸盐的质量浓度和空间分布 [15].δ15N, δ18O同位素的值域范围表现为城镇用地的均值最高,分别为13.80‰,1.27‰,与生活污染来源密切相关. 一是要协调人民内部矛盾。利益冲突是人民内部矛盾的根源和基础。基层警务工作要依靠依法照章办事,切实保障人民的根本利益。[7]基层警务机关要按照“发现得早、控制得住、处置得好”的总体要求,根据有关信息,及时了解当前社会的核心问题并且及时处理。高度关注重点领域、重点行业、重点地区的动向,健全和完善维护稳定的预警工作机制。在政府的统一领导下,基层警务工作者应该主动配合有关部门进行问题调查,根据调查情况进行针对性的行动,协调人民群众通过正常渠道反映问题,指导群众通过法律手段维护自身权益,通过源头上即基层方面的控制来保证社会的稳定。 2.2 地下水硝酸盐的来源与迁移转化 2.2.1 基于氮氧双同位素的地下水硝酸盐污染来源解析 氮氧同位素特征对于硝酸盐污染来源具有较好的指示意义,通过梳理国内外对硝酸盐中δ15N-NO3−和 δ18O-NO3−同位素的特征值研究,结合我国不同硝酸盐污染来源的差异性绘制δ15N-NO3−, δ18O-NO3−同位素特征值表,分析研究区4次采样过程中利用细菌反硝化原理得到的同位素特征值,由表1及图4可知,研究区地下水体硝酸盐氮氧同位素值域大部分位于粪肥及生活污水的范围内,少部分位于土壤氮及降水和化肥中NH4+范围内,说明研究区粪肥及生活污水可能是主要造成地下水NO3-污染的来源,其次为土壤氮来源.这一研究结论与水化学分析结果较为一致. 图4 研究区δ15N-NO3−, δ18O-NO3−同位素特征值 Fig.4 δ15N-NO3−, δ18O-NO3− isotopic characteristic values in the study area 2.2.2 地下水硝酸盐迁移转化规律研究 通过水化学耦合同位素技术得出研究区地下水硝酸盐污染来源主要为人类活动造成的粪肥及生活污水源,部分来源于土壤氮及降水和化肥中NH4+,但不同的NO3−源在进入水体之前的迁移转化过程中,由于物理,化学和生物转化过程的影响,会发生同位素分馏 [16].氮同位素参与的动力学分馏作用过程有硝化作用,反硝化作用,扩散作用,矿化作用,同化作用,固氮作用.其中矿化作用,同化作用和固氮作用不会产生较大的分馏效应[1].因此,分析研究区氮的迁移转化过程(硝化作用,反硝化作用)具有重要意义,能够更好的为氮污染防治提供依据[17]. 高铁会促进民航票价的稳定,二者之间相互制约,相互竞争,有利于价格的均衡。高铁有效改善了民航运输业的垄断性,有利于促进民航降低票价,优化服务。高铁的运营,可以采取针对老年乘客的特殊服务策略,更多地考虑老人的感受,也可以进行早高峰晚高峰和其余时间的差别定价,可以针对女性旅客开设女性候机室等来优化服务[2]。 反硝化作用的机理是:微生物利用硝酸盐作为电子受体氧化有机碳,从而发生反硝化作用,使硝酸盐脱氮.反硝化作用可以导致NO3-基质的同位素值富集[18],该反应对15NO3-和14NO3-显出差异,14NO3-倾向于成为电子受体,因此剩余硝酸盐富集15N.这也就是利用氮同位素技术识别硝化作用的最基本机理.氮循环过程中反硝化作用是改变地下水中硝酸盐浓度的主要生化过程,反硝化作用使N,O同位素重度富集,富集因子一般分别在-40‰~-5‰和-18‰~-8‰之间[19-20],满足瑞利方程:δR=δR0+εln (R/R0)[21].因此,根据δ15N-NO3-值与 ln[NO3-]呈线性反相关关系可以判断该区地下水中存在反硝化作用[22],并且国内外很多研究表明反硝化可引起 δ18O-NO3−和 δ15N-NO3−值同比升高,两者比率接近0.5(1:1.3~1:2.1之间)[23-25]. 图5 研究区NO3--N 浓度的自然对数与δ15N-NO3−和δ18O-NO3−同位素相关性 Fig.5 The correlation between natural logarithm of the NO3−-N concentration and δ15N-NO3−,δ18O-NO3− isotopic in the research area 研究区4次采样中获得的δ18O/δ15N比值分别为0.24,0.48,0.34,0.31,且r2分别为0.11,0.48,0.12, 0.27,相关度较差,基本上不在反硝化引起的δ18O/ δ15N比值范围内.此外由图5中NO3−-N浓度的自然对数与δ15N-NO3−,δ18O-NO3−同位素相关性可知ln(NO3−)与δ18O-NO3−存在线性正相关关系,与研究结论相反,ln(NO3−)与δ15N-NO3−虽存在线性负相关关系但相关性较低,此外,Gillham等[26]在野外调查研究中经统计分析认为,地下水环境中反硝化作用的DO上限为2.0mg/L;Desimone等[27]对地下水NO3--N污染晕的监测分析发现,虽然DO在浓度为2~6mg/L的条件下仍有反硝化作用的存在,但反硝化速率很小.而据监测结果显示,研究区12处监测点位DO 浓度在3.37~8.16mg/L之间,平均浓度为6.10mg/L,为不利于反硝化反应发生的环境,因此基本可以判定研究区NO3--N在迁移转化过程中基本不存在反硝化反应. 相关研究表明,硝化作用过程中结合的氧原子2/3来自于H2O,1/3来自于O2.硝化作用产生的硝酸盐δ18O-NO3-值为-10‰~+10‰[28].而根据4次不同时间段内得到的δ18O-NO3-同位素特征值显示,其值域范围在-9.62~6.48‰之间,均在硝化反应的特征值范围内.因此判断该区氮的迁移转化过程以硝化反应为主. 2.3 SIAR模型计算研究区地下水硝酸盐各污染来源的贡献率 据上述分析,硝酸盐污染来源主要为粪肥及生活污水(M&S),土壤氮(Soil)及降水和化肥中NH4+(NF&R) 3种污染来源,且迁移转化作用以硝化作用为主,基本上不存在反硝化作用,因此利用SIAR模型计算硝酸盐各源的贡献率时假设分馏因子Cjk=0.根据模型输出结果(如图6所示)发现研究区硝酸盐污染来源表现为:粪肥和生活污水(45.37%)>土壤氮(41.39%)>降水及化肥中的氨氮(13.24%).模型运算结果与研究区以城镇和耕地为主的土地利用类型现状较为相符.因此,判断该区地下水硝酸盐污染的来源受人类生产生活过程中污水,粪肥的排放及农药化肥的施用的影响较大.在污染治理过程中应加强城镇污水设施建设,控制化肥的使用量. 图6 SIAR模型计算各污染源的贡献率 Fig.6 The SIAR model calculates the contribution rate of each pollution source 本研究利用SIAR模型定量计算各污染源的贡献率时虽然与水化学法结合氮氧同位素的分析结果较为一致,但仍存在很大的不确定性,未考虑同位素分馏及季节性变化的影响给研究结果带来的一定误差,在未来的研究中应加强对SIAR模型的矫正. 3 结论 3.1 研究区地下水存在不同程度污染.在溶解性无机氮中,NO3−-N是主要的形式,超标率在77%左右且表现出夏季较为严重,沿河污染较轻的空间特征. 3.2 受人类活动影响及土壤生化反应的影响,不同的土地利用类型的地下水硝酸盐污染程度不同且地下水氮的迁移转化过程以硝化反应为主,基本不存在反硝化作用. 3.3 SIAR模型结果显示地下水硝氮污染来源中以粪肥及生活污水为主,占45.37%,其次为土壤氮(41.39%)及降水和化肥中的NH4+(13.24%) 参考文献: [1] 张 金,马金珠,陈春武,等.硝酸盐氮氧同位素在不同生态系统中的研究进展[J]. 干旱区地理, 2015,38(2):312-319. Zhang J, Ma J Z, Chen C W, et al. An overview on application of dual isotope compositions of nitrate in different ecosystems [J]. Aird Land Geography, 2015,38(2):312-319. [2] 赵庆良,马慧雅,任玉芬,等.利用δ15N-NO3-和δ18O-NO3-示踪北京城区河流硝酸盐来源[J]. 环境科学, 2016,37(5):1692-1698. Zhao Q L, Feng H Y, Ren Y F, et al. δ15N-NO3- and δ18O-NO3-Tracing of Nitrate Sources in Beijing Urban Rivers [J]. Environmental Science, 2016,37(5):1692-1698. [3] GLESER L J. Some thoughts on chemical mass balance models [J]. Chemometr Intel Lab, 1997,37:15-22. [4] Sofowote U M, Mccarry B E, Marvin C H. Source apportionment of PAH in Hamilton Harbour Suspended Sedi ments: Comparison of two factor analysis methods [J]. Environmental Science & Technology, 2008,42(3):6007-6014. [5] Zhou F, Gprdon H H, Guo H C, et al. Spatio - Temporal patterns and source apportionment of coastal water pollution in Eastern Hong Kong [J]. Water Research, 2007,41(6):3429-3439. [6] Xing M, Liu W. Using dual isotopes to identify sources and transformations of nitrogen in water catchments with different land uses, Loess Plateau of China [J]. Environmental Science and Pollution Research, 2016,23(1):388-401. [7] Li R, Ruan X, Bai Y, et al. Effect of wheat-maize straw return on the fate of nitrate in groundwater in the Huaihe River Basin, China [J]. Science of The Total Environment, 2017,592:78-85. [8] 张翠云,张 胜,李政红,等.利用氮同位素技术识别石家庄市地下水硝酸盐污染源[J]. 地球科学进展, 2004,19(2):183-190. Zhang C Y, Zhang S, Li Z H, et al. Using nitrogen isotope techniques to identify the sources of the nitrate contamination to the groundwater beneath Shijizhuang city [J]. Advance in Earth Sciences, 2004, 19(2):183-190. [9] Johannsen A, Daehnke K, Emeis K. Isotopic composition of nitrate in five German rivers discharging into the North Sea [J]. Organic Geochemistry, 2008,39(12):1678-1689. [10] World Health Organization. Guidelines for drinking-water quality. WHO, Geneva, Switzerland. 1984. [11] 金赞芳.城市(杭州)地下水污染源解析与修复技术研究[D]. 浙江大学, 2004. Jin Z F. Analysis and remediation of groundwater pollution sources in Hangzhou [D]. Zhejiang University, 2004. [12] Bu H, Zhang Y, Meng W, et al. Effects of land-use patterns on in-stream nitrogen in a highly-polluted river basin in Northeast China [J]. Science of the Total Environment, 2016,553(553):232-242. [13] 张玉玲,司超群,陈志宇,等.土壤硝酸盐氮的空间变异特征及影响因素分析[J]. 吉林大学学报:地球科学版, 2018,48(1):241-251. Zhang Y L, Si C Q, Chen Z Y, et al. Spatial variability of soil nitrate nitrogen and its influencing factors. Journal of Jilin University (Earth Science Edition), 2018,48(1):241-251. [14] 张 妍,毕直磊,张 鑫,等.土地利用类型对渭河流域关中段地表水硝酸盐污染的影响研究[J]. 生态学报, 2019,39(12):1-8. Zhang Y, Bi Z L, Zhang X, et al. Effects of land-use types on nitrate pollution of surface water in Guangzhou area in the Weihe River basin [J]. Acta Ecologica Sinica, 2019,39(12):1-8. [15] 孔晓乐,王仕琴,丁 飞,等.基于水化学和稳定同位素的白洋淀流域地表水和地下水硝酸盐来源[J]. 环境科学, 2018,39(6):2624-2631. Kong X L, Wang S Q, Ding F, et al. Source of nitrate in surface water and shallow groundwater around baiyangdian lake area based on hydrochemical and stable isotopes [J]. Environment Science, 2018, 39(6):2624-2631. [16] Nestler A, Berglund M, Duta S, et al. Isotopes for improved management of nitrate pollution in aqueous resources: review of surface water field studies [J]. Environ Sci Pollut Res Int, 2011,18(4): 519-533. [17] 王开然,郭芳,姜光辉,等.15N和18O在桂林岩溶水氮污染源示踪中的应用[J]. 中国环境科学, 2014,34(9):2223-2230. Wang K R, Guo F, Jiang G H, et al. Application of 15N and 18O to nitrogen pollution source in karst water in Eastern Guilin [J]. China Environmental Science, 2014,34(9):2223-2230. [18] Sebilo M, Billen G, Mayer B, et al. Assessing Nitrification and Denitrification in the Seine River and Estuary Using Chemical and Isotopic Techniques [J]. Ecosystems, 2006,9:564–577. [19] Sebilo M, Billen G, Grably M, et al. Isotopic composition of nitrate-nitrogen as a marker of riparian and benthic detrification at the scale of the whole Seine river system [J]. Biogeochemistry, 2003,63: 35–51. [20] Lehmann M F, Reichert P, Bernasconi S M, et al. Modeling nitrogen and oxygen isotope fractionation during denitrification in a lacustrine redox-transition zone [J]. Geochimica et Cosmochimica Acta, 2003, 67(14):2529–2542. [21] Mariotti A, Germon J C, Hubert P, et al. Experimental determination of nitrogen kinetic isotope fractionation: Some principles; illustration for the denitrification and nitrification processes [J]. Plant and Soil, 1981, 62(3):413-430. [22] Chen J, Tang C, Yu J. Use of 18O, 2H and 15N to identify nitrate contamination of groundwater in a wastewater irrigated field near the city of Shijiazhuang, China [J]. Journal of Hydrology, 2006,326(1): 367-378. [23] Xue D M, Botte J, Baets B D, et al. Present limitations and future prospects of stable isotope methods for nitrate source identification in surface- and groundwater. [J]. Water Research, 2009,43(5):1159- 1170. [24] Mengis M, Schif S L, Harris M, et al. Multiple geochemical and isotopic approaches for assessing ground water NO3− elimination in a Riparian Zone [J]. Groundwater, 2010,37(3):448-457. [25] Fukada T, Hiscock K M, Dennis P F, et al. A dual isotope approach to identify denitrification in groundwater at a river-bank infiltration site [J]. Water Research, 2003,37(13):3070-3078. [26] Trudell M R, Gillham R W, Cherry J A. An in-situ study of the occurrence and rate of denitrification in a shallow unconfined sand aquifer [J]. Journal of Hydrology, 1986,83(3):251-268. [27] Desimone L A, Howes B L. Nitrogen transport and transformations in a shallow aquifer receiving wastewater discharge: A mass balance approach [J]. Water Resources Research, 1998,34(2):271-285. [28] Kendall, Carol, Elliott, et al. Tracing Anthropogenic Inputs of Nitrogen to Ecosystems [J]. Stable Isotopes in Ecology & Environmental Science, 2007:375-449. Source of nitrate in groundwater based on hydrochemical and dual stable isotopes. FU Xue-mei1,2, SUN Yuan-yuan1, SU Jing1*, ZHENG Ming-xia1*, XI Bei-dou1, QIAN Guang-ren2 (1.Chinese Research Academy of Environmental Science, State Key Laboratory of Environmental Criteria and Risk Assessment, Beijing 100012, China;2.School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China). China Environmental Science, 2019,39(9):3951~3958 Abstract:The groundwater samples of the north bank of Yanghe, Xuanhua District, Zhangjiakou City, Hebei Province were selected, to identify the pollution source, ratio, migration and transformation characteristics of nitrogen in groundwater by qualitative and quantitative methods. Land type analysis, hydrogeochemistry analysis, and isotope tracer technique of δ15N-NO3−and δ18O-NO3− were used in the study. The results showed that the main contaminant of nitrogen pollution was NO3− in the study area, and 77% samples during four sampling sessions at 12 sampling points exceeded World Health Organization standard value 10mg/L. The serious pollution period was in August 2018. According to spatial concentration interpolation results, the lower nitrate concentration was along the river and the offshore area, and the higher was in the middle area. Different land use type had different concentration, dry land had highest and urban system had higher concentration. The results of stable isotope model (SIAR) showed that the proportion of groundwater nitrate pollution sources were 45.37%, 41.39%, and 13.24% for manure and domestic sewage, soil nitrogen, and NH4+ in rainfall and fertilizers. The result was consistent with the land use types. Besides, nitrification was dominated migration and transformation process of nitrogen. The study can provide more accurate and comprehensive analysis method for groundwater nitrogen pollution sources analysis, and recommendation for groundwater pollution control. Key words:groundwater;nitrate-oxygen isotope;hydrochemical;nitrate pollution;SIAR 中图分类号:X523 文献标识码:A 文章编号:1000-6923(2019)09-3951-08 作者简介:傅雪梅(1992-),女,山东青州人,硕士研究生,研究方向为地下水污染防控.发表论文2篇. 收稿日期:2019-02-27 基金项目:国家水体污染控制与治理科技重大专项(2018ZX07109-001) * 责任作者, 郑明霞, 高级工程师, zhengmx@craes.org.cn; 苏婧, 研究员, sujing169@163.com

