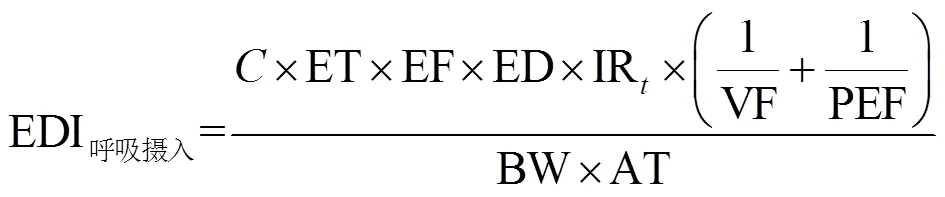长江流域岸边土中OCPs的残留特征、来源及风险评价
鲁垠涛,薛宏慧,张士超,裴 晋,向鑫鑫,王雪雯,孙绍斌,姚 宏*
长江流域岸边土中OCPs的残留特征、来源及风险评价
鲁垠涛1,2,薛宏慧1,2,张士超3,裴 晋1,2,向鑫鑫1,2,王雪雯1,2,孙绍斌1,2,姚 宏1,2*
(1.北京交通大学土木建筑工程学院,北京 100044;2.水中典型污染物控制与水质保障北京市重点实验室,北京 100044;3.中国铁道科学研究院集团有限公司节能环保劳卫研究所,北京 100081)
选取长江流域干流及支流周围的土壤作为研究介质,分析表层土壤中13种有机氯农药(OCPs)的含量,用同分异构体比值法和主成分分析法解析其来源,并对土壤中的OCPs进行风险评估.结果表明,长江流域表层土壤中∑13OCPs的含量范围为8.94~77.79ng/g,平均含量是24.55ng/g ,主要成分是六HCHs和DDTs.OCPs的含量水平表现为上游与下游相近,且二者均小于中游,在世界范围内处于中等水平.土壤中的HCHs主要来自于林丹的历史残留; DDTs主要来自于三氯杀螨醇的近期输入和工业DDTs的非法使用.健康风险评价表明,中游地区的风险高于上游及下游地区,特别是在城陵矶、南嘴和湘阴3个地区,土壤中OCPs对儿童的致癌风险Risk综合处于10-6~10-4,存在一定的致癌风险.
长江流域;岸边表层土;有机氯农药;健康风险评估
有机氯农药(OCPs)因其效率高、成本低等优点曾在全世界范围内广泛使用[1].20世纪60年代,人们逐渐发现OCPs在环境中具有长久性、生物累积性及毒性,极难降解,对生态环境和人类健康造成重大威胁[2].尽管我国从1983年以来逐步禁止了DDTs、HCHs等OCPs的生产和使用,但土壤环境中依然有OCPs类物质的残留.广东省农业土壤中OCPs的检出率为99.8%,含量范围在n.d.~ 936.94ng/g之间[3];兰州西固区土壤中8种OCPs异构体的检出率均为100%,总质量比范围在18.34~ 125.34ng/g之间,平均值为54.84μg/kg[4].土壤是OCPs迁移和传输过程中发挥重要作用的环境介质之一,研究土壤中OCPs的分布特征有助于了解这一地区OCPs的总体污染情况.
长江是全国除沿海开放地区以外,经济密度最大的经济地带.目前,一些研究人员对长江水系武汉段河水中的OCPs,如p,p'-DDT、-HCH、艾氏剂残留对水生生物的生态风险[5],沉积物中DDTs的含量水平、污染生态风险[6]等进行了研究,但这些研究主要针对水体和沉积物,且集中于长江的特定某段,对长江全流域土壤介质中OCPs的研究则鲜有报道.
HCHs和DDTs是我国历史上使用规模最大的农药,现有研究多集中于这2类OCPs,在这两类物质8种同系物的基础上增加了5种常用且研究较多、危害较大的OCPs,对它们的残留特征、来源及风险进行了研究,可以更全面的了解长江流域岸边土中的OCPs污染情况.
本文以长江全流域作为研究区域,横跨9个省、市,以干流及支流周围的土壤作为研究介质,分析了表层土壤中13种OCPs的含量,并进行了来源解析和风险评估,为长江流域岸边表层土中有机氯农药的污染状况提供数据依据.
1 材料和方法
1.1 研究区域
长江流域位于东经90°~122°,北纬26°~32°,横跨中国东部、中部和西部3大经济区,干流全长6397km,流域总面积180万km2.地处亚热带,年平均降水量1067mm,江源地区年降水量小于400mm,属于干旱带;流域内大部分地区在800~1600mm,属湿润带.长江干流宜昌以上为上游,宜昌至湖口为中游,湖口至长江入海口为下游.
1.2 样品采集
对长江全流域湖北段34个国控断面距岸边2m左右位置进行表层土调查采样.采样点如图1所示,样品采集点沿江分布,共34个土壤样品,其中包括干流断面17个,支流断面17个,途经9个省、市(云南、四川、重庆、湖北、湖南、河南、江西、安徽和江苏).根据长江流域的地理特征,将研究区域分为3个部分:长江上游(石鼓、屏山、向家坝、宜宾、高场、泸州、朱沱、北碚、小河坝、寸滩、武隆、武胜、罗渡溪、巴东、庙河、夜明珠、晓溪塔和宜昌);长江中游(沙市、城陵矶、螺山、湘阴、南嘴、周文庙、武汉、集家嘴、白河、丹江口、陶岔、襄阳和仙桃);长江下游(大通、南京和镇江).土壤样品的采集使用不锈钢铲,采用多点采集、混合取样的方法采集表层(0~5cm)的土壤样品,去除其中的石子、贝壳、虫子、植物碎片等杂物,放在处理好的铝盒中保存.冷藏保存运输回实验室后,放入-20℃的冰箱保存.样品经冷冻干燥研磨过20目筛网后进行后续处理.
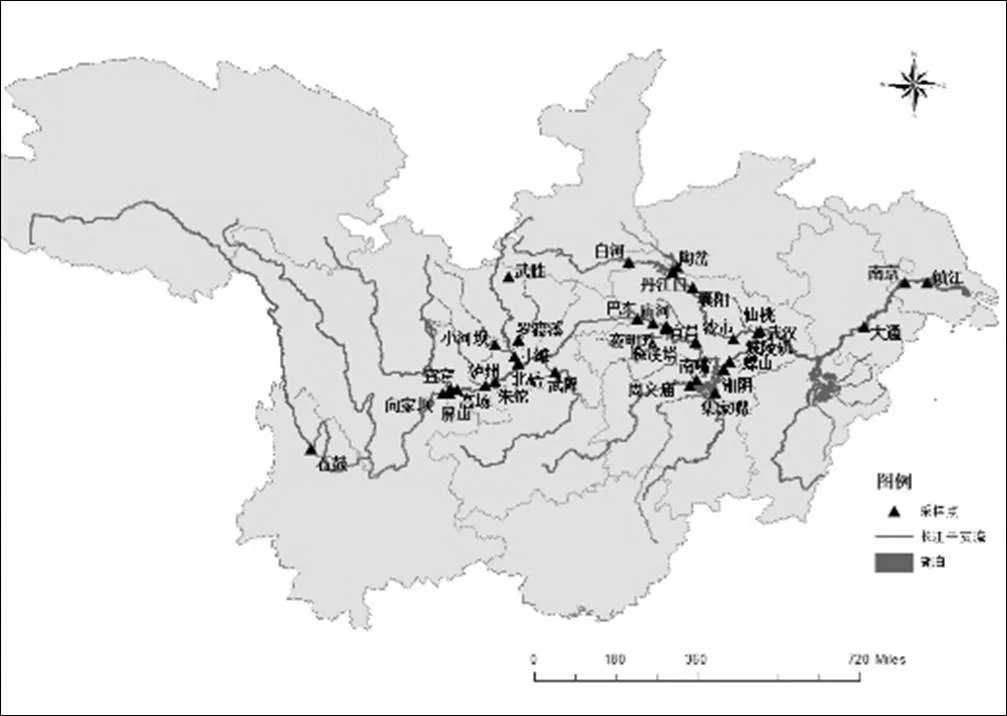
图1 采样点示意
1.3 前处理方法
准确称量10g经冷冻干燥处理后的土壤样品,加入等量的无水硫酸钠,加入100μL代标物质(Naphthalene-D8、Fluorene-D10、Pyrene-D10、Perylene-D12、CB155),用140mL正己烷/丙酮(V/V,1:1)索氏萃取24h.提取液加入3~4mL异辛烷在旋蒸仪(温度为35℃)上浓缩至2~3mL,再经过硅胶层析柱,用预清洗过的脱脂棉、2g左右的无水硫酸钠、10g活化后的硅胶和2g的无水硫酸钠进行净化.采用70mL的正己烷/二氯甲烷(V/V,1:1)混合溶液淋洗净化层析柱,洗脱液加入3~4mL的异辛烷进行旋转蒸发浓缩至1~2mL,最后氮吹加入内标物质定容到1mL,混匀转移至棕色色谱瓶中待至仪器分析[7].
1.4 仪器分析测定
本文测定了13种OCPs,分别为α-HCH、β-HCH、γ-HCH、o,p'-DDE、o,p'-DDT、p,p'-DDE、p,p'-DDD、p,p'-DDT、艾氏剂(Aldrin)、狄氏剂(Dieldrin)、七氯(Heptachlor)、六氯苯(HCB)和反式九氯(TN).采用Agilent6890N 型气相色谱(GC-ECD)仪,色谱柱为DB-5MS毛细管色谱(60m×0.25mm× 0.25µm),色谱柱升温程序为:初始温度为80℃保持1min,然后以10℃/min的速度升温至160℃,再以2 ℃/min的速度升温至250℃,最后以30℃/min的速度升温至300℃,恒温5min;恒流无分流进样2.0μL,流速设定为0.8mL/min.使用内标法对OCPs测定进行定量.
1.5 质量控制和质量保证
本实验同一批处理34个土壤样品,每10个样品做一个空白样,以确定样品预处理过程中是否受到试剂、仪器以及人为因素的干扰.在相同条件下处理一个基质加标样,来检测预处理方法的回收率.在实验过程中采用添加代标物和内标物来检验每个样品目标物的回收率.所有空白样品中目标OCPs同系物的含量均很低.所有代标的回收率均处于86.64%~127.26%,满足美国EPA对代标回收率70%~130%的要求,未对实验数据进行回收率修正.
1.6 健康风险评价
本文采用美国国家环境保护署(USEPA)推荐的方法计算OCPs对人体健康产生的致癌风险(Risk)和非致癌风险(HI)[8-9].OCPs暴露于人体的3条途径分别是经口摄入、呼吸摄入和皮肤接触,按照以下公式计算不同途径OCPs的长期摄入剂量.