ELISA与HPLC-MS对饲用玉米中2种霉菌毒素的比较分析
钟兴文, 王炳彦, 陈 琛, 杨旭艳 , 杨秀娟,陈 莹, 孙照程, 华雪妃, 孔凡虎, 章雨竹, 陶琳丽*
(1.云南农业大学动物科学技术学院,云南省动物营养与饲料重点实验室,云南昆明 650201;2.牟定县新桥镇畜牧兽医站,云南楚雄675501;3.大理白族自治州动物卫生监督所,云南大理 671000)
赤霉烯酮(ZEA)是一种非类固醇的具有雌激素效应的镰刀菌毒素,主要污染玉米、小麦、大麦等谷物作物,毒素可作用于畜禽的生殖系统,引起雌性动物产生雌激素过多综合征和严重的生殖道症状及不孕症,同时会对动物机体产生遗传毒性、免疫毒性、细胞毒性和致肿瘤毒性(祭芳等,2019;姜淑贞等,2011)。T-2毒素也是污染我国饲料原料的主要霉菌毒素之一,被列为最危险的天然污染源之一,主要表现为基因毒性、细胞毒性和血液毒性,能够通过食物链的传递和生物体的蓄积作用,污染谷物及其制品,进而对畜禽及其产品的安全性甚至人体健康构成严重威胁(薛山等,2013)。大量研究表明,ZEA和T-2毒素在我国玉米中有很高的污染率,且这两种毒素对畜禽生产和人类自身都有巨大的危害(杜妮,2018;梁琛等,2017)。因此,加强对玉米中ZEA和T-2毒素的监测有利于保障生产者和消费者的切身利益,对饲料工业、畜牧业和农业的可持续发展也有着重大意义。
目前霉菌毒素的检测方法主要有生物学方法、免疫学方法和化学仪器分析法等,根据检测效率的快慢,又可分为快速方法和确认方法(Agag,2004)。快速筛选霉菌毒素的方法以酶联免疫(ELISA)法较为常用,该法具有操作简单方便、成本较低、检测快速等优点,适合大批量样品的快速检测,但因所需抗原、抗体灵敏度较高,易出现假阳性反应,导致检测结果不准确。而确认方法主要基于色谱法,如气相色谱法(Tarter等,1991)、高效液相色谱法(梁雄宇等,2011)、液相色谱-串联质谱联用法等 (赵孔祥等,2011;Beltran等,2009)。高效液相色谱-串联质谱联用(HPLC-MS)法集高效分离和多组分定性和定量检测于一体,是理想的检测方法,逐渐成为霉菌毒素检测的主流方向,但对检验人员的技术要求较高 (王瑞国等,2015)。基于检测霉菌毒素的重要性,本研究采用ELISA和HPLC-MS对饲用玉米中的ZEA和T-2毒素进行检测,旨在比较两种方法对饲用玉米中ZEA和T-2毒素的检测效果。
1 材料与方法
1.1 样品采集与制备 在多家饲料厂采集饲用玉米30份。采集方法严格按照 《饲料采样法》(GB/T14699.1-2005)的要求,用四分法缩减取200 g,用粉碎机粉碎后过40目筛,混匀装入自封袋中备用,样品在测定前于-20℃冰箱中密封保存。
1.2 主要仪器 ST-360酶标仪 (上海科华实验系统有限公司);TSQ QUANTIVA高效液相色谱—串联质谱仪 (Thermo Scientific);300 g摇摆式高速万能粉碎机 (温岭市林大机械有限公司);SHA-B恒温振荡器(常州智博瑞仪器制造有限公司);H2050R高速冷冻离心机 (湘仪离心机有限公司)。
1.3 主要试剂 甲醇、乙酸、甲酸、乙腈,均为色谱纯,购自天津市光复有限公司;氯化钾、氯化钠、磷酸二氢钾、十二水合磷酸氢二钠、吐温-20、盐酸、氢氧化钠,均为分析纯,购自天津市风船化学试剂科技有限公司;玉米赤霉烯酮标准品和T-2毒素标准品,购自国家标准物质中心;黄曲霉毒素B1/玉米赤霉烯酮/T-2毒素三合一免疫亲和柱,购自北京华安麦科生物技术有限公司;ELISA试剂盒,购自北京龙科方舟生物工程有限公司。
1.4 酶联免疫法 ZEA预处理:称取(5±0.1)g制备的玉米样品于50 mL离心管中,加入25 mL 70%甲醇溶液,在恒温振荡器(200~300 r/min)上充分振荡提取3 min,静置后取上清液,4000 r/min离心5 min,向900μL ZEA样品稀释液中加入离心后的上清液100μL,混匀待检;T-2预处理:同ZEA处理,最后一步改为向950μL的T-2毒素样品稀释液中加入离心后的上清液50μL,混匀待检。将ZEA和T-2毒素的待检样品按照各自的试剂盒方法进行操作,最后在酶标仪450 nm/630 nm双波长下检测其吸光度,然后根据样品的百分吸光度计算ZEA和T-2毒素的含量。ELISA法对ZEA和T-2毒素的检出限分别为25μg/kg和 20μg/kg。
1.5 高效液相色谱-串联质谱联用法 参考NY/T 2071-2011《饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定 液相色谱-串联质谱法》进行测定,其过程是利用试样中的霉菌毒素经乙腈溶液提取,正己烷脱脂及霉菌毒素多功能净化柱净化后,氮气吹干,甲酸乙腈溶液复溶,用液相色谱-串联质谱法测定,采用色谱保留时间和质谱碎片及其离子丰度比定性,外标法定量。HPLCMS法对ZEA和T-2毒素的检出限分别为5μg/kg和 1μg/kg。
1.5.1 样品预处理 样品提取:称取(5±0.01)g玉米样品于50 mL离心管中,加入25 mL 80%乙腈-水溶液(乙腈∶水=80∶20)提取,在恒温振荡器(250 r/min)上剧烈振荡 20 min,然后 4000 r/min离心5 min,取5 mL离心后的上清液加入35 mL稀释液稀释,混匀,取20 mL滤液过柱。样品净化:取出接近室温的免疫亲和柱,将20 mL注射器的下端直接穿透亲和柱上方的塞子,完成注射器筒与亲和柱的连接,去掉亲和柱下方堵头,将其插在固相萃取装置的架子上进行固定,完成亲和柱与固相萃取装置的连接,在注射器针筒内装上20 mL滤液,调节固相萃取开关,使滤液以1~2滴/s的速度流出,待液体排干后,先用10 mL洗涤液(0.1%Tween-20水溶液)洗涤一次,排干;再用10 mL超纯水洗涤一次,流速为2~3滴/s;待液体排干后,关闭固相萃取开关。样品洗脱:在亲和柱内加入 2 mL洗脱液(甲醇:乙酸=98:2),静置 3 min后,以1滴/秒速度洗脱,用10 mL的玻璃试管收集洗脱液,调节氮吹仪的参数,控制适宜的氮气流速,在50℃的氮气下吹干洗脱液,用1 mL甲酸乙腈(1∶1)溶液复溶,再用涡旋振荡器振荡5~10 min使霉菌毒素和复溶液充分溶解,用1 mL注射针筒吸出溶解液,过0.22μm的有机滤膜,装瓶上机。
1.5.2 液相色谱条件 色谱柱:C18柱 (长度50 mm,内径1.9μm);流动相:0.1%的甲酸溶液和1∶1的甲醇乙腈溶液;流速:0.3 mL/min;柱温:33℃;进样量:5μL;质谱检测器。流动相、流速及洗脱条件如表1和表2所示。
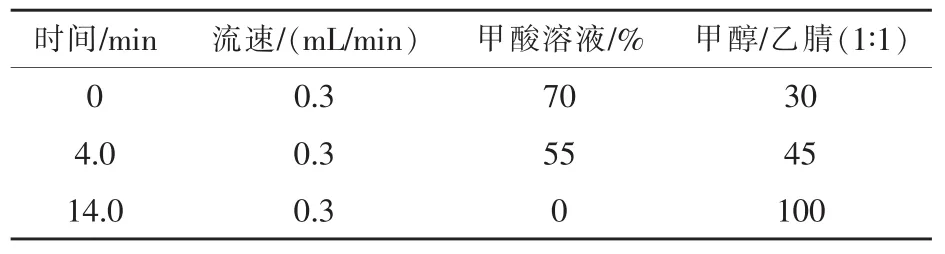
表1 ESI+源梯度洗脱条件
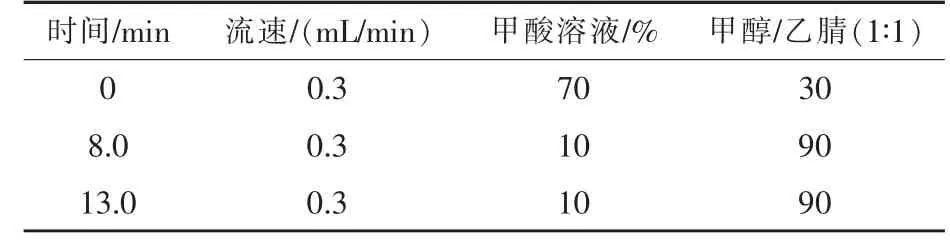
表2 ESI-源梯度洗脱条件
1.5.3 质谱条件 离子源:电喷雾离子源;扫描方式:正离子扫描模式和负离子扫描模式;检测方式:多反应监测;毛细管电压,模式4000 V,负模式3500 V;干燥气温度:350℃;雾化气压力:40 psi;脱溶剂气、锥孔气均为高纯氮气;碰撞气为高纯氩气。
1.6 限量标准 玉米赤霉烯酮(ZEA)和T-2毒素均参照 《饲料卫生标准》(GB13078-2017),ZEA≤500 μg/kg;T-2≤ 500 μg/kg。
1.7 数据处理 所有实验数据均用Microsoft Excel进行整理分析。
2 结果与分析
2.1 玉米赤霉烯酮的检出结果 由表3可知,使用ELISA法和HPLC-MS法对饲用玉米中ZEA的检出率均为100%,且两种方法检出结果最高的均是18号玉米样品,检出值分别为918.80μg/kg和345.01μg/kg。ELISA法检出结果最低的是11号玉米样品,含量为28.07μg/kg,对应HPLC-MS法检出值为12.97μg/kg。而HPLC-MS法检出结果最低的是17号玉米样品,含量为5.00μg/kg,对应的ELISA法检出值却为99.47μg/kg,远高于HPLC-MS法。即HPLC-MS法测定ZEA的最高、最低含量均低于ELISA法测定的结果。根据2017版的《饲料卫生标准》中ZEA的限量标准(ZEA≤500μg/kg),ELISA法检测超标数量有 3个,而HPLC-MS法则无超标样品。两种检测方法对ZEA的检出结果相差最大的是13号玉米样品,相差值为810.06μg/kg;检出结果相差最小的是8号玉米样品,相差值为1.61μg/kg,其他玉米样品的检测结果均有不同程度差异。实验结果表明,1号、15号、20号样品的检测结果是HPLC-MS法高于ELISA法,而其他玉米样品的检测结果都是ELISA法高于HPLC-MS法。
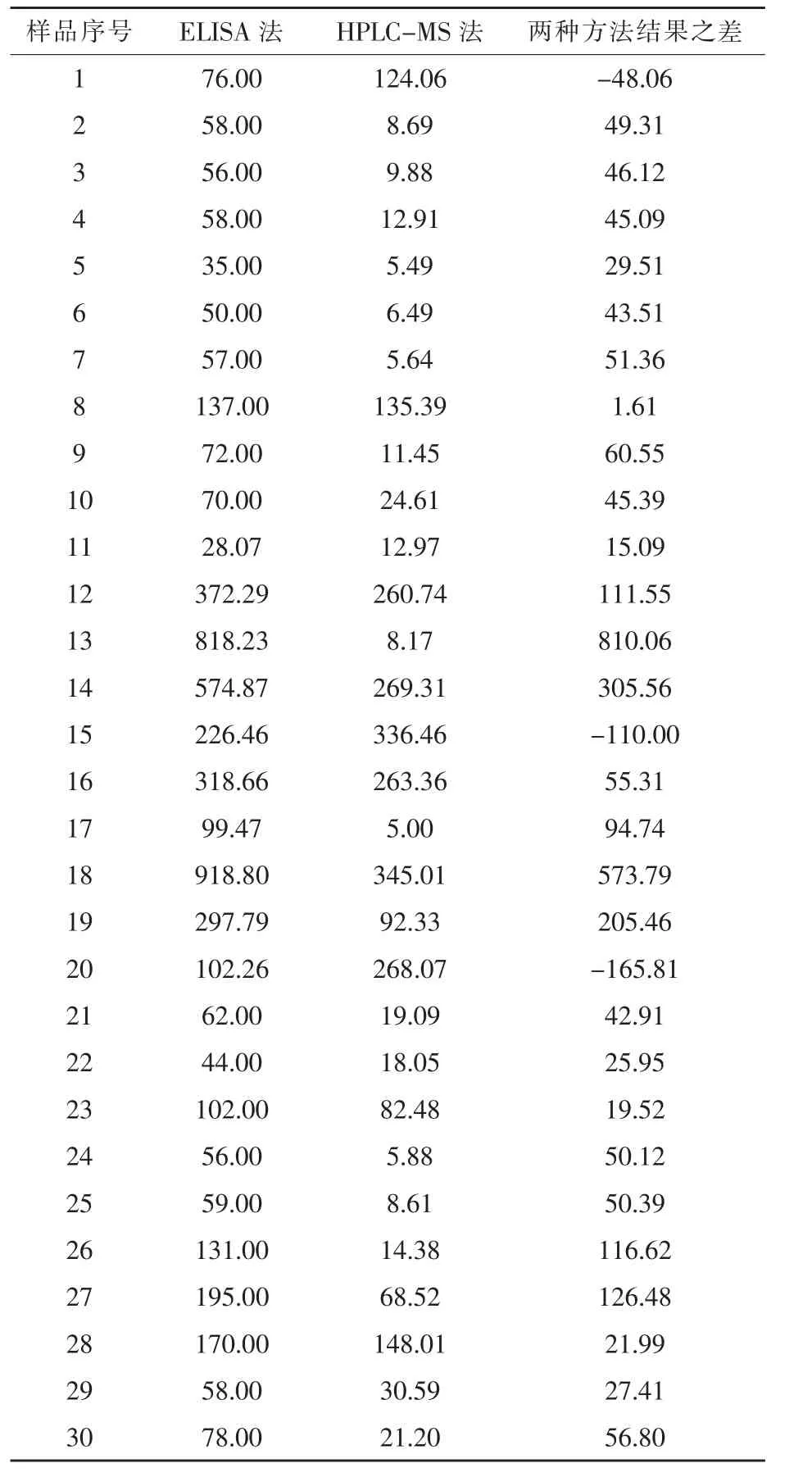
表3 玉米赤霉烯酮的检测结果 μg/kg
2.2 T-2毒素的检出结果 由表4可知,ELISA法对饲用玉米中T-2毒素的检出率为83.33%。HPLC-MS法检出11号玉米样品的T-2毒素含量为0.48μg/kg,低于HPLC-MS法的检出限,相当于未检出,并且也远小于对应的ELISA法检出的结果62μg/kg,而其余的玉米样品则都没被检测到。使用ELISA法检测饲用玉米样品中T-2毒素含量最高是1号样品,含量为124.6μg/kg,对应的HPLC-MS法却未检出。两种检测方法下,13号、14号、21号、23号、24号玉米样品未检出T-2毒素。根据2017版的《饲料卫生标准》中T-2的限量标准 (T-2≤500μg/kg),发现ELISA法和HPLC-MS法对饲用玉米中T-2毒素含量的检测结果显示均未超标。结果表明,ELISA法对饲用玉米中T-2毒素的检出结果均大于HPLC-MS法,且ELISA法的检测结果也相对较低。
3 讨论
本研究中采用ELISA法和HPLC-MS法检测ZEA的检出率均为100%,而蒋玉寒(2015)、杨晓飞(2007)、王若军(2003)等研究不同地区的玉米中ZEA也是100%检出,这说明了我国大部分地区的玉米普遍被ZEA污染。李玲(2017)检测玉米副产物中ZEA的情况与本研究结果一致,侯真真(2018)在干酒槽、蛋白粉、高粱等鸡饲料原料中也有不同程度的检出ZEA,证实ZEA对谷物类作物污染广泛,且在实际生产中难以消除,人们应该加强对ZEA的监测。ELISA法检测玉米样品中T-2毒素时的检出率为83.33%,但检出含量相对较低,无超标样品,而HPLC-MS法的检出率几乎为零。
在本实验中,两种方法检测玉米中ZEA、T-2毒素时得到的结果都存在差异,ELISA法检测出的结果普遍高于HPLC-MS法检测的结果。影响ELISA法测定结果的原因有以下几个方面:(1)样品预处理可直接影响霉菌毒素的分析灵敏度和准确度,选择合适的溶剂才能确保最大程度的提取到霉菌毒素。陈建伟(2012)以玉米为试材发现,甲醇浓度对ELISA测定结果影响最为显著,其次是提取溶液体积和提取时间以及温度。(2)ELISA法不能把玉米样品中的脂肪、重金属离子除去,而重金属离子的存在会破坏酶的活性,使酶底物加入后显色偏浅,易出现假阳性;或是脂肪吸附在包被抗体孔中阻碍了样品液抗原与抗体的结和,也会造成假阳性(乙小娟等,2000)。(3)由于提取液甲醇易挥发,制成样品液时不易控制其pH,样品液的pH过高、过低都会影响检测结果。陈玲(2006)研究发现,当样品提取液pH低于5时,酶标抗原中酶的结构发生不可逆的变化并丢失其大部分活性,导致显色反应时颜色偏浅,使结果出现假阳性。玉米样品液的pH应在6~8为宜,若偏离此范围要用盐酸或氢氧化钠调节pH。(4)霉菌毒素之间有共同污染的现象(周建川等,2018;龚阿琼,2017)。本实验检测的ZEA和T-2毒素可能与其他毒素也有交叉反应的现象。(5)霉菌毒素在不同试剂盒方法中的预处理方法、数据处理方式以及毒素的回收率、检出限及检测范围等的差异都会对测定结果造成影响。HPLC-MS法是较为理想的检测,不存在交叉反应和假阳性的问题,已被广泛应用,是检测霉菌毒素方法中较为权威的 (王瑞国,2015)。但对实验员的操作要求较高,若在前处理过程中操作不当,如毒素洗脱不完全、氮气吹的过多,使样品中霉菌毒素含量减少,导致检测结果偏低;还有HPLC-MS法的检测时间较长,可能会使待测毒素发生氧化,影响测定结果。
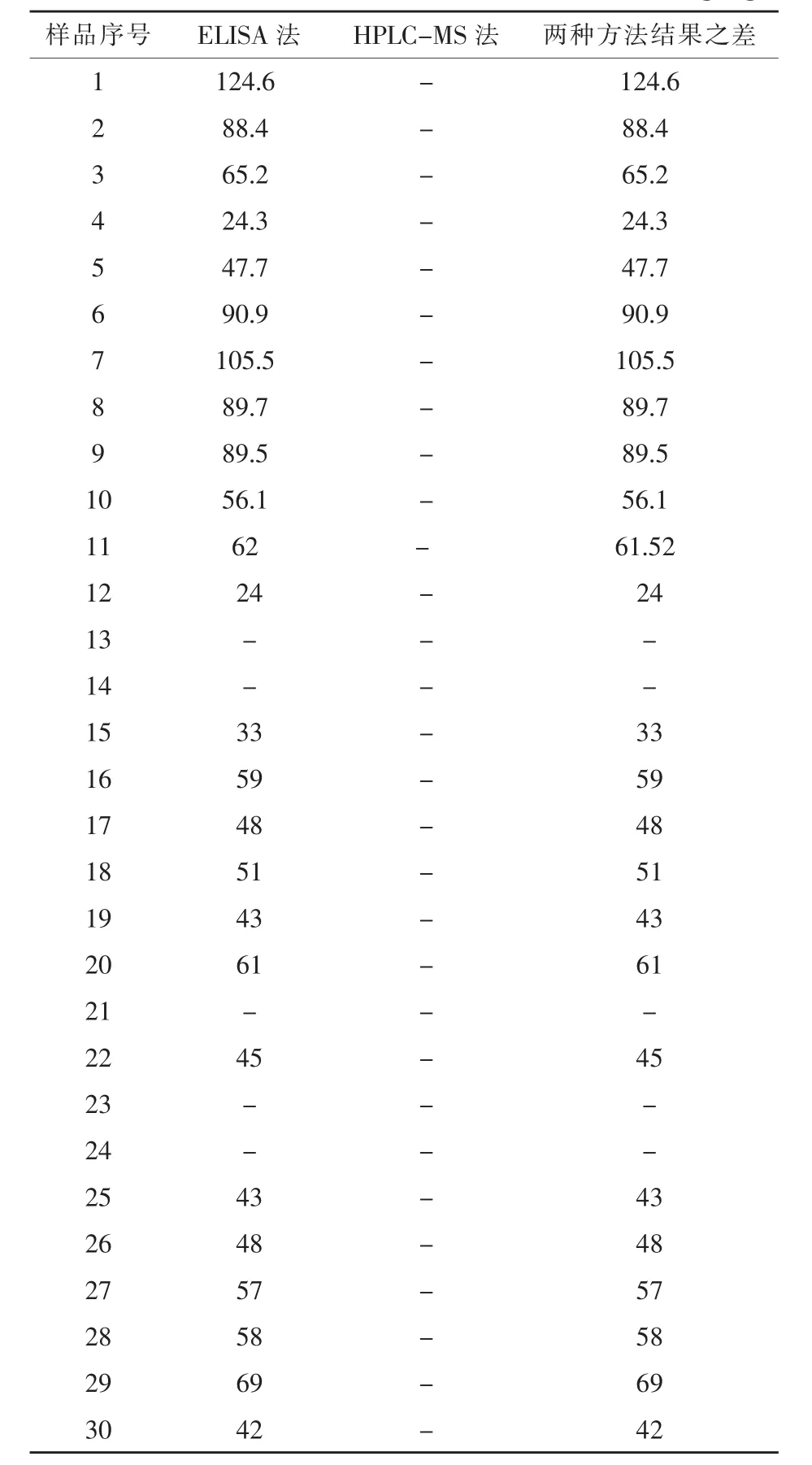
表4 T-2毒素的结果μg/kg
综上所述,玉米中的霉菌毒素用ELISA法检测的结果普遍高于HPLC-MS法,HPLC-MS法则是结合了液相色谱的高分离度、高灵敏性和质谱检测器的通用性、可知分子结构、选择性好等优点,检测玉米中霉菌毒素时测定结果较为稳定和准确。因此,在实际生产应用中,相关人员可根据不同的检测目的选择不同的检测方法,或者是先采用ELISA法进行初筛,样品呈阳性之后,再采用HPLC-MS法进行分析验证,这样得到的结果较为可靠又有实际意义。
4 结论
本实验采用两种检测方法对饲用玉米中ZEA和T-2毒素的检测结果显示,ELISA法检测的结果普遍高于HPLC-MS法。但根据两种检测方法的优缺点,检测饲用玉米中的ZEA和T-2毒素时,适合用ELISA法初筛,检测结果呈阳性之后,再用HPLC-MS法进行精确定量。

