猪流行性腹泻病毒S1-NTD蛋白表达及其免疫原性研究
孙 裴,张 娟,舒金琪,施杏芬,FAHD,舒建洪,钱 泓
(1 安徽农业大学 动物科技学院,安徽 合肥 230036;2 浙江理工大学 生命科学与医药学院,浙江 杭州 310018; 3 浙江省兽药饲料监测所,浙江 杭州 310020)
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的猪流行性腹泻病(porcine epidemic diarrhea,PED)具有高致病性、高死亡率等特点,且在世界范围内广泛分布[1]。1978年,比利时首次确认PED的病原[2],此后该病在匈牙利、德国、日本、中国、韩国、越南等多个欧亚国家相继发生[3]。2013-2014年,美国、加拿大、古巴、墨西哥和日本出现PED疫情[4-5]。PED在我国部分地区时有发生和流行,且多为混合感染爆发,给养猪业带来了巨大的经济损失[6-7]。疫苗接种是预防和控制PED的主要手段,目前市场上的疫苗多为传统的弱毒疫苗或灭活疫苗,而该类疫苗在安全性等方面存在诸多隐患[8-9]。基因工程疫苗可有效解决传统疫苗存在的问题,所以研究开发新型PEDV基因工程疫苗具有重要的意义。
PEDV病毒囊膜上的纤突(S)蛋白[10-12],属于I型糖蛋白,呈辐射状连接在病毒粒子囊膜表面上,是病毒的主要抗原,负责与宿主细胞的受体结合;同时PEDV S蛋白也是诱导病毒产生中和抗体的主要抗原。在病毒侵染靶细胞时,S蛋白与靶细胞膜上的相应位点结合,通过膜融合进入细胞内部,从而调节中和抗体的产生[13-14]。因此S蛋白被认为是基因工程疫苗研究的关键候选抗原。编码PEDV S蛋白的基因序列大小约4 125 nt,编码1 383个氨基酸,蛋白分子质量180~220 ku。PEDV S蛋白可以分为2个区域:S1区(1~789位氨基酸)和S2区(790~1 383位氨基酸),其中S2蛋白较为保守,而S1蛋白变异较大,也是S蛋白主要的功能区[15]。S1蛋白包含N端结构域(N terminal domain,NTD)和C端结构域(C terminal domain,CTD),这2个结构域都可能作为受体结合区(RBD)识别不同的细胞蛋白和糖,而诱导中和抗体产生的表位位于RBD内[16]。
杆状病毒是昆虫的病原体,其所具有的一些典型特征(如在晚期基因高水平表达)使其非常适合作为外来基因表达的载体[17-18]。为推进PEDV基因工程疫苗的探索和创新,本研究利用昆虫杆状病毒表达系统表达PEDV S1-NTD蛋白,并验证了其免疫原性,旨在为利用昆虫杆状病毒表达系统制备PEDV基因工程亚单位疫苗提供依据。
1 材料与方法
1.1 材 料
pFastBac Dual载体、大肠杆菌K-12菌株TG1、大肠杆菌DH5α、大肠杆菌DH10Bac、昆虫细胞sf9,均由浙江省家蚕生物反应器和生物医药重点实验室保存。6周龄BALB/c小鼠,由杭州玄竹生物科技有限公司提供。
PCR高保真酶混合液、Cellfection Ⅱ转染试剂(Invitrogen,美国),DNA Marker (BioLabs,美国),DNA凝胶回收试剂盒、质粒小量提取试剂盒、PCR清洁回收试剂盒(QIAGEN,德国),Quick-Cut限制性内切酶(Takara,大连), SF-900IISFM培养基(Gibco,美国),鼠源Flag单克隆抗体、鼠源抗His6单克隆抗体(Roche,瑞士),刀豆蛋白ConA(Sigma,美国),PEDV商业疫苗(浙江诗华诺倍威有限公司,杭州),HRP-羊抗小鼠单克隆抗体(Abcam,美国),小鼠淋巴细胞分离液(达科为生物技术有限公司),PEDV酶联免疫试剂盒(Andy,美国)。
1.2 PEDV S1-NTD基因PCR的扩增
利用DNAstar软件设计S1-NTD基因扩增引物,交由生工生物工程(上海)股份有限公司合成。引物序列:PEDV S1-NTD For:5′-TCCCCCGGGATGCATCACCATCACCATCACGGCCAGTCCCTA-
GCTTT-3′(下划线碱基为SamⅠ酶切位点);PEDV S1-NTD Rev:5′-GGGGTACCTTAGTGATGGTGATGGTGATGGTGTAGCACTGACAAATC-3′(下划线碱基为KpnⅠ酶切位点)。
以PEDVS基因(由浙江省家蚕生物反应器和生物医药重点实验室保存)为模板进行PCR扩增。PCR反应体系为:PCR高保真酶混合液45 μL,上、下游引物(10 μmol/mL)各2 μL,DNA模板1 μL。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,共25个循环;72 ℃终延伸10 min,4 ℃保存。扩增产物用1%琼脂糖凝胶电泳进行鉴定。
1.3 重组表达质粒和穿梭质粒的构建及鉴定
将扩增出的PEDVS1-NTD基因进行SamⅠ/KpnⅠ双酶切,然后与经同样双酶切的pFastBac Dual载体连接,转入TG1感受态细胞中,构建出pFastBac Dual PEDV S1-NTD重组表达质粒,将连接产物转化大肠杆菌DH5α后的菌液涂抹至含0.1 mg/mL氨苄青霉素的培养板上筛选阳性克隆,摇菌提取质粒后进行SamⅠ/KpnⅠ双酶切、PCR扩增和测序鉴定。
将构建成功的pFastBac Dual PEDV S1-NTD重组表达质粒转化DH10Bac菌,与其中的Bacmid质粒进行同源重组,得到重组穿梭质粒Ac-PEDV S1-NTD,并进行蓝白斑试验筛选。设计引物M13 F:5′-CCCAGTCACGACGTTGTAAAACG-3′,M13 R:5′-AGCGGATAACAATTTCACACAGG-3′,交由生工生物工程(上海)股份有限公司合成。以蓝白斑试验筛选的阳性重组质粒为模板,用M13F/M13R、M13F/PEDV S1-NTD Rev、M13R/PEDV S1-NTD For、PEDV S1-NTD For/PEDV S1-NTD Rev对重组穿梭质粒Ac-PEDV S1-NTD进行PCR鉴定。
1.4 重组杆状病毒rvAcPEDV S1-NTD的构建
将鉴定正确的重组穿梭质粒Ac-PEDV S1-NTD感染sf9细胞,观察细胞的发病状态。收集感染的sf9,用细胞与上清中的P1代重组杆状病毒rvAcPEDV S1-NTD再次感染sf9细胞,获得P2代重组杆状病毒,用空斑试验测定其滴度。用其感染sf9细胞,48 h后收集细胞,用细胞裂解液裂解后取上清液,用10%的SDS-PAGE电泳分离细胞总蛋白,以鼠源抗His6单克隆抗体为一抗进行Western blot试验,验证重组蛋白S1-NTD在sf9细胞中的表达情况。
用密度为1×106mL-1的处于对数生长期的健康sf9细胞铺六孔板,27 ℃静置1 h,将P2代重组杆状病毒rvAcPEDV S1-NTD以感染复数(multiplicity of infection,MOI)为0.1感染sf9细胞,于感染后第1,2,3,4,5和6天收集细胞上清液,用空斑试验测定病毒滴度,进而绘制重组杆状病毒的增殖曲线。
1.5 目的蛋白PEDV S1-NTD在sf9细胞中的表达量
将MOI为0.1,1和3的P2重组杆状病毒分别感染sf9细胞,于感染后第1,2,3,4和5天分别收集细胞(MOI=3时,第5天的细胞大量死亡,故未收集细胞样品),PBS洗涤后用细胞裂解液裂解后取上清液,以鼠源抗His6单克隆抗体作为一抗,用Western blot测定重组蛋白的表达量,同时以β-actin为内参蛋白。
1.6 重组蛋白PEDV S1-NTD的免疫原性分析
用P2代重组杆状病毒继续感染sf9细胞,制备P3代重组杆状病毒。用MOI为0.1的P3代重组杆状病毒感染sf9细胞,第4天收取上清液即病毒液。利用30 ku的超滤管浓缩病毒以达到要求的病毒滴度。取24只6周龄的雌性BALB/c小鼠,随机平均分为重组杆状病毒rvAcPEDV S1-NTD组及PBS、空载体Bacmid和PEDV疫苗对照组,分别皮下注射免疫rvAcPEDV S1-NTD、PBS、空载体Bacmid、PEDV商业疫苗,其中rvAcPEDV S1-NTD免疫量为1×108pfu/只,PBS和PEDV商业疫苗的免疫量为200 μL/只,空载体Bacmid的免疫量为1×108pfu/只,每隔2周免疫1次,共免疫3次。
1.6.1 抗体效价 在第1次免疫后的第0(第1次免疫当天),14,28和35天,每组随机取3只小鼠,断尾采血,分离血清,100倍稀释后,用ELISA法检测各组小鼠血清的效价,具体方法参照试剂盒说明书。
1.6.2 脾淋巴细胞增殖 在小鼠第1次免疫后的第35天,每组取3只小鼠处死,在体积分数75%的酒精中浸泡3 min后,在超净工作台中解剖,分离脾脏,按照小鼠淋巴细胞分离液说明书分离脾淋巴细胞。以密度1×106mL-1的脾淋巴细胞铺96孔板(100 μL/孔),设置ConA阳性组、PEDV刺激组和PBS阴性对照组,每组设置3个重复。ConA阳性组脾淋巴细胞加入20 μg/mL 的ConA,100 μL/孔;PBS阴性组加入PBS 100 μL/孔;PEDV刺激组加MOI为1的PEDV病毒液,100 μL/孔。各组细胞培养42 h后,加入20 μL 5 mg/mL MTT,振荡1min,放置6 h后弃掉上清液,每孔加入100 μL DMSO,振荡2 min,于492 nm下测定吸光值(OD492)。计算刺激指数(SI),判断淋巴细胞的增值程度。刺激指数(SI)=刺激组OD492平均值/PBS阴性对照组OD492平均值。
2 结果与分析
2.1 PEDV S1-NTD基因的PCR扩增结果
PEDVS1-NTD基因的PCR扩增产物电泳后,获得了约738 bp的片段 (图1),与预期结果(738 bp)相符。

M.DNA Marker DL2000;1,2.PCR扩增产物M.DNA Marker DL2000;1,2.PCR amplification product图1 PEDV S1-NTD基因PCR扩增产物的电泳结果Fig.1 PCR products of PEDV S1-NTD gene identified byagarose gel electrophoretogram
2.2 PEDV S1-NTD基因表达质粒和重组穿梭质粒的鉴定
对构建完成的重组表达质粒pFastBac Dual PEDV S1-NTD进行PCR与双酶切鉴定,结果均在738 bp附近出现符合预期长度的特异性条带(图2)。测序分析表明,构建完成的重组质粒中的目的基因S1-NTD序列与模板序列一致,表明重组质粒已构建成功。

M.DNA Marker DL10000;1.PCR扩增产物;2,3.pFastBac Dual PEDV S1-NTD的SamⅠ/KpnⅠ双酶切产物M.DNA Marker DL10000;1.PCR amplification product;2,3.Products of pFastBac Dual PEDV S1-NTD digested by enzyme SamⅠand KpnⅠ图2 重组表达质粒pFastBac Dual PEDV S1-NTD 的PCR鉴定(A)和双酶切鉴定(B)Fig.2 PCR detection(A)and dual enzyme digestion(B)of recombinant plasmid pFastBac Dual PEDV S1-NTD
重组穿梭质粒Ac-PEDV S1-NTD经 M13F/M13R、M13F/PEDV S1-NTD Rev、M13R/PEDV S1-NTD For、PEDV S1-NTD For/PEDV S1-NTD Rev引物 PCR鉴定,分别获得了3 319,2 739,1 196,738 bp的片段,片段长度均与预期目的片段长度一致(图3),表明重组穿梭质粒构建成功。

M.DNA Marker;1~4.分别以M13F/M13R、M13F/PEDV S1-NTD Rev、M13R/PEDV S1-NTD For、PEDV S1-NTD For/PEDV S1-NTD Rev为引物的PCR扩增产物M.DNA Marker;1-4.Products amplified with M13F/M13R,M13F/PEDV S1-NTD Rev,M13R/PEDV S1-NTD For,PEDV S1-NTD For/PEDV S1-NTD Rev as primers
2.3 重组杆状病毒rvAcPEDV S1-NTD的制备
将鉴定正确的重组穿梭质粒Ac-PEDV S1-NTD感染sf9细胞,5 d后显微镜下观察到细胞体积增加,细胞核变大,停止生长,部分细胞贴壁不牢固,悬浮在培养基中,并有一部分细胞发生裂解死亡,说明细胞已经出现病变。利用空斑试验测定P2代重组杆状病毒rvAcPEDV S1-NTD的滴度为8.5×106pfu/mL。
Western blot检测结果(图4)显示,在25~32ku处出现条带,与预测的重组蛋白分子质量大小(28 ku)相符,表明重组蛋白已经在sf9细胞中成功表达。
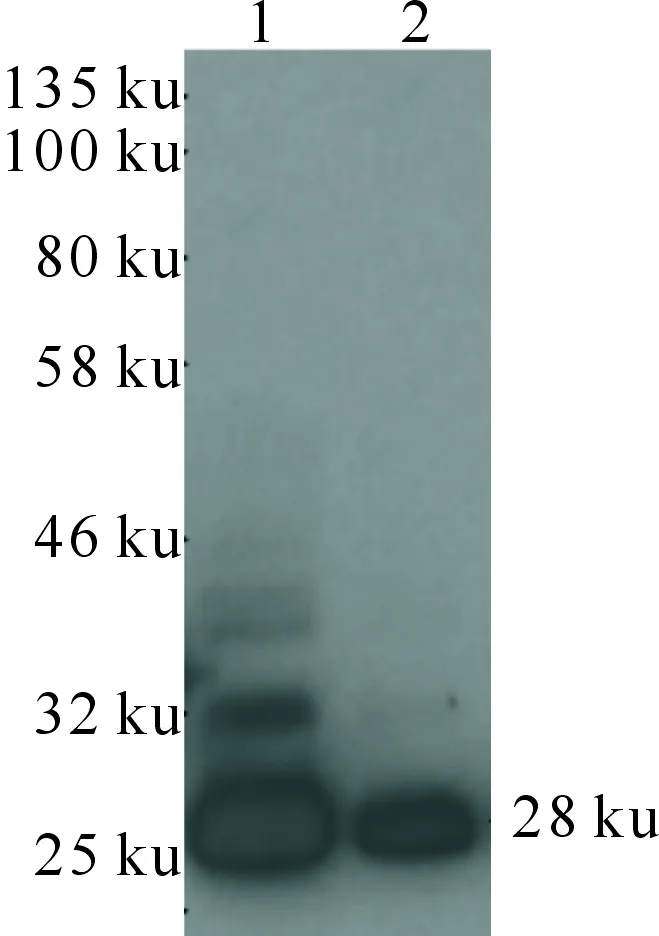
1.蛋白Marker;2.目的蛋白1.Protein Marker;2.Target protein图4 PEDV S1-NTD蛋白在sf9细胞中表达的Western blot鉴定Fig.4 PEDV S1-NTD protein expression in sf9 celldetected by using Western blot
重组杆状病毒rvAcPEDV S1-NTD的增殖曲线如图5所示。由图5可知,在感染后第3天时病毒滴度达到最高,为8.1×106pfu/mL。

图5 重组杆状病毒rvAcPEDV S1-NTD的增殖曲线Fig.5 Growth of recombinant baculovirus of rvAcPEDV S1-NTD
2.4 重组PEDV S1-NTD蛋白的表达量
由图6可知,P2代重组杆状病毒感染sf9细胞时,MOI为0.1的第4天和MOI为1的第3天,重组PEDV S1-NTD蛋白的表达量达到最高。

1~5.分别为转染后第1,2,3,4,5天1-5.1,2,3,4,5 days after transfection,respectively图6 PEDV S1-NTD蛋白表达的Western blot检测Fig.6 Detection of target protein PEDV S1-NTD expression by Western blot
2.5 重组杆状病毒rvAcPEDV S1-NTD的免疫原性
由图7可知,PBS对照组、空载体Bacmid对照组小鼠血清中未检测到PEDV特异性抗体的产生;重组杆状病毒rvAcPEDV S1-NTD组、PEDV商业疫苗组小鼠血清中PEDV特异性抗体水平随着免疫次数的增加而升高,均在免疫后35 d达到最高值,为1∶5 000。结果表明,与PEDV商业疫苗组一样,重组杆状病毒rvAcPEDV S1-NTD组也可诱导机体产生特异性抗体。
由图8可知, PBS对照组和空载体Bacmid对照组小鼠脾淋巴细胞对于PEDV的刺激未发生明显增殖(P>0.05),刺激指数明显小于ConA刺激组;重组杆状病毒PEDV组和PEDV商业疫苗组小鼠脾淋巴细胞对PEDV的刺激均发生了明显的增殖,刺激指数分别显著和极显著高于PBS对照组。结果表明,与PEDV商业疫苗组一样,重组杆状病毒PEDV组也可诱导机体产生细胞免疫效应。

图7 重组杆状病毒rvAcPEDV S1-NTD免疫小鼠血清
PEDV特异性抗体的效价检测
Fig.7 Tier detection of serum PEDV specific antibody
against recombinant baculovirus rvAcPEDV
S1-NTD immunized mice
“*”和“**”表示与PBS对照组差异显著和极显著
“*”and “**” means,compared with PBS control group
图8 重组杆状病毒rvAcPEDV S1-NTD免疫
小鼠脾淋巴细胞增殖情况
Fig.8 Proliferation of spleen lymphatic cells in mice
immunized with recombinant baculovirus
rvAcPEDV S1-NTD
3 讨 论
目前,对于PEDV S1蛋白的重组表达所采用的表达系统主要有乳酸乳球菌表达系统[19]、大肠杆菌表达系统[20]、干酪乳杆菌表达系统[21]、腺病毒表达系统[22]和杆状病毒表达系统[23]等。与原核表达系统及其他真核表达系统相比,昆虫杆状病毒表达系统由于具有独特的生物学特性而日益受到人们的青睐。杨德强等[23]通过昆虫杆状病毒Bac-to-Bac System表达系统对PEDV S1蛋白进行了表达,但其未对表达产物的免疫原性进行检验。史翠萍等[24]利用杆状病毒表面展示技术表达了PEDV S1蛋白,经动物免疫试验证实,表面展示有PEDV S1蛋白的重组杆状病毒能够激发有效的体液免疫及细胞免疫反应,具有较好的免疫原性。以上研究结果为本研究的开展提供了理论支撑。为了进一步探讨经杆状病毒表达系统表达的PEDV S1蛋白的免疫原性,本研究利用昆虫杆状病毒表达系统成功制备了重组杆状病毒rvAcPEDV S1-NTD,用rvAc-PEDV S1-NTD感染sf9细胞后,通过鼠源抗His6单克隆抗体进行Western blot分析,证实了目的蛋白可成功表达。在此基础上,通过不同MOI的重组杆状病毒感染sf9细胞后,空斑试验检测证实在MOI为0.1时感染sf9细胞第3天病毒滴度达到最高值;Western blot检测证实MOI为1时感染第3天,蛋白表达量达到最高。重组病毒rvAcPEDV S1-NTD免疫小鼠后,ELISA法检测相应的抗体证实,在免疫后35 d效价达到最高值,为1∶5 000;淋巴细胞增殖试验结果证实,在PEDV病毒刺激下重组杆状病毒rvAcPEDV S1-NTD免疫组的淋巴细胞发生了明显的增殖。
综上所述,本研究利用昆虫杆状病毒表达系统成功构建了重组杆状病毒rvAcPEDV S1-NTD,并表达了具有免疫原性的PEDV S1蛋白,为后续研制PEDV亚单位疫苗奠定了基础。

