滴定分析中产生误差常见原因的几点探讨
徐 苑
(南京化工技师学院,江苏 南京 210048)
1 滴定曲线差别对测试结果精准度的影响
除开电位的管控偏差与滴定剂的体积偏差,不同浓度或不同浓度比的待检测溶液滴定曲线是有差别的,这也是控制电位滴定法测试结果精准度的关键因素。通常情况下,滴定曲线的差别越大对控制电位滴定法的测试就越有利。滴定曲线的差别与运算模型中的比率数据、滴定反应的本性及滴定参数的方位等因素相关。
滴定曲线差别与运算模式的关联:单组分滴定曲线的差别与运算模式中比率系数K的大小直接相关[1]。
滴定曲线差别与反应实质表现在:滴定曲线差别的数据是由滴定反应的本质所决定的。对单组分来讲,滴定物体的平稳度越高。K系数越大,相异浓度待测物滴定曲线的差别也变大;对多组分来讲滴定物的平稳度越高,滴定物平稳度的区别就越大。
滴定曲线差别与滴定方位的关联:越逼近化学计量点,滴定曲线的差别就越大。挑选恰当的电位,把滴定参数的方位管控在滴定曲线差别很大的位置,对提升测试成果的精准度是有所帮助的。
2 滴定分析中误差的常规原因
2.1 实验阶段
2.1.1 药剂
HCl、HCOOH、HAc、H3PO4、NaAc、NH3、甲基橙、甲基红与酚酞等药剂都是分析纯。
2.1.2 酸碱滴定曲线的测试
将和滴定受体酸的浓度相等的NaOH标准试液滴入到酸试液内,并且使用CT-6023型酸度设备测试试液的pH值。绘出pH值与NaOH试液体积的V的关联曲线,即滴定曲线。
2.1.3 酸碱试剂的吸纳光谱测试
向25mL有着既定pH值的缓冲试液中掺加2%的指示剂试液3D,配备有着既定pH值的酸碱试剂溶液,使用722S型分光光度设备,测试出其在400mL~750mL范围内的吸光数据,使用岛津2450型分光光度设备测试酚酞紫外线的吸光数据。绘制吸光度A和吸纳波长λ关联图谱,依照吸纳光谱明确吸纳波长λmax的数据,画出最大吸纳波长λmax和pH数据的关联图谱[2]。
2.2 结果与讨论
主要探讨终点偏差与pH数据突跃范畴及试剂变色点的关联。
终点偏差是因为滴定终点与化学计量点不相同导致的。在酸的滴定系统内,强酸的化学计量点对外界影响最低,其基本稳固在PHsp为7不改动;一元或多元弱酸则是不同的,其化学计量点不但被其强度影响,还被其浓度所作用。为了对不同种类酸的尺度进行研究,解析化学学说中给出了pH数据突跃范畴的定义,将化学计量点前后所有的±0.1%的相对偏差是所具有的pH数据范畴界定为pH值突跃范畴。在pH数据突跃范畴内终止滴定,所形成的的终点误差是±0.1%,与滴定模式中所允许的误差范畴是相吻合。因为没有办法直观地感受酸碱反映是不是达到化学计量点。所以,常参考酸碱试剂的色调改变情况来确定是不是终止滴定,而将试剂变色终止滴定的一个点叫做滴定终点,而这时的PHep数据与PHsp越趋近,那么终点偏差就越小。所以,左右pH突跃范畴大小的因素也成为左右终点偏差数据的因素,依照pH突跃范畴选择适当的试剂,是降低终点偏差的重要方法[3]。
2.3 滴定酸的种类与pH数据突跃范畴
1)强酸滴定系统内左右pH数据突跃范畴的元素是强酸的代表,HCl的滴定被用在讨论强酸滴定系统内左右pH数据突跃范畴的元素。使用20mL的移液管依顺序抽取1.000mol·L-1、0.100 0mol·L-1、0.010 00mol·L-1的 HCl试液倒入三只器皿内,用相应的浓度的NaOH标准试液完成测试,测试获得的滴定曲线,如图1所示。
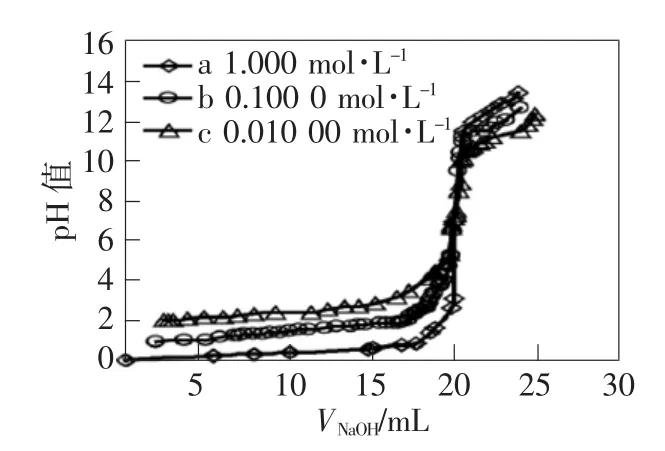
图1 相异浓度HCl的滴定谱图
如图1所示,三类浓度滴定的化学计量点PHsp相似,均在pH数据突破范畴内。而且,伴随溶液的增加,pH数据的突跃范畴也变得越大。如果NaOH与HCl的浓度增加了10个倍数,pH数据突跃范畴的极大值与极小值会依次扩大1个pH值,pH值突跃范畴会增大2个pH值单位。所以,如果试剂明确后,滴定终点也就能够明确,此刻浓度是左右滴定终点的重要元素,浓度变大的偏差就能够缩小,反之亦如此。
2)一元弱酸滴定系统内影响pH值突跃范畴的元素
被当成一元弱酸代表的HCOOH、HAc的滴定模式中,被用来获得pH数据突跃范畴。使用20mL的移液管依次抽取1.0mol·L-1、0.1mol·L-1、0.01mol·L-1的 HCOOH试液置于3个器皿内,使用相对浓度的NaOH标准溶液完成滴定,测试获得滴定曲线。
实验表明,从HCOOH的滴定图谱中,其滴定的pH数据突跃范畴相较于浓度HCl的要小很多。而且,是在弱碱性范畴内。和强酸的滴定有所区别,浓度的变更仅会左右pH突跃的最大值。并且,让化学计量点PHsp数据伴随浓度的稀释而下降,依顺序是8.72(a)、8.22(b)、7.72(c)。和强酸滴定类似的状况是,PHsp依然处于pH数据突跃范畴的中央,浓度每增加10个倍数,pH数据的突跃范畴的最大值就增大1个pH值单位。
为了深度解读该实验的情况,使用25mL的移液管依顺序抽取1.000mol·L-1、0.100 0mol·L-1、0.010 00mol·L-1的 HAc试液,使用相对浓度的NaOH标准试液实施滴定。测试其滴定图谱。解析HAc的滴定曲线能够看到,浓度的影响和HCOOH滴定阶段的状况类似。并且,pH数据突跃的最大pH数据和HCOOH同等浓度是一致的。有差别的地方仅为对应浓度滴定的PHsp值要比HCOOH的pH值高0.50个单位。而且,pH数据突跃的最小pH数据要比HCOOH高1个pH值单位。所以,它的pH数据突跃范畴会变得更窄。上述情况表明,在一元弱酸的滴定工作中,不但浓度是影响pH数据突跃范畴的元素,滴定受体强酸的强度也是重要的影响元素[4]。
为了阐述滴定酸的强度对pH数据突跃范畴的影响,把浓度均为0.1mol·L-1的 HCl、HCOOH、HAc的滴定图谱绘制成图,如图2所示,有利于对比。
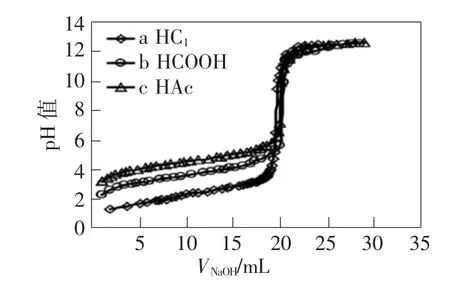
图2 0.1000mol-1相异强度酸的滴定图谱
如图2所示,浓度相等阶段,pH值突跃的最大值不改动,而pH值突跃的最小值因为滴定酸的改变而改变。酸性极强的HCl、pH数据突跃最小值也是最小的,为4.30,酸性极弱时的HAc,pH突跃数据为7.74,是最高的。HCOOH的pH数据突跃最小值为6.74,处于HCl与HAc的数值范畴内,比HAc低1个pH值单位。已获得HCOOH的酸性值(pKa=3.74)相较于 HAc的酸性值(pKa=4.74)大10倍。因此,都能够滴定对象酸的pKa值每缩减1,那么pH值突跃下限,并往下扩充1个pH值单位。
3 结语
强碱滴定多元弱酸的系统内,会出现pH值的突跃情况,必须使用两种或若干种相异变色点的试剂来明确。依照实验成果,多元弱酸的pH值突跃范畴很小,除最后一类质子形成的突跃范畴的上限与浓度有关联外,剩余的pH值突跃范畴与浓度没有关联。

