炎性细胞因子对滑膜细胞诱导型一氧化氮合酶和一氧化氮表达的作用及其机制研究
陈泽琪 傅佳民 杨娣 金彬 王芯叶 吴冬蕾 罗心静 莫选荣
类风湿关节炎(rheumatoid arthritis,RA)是一种主要累及周围关节的慢性炎症性自身免疫性疾病。滑膜成纤维细胞及其生成的炎症介质在RA关节滑膜炎症和关节破坏中起重要作用。一氧化氮(NO)是一种生物自由基,在体内经一氧化氮合酶(NOS)催化并由L-精氨酸生成。NOS有3种,其中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)是 NO生产过程中的关键酶。NO具有广泛的生理病理作用,生理量的NO介导和调节多种生理过程,其参与血管调节、神经递质的传递、抗病毒反应和免疫反应,但过量的NO可造成组织损伤,并会参与多种急性和慢性炎症性疾病的病理过程[1]。研究表明RA患者关节液和血清中的NO水平明显高于正常人[2],应用iNOS抑制剂可显著缓解佐剂关节炎大鼠的关节肿胀、滑膜炎症和软骨损伤[3-4]。因此认为NO和iNOS作为炎症介质在RA病变中起重要作用,调控NO和iNOS的表达是防治RA的重要靶点[6]。
核因子 κB(nuclear factor,NF-κB)通路作为在 RA中发挥重要作用的信号通路之一,参与多种细胞因子的生成调节[7-8]。有研究证实,IL-1、IFN-γ、TNF-α 等炎性细胞因子联合刺激巨噬细胞产生大量NO和iNOS,而NF-κB参与NO和iNOS生成的调节[9]。关节滑膜细胞及其分泌的炎性细胞因子IL-1、IFN-γ、TNF-α在RA的滑膜炎症持续进展、关节破坏中起重要作用[2]。但炎性细胞因子是否能刺激滑膜细胞产生NO和iNOS、NF-κB在滑膜细胞NO和iNOS生成中起何作用,目前尚不清楚。本实验拟以人类滑膜成纤维细胞株MH7A作为载体,观察这些炎症因子单独或联合刺激下NO及iNOS生成的变化,并探讨NF-κB在NO和iNOS生成中的作用。
1 材料和方法
1.1 主要材料和试剂 人类滑膜成纤维细胞株MH7A购自广州吉妮欧生物科技有限公司,IL-1、IFN-γ、TNF-α均购自美国Sigma公司,NF-κB抑制剂BAY(型号:11-7082)购自美国MedChemExpress公司,SYBR Green qPCR Master Mix试剂盒、逆转录试剂盒和Trizol提取RNA试剂盒均购自美国Applied Biosystems公司,NF-κB p-p65兔单克隆抗体和iNOS兔多克隆抗体均购自美国Cell Signaling Technology公司,GAPDH兔单克隆抗体和辣根酶标记的山羊抗兔IgG均购自美国Santa Cruz公司,NO测定试剂盒购自南京建成生物工程研究所,聚偏二氟乙烯膜(PVDF)购自美国Millipore公司,荧光二抗和4′,6-二脒基-2-苯基吲哚(DAPI)购自南通碧云天生物科技公司,定量PCR试剂盒购自Thermo公司。
1.2 方法
1.2.1 滑膜成纤维细胞培养和传代 滑膜成纤维细胞株MH7A复苏后,加入含10%FBS的DMEM培养基培养,每3~4d换液1次。当细胞生长至融合时,用0.25%胰蛋白酶消化并按1∶3比例分瓶传代,传代后细胞加入10%FBS的DMEM培养基继续培养。
1.2.2 实验分组 在一阶段实验中,将细胞根据不同刺激时间分为 0、2、4、8、12、24h 6 组,并将 6 组的滑膜细胞分别用 IL-1(10ng/ml)、TNF-α(20ng/ml)和 IFN-γ(100U/ml)单独刺激及联合刺激。在二阶段实验中,先将滑膜细胞根据有无联合刺激以及加入BAY的浓度不同分为正常组(C组)、联合刺激组、联合刺激+BAY(2.5)组、联合刺激+BAY(5)组,后两组是用 2.5或 5ng/ml BAY 进行预处理后,加入 IL-1(10ng/ml)、TNF-α(20ng/ml)和 IFN-γ(100U/ml)联合刺激,通过观察细胞质蛋白p-p65表达情况间接观察NF-κB活化情况,从而筛选出BAY最佳抑制剂浓度。
1.2.3 细胞内p-p65和iNOS蛋白表达检测 采用Western blot法。将分组处理后的滑膜细胞用PBS清洗后,加入含蛋白酶抑制剂的放射免疫沉淀分析裂解液裂解30min,离心收集上清液,采用牛血清白蛋白定量法。将20μg蛋白样品与6×十二烷基硫酸钠(SDS)加样缓冲液混合,煮沸5min。样品经10%SDS-聚丙烯酰胺凝胶电泳分离后,经电转移法转移到聚偏氟乙烯膜上,室温下用含2%脱脂奶粉的封闭液封闭4h,分别加入p-p65兔单克隆抗体、iNOS兔多克隆抗体孵育2~4h,漂洗后,加入辣根过氧化物酶标记的二抗,反应1h。电化学发光底物检测膜上的抗原-抗体复合物,置凝胶成像系统成像,分析灰度值。甘油醛-3-磷酸脱氢酶(GAPDH)为内参照物。
1.2.4 NF-κB核移位的检测 采用细胞免疫荧光法。将培养瓶中各组滑膜细胞用胰酶消化后均匀接种于铺有爬片的6孔板,待细胞长满至细胞培养瓶的80%面积时给予相应处理一定时间,倒去培养液,加入4%多聚甲醛固定1h,将配好的NF-κB p-p65兔单克隆抗体加入6孔板中,4℃过夜,用PBS清洗后加入的异硫氰酸荧光素标记的荧光二抗,室温孵育2h。用PBS洗后加入DAPI染色5min(全程避光)。吸干净后,在载玻片上滴加淬灭液,将爬片正面向下置于载玻片上,荧光显微镜观察。
1.2.5 细胞内iNOS mRNA表达检测 采用实时荧光定量PCR法。采用Trizol法提取各组细胞的总RNA。将提取后的RNA经逆转录生成 cDNA,反应体系如下:RNA(1μg)、MMuLV2 逆转录酶(40U/μl)、多聚胸腺嘧啶(100nM)、脱氧核糖核苷三磷酸混合物(1mM)、二硫苏糖醇(0.1M)、RNA 酶抑制物(40U/μl)、加焦碳酸二乙酯去离子水至总体积为20μl。反应条件如下:42℃ 60min,70℃10min。将生成的cDNA使用定量PCR试剂盒进行扩增,反应体系如下:0.4μM 模板、正、反义链各 1μl、12.5μl SYBR Green 酶、加去离子水至总体积 20μl。PCR反应程序如下:95℃ 5min预变性,然后按95℃ 15s,60℃1min共40个循环,最后72℃ 7min延伸。数据处理采用阈值循环(Ct)分析法,计算模板与对照样本之间的 2-ΔΔCt值差。
1.2.6 细胞培养上清液中NO浓度变化的检测 采用硝基还原酶法。各组滑膜细胞经一定处理后,收集上清液。按NO测定试剂盒说明书所述加入样本和试剂一,37℃水浴60min。加入试剂二,室温孵育40min,3 500~4 000r/min,离心10min。取上清液0.5ml,加入显色剂,静置10min,550nm波长,1cm光径,比色,得出结果。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料用表示,组间比较采用单因素方差分析,方差齐性者两两比较采用LSD-t检验,方差不齐者采用Dunnet’t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3种炎症因子单独或联合刺激滑膜细胞p-p65、iNOS蛋白水平比较 IL-1刺激 4、8h及联合刺激4h后细胞p-p65蛋白表达均增加,而IL-1刺激2、4h及联合刺激4h后滑膜细胞iNOS蛋白表达均增加,差异均有统计学意义(均P<0.05),见表1、2和图1。
2.2 3种炎症因子单独或联合刺激对NF-κB核移位的影响 3种炎症因子单独或联合刺激4和8h后,滑膜细胞NF-κB核转移明显增加,见图2。
2.3 3种炎症因子单独或联合刺激对细胞iNOS mRNA水平的影响 IL-1刺激8、12h和TNF-α刺激2、8、12h以及INF-γ刺激2h及联合刺激2、8、12和24h后,滑膜细胞iNOS mRNA表达均有所升高,差异均有统计学意义(均P<0.05),见表 3。
2.4 3种炎症因子单独或联合刺激对NO水平的影响3种炎症因子单独或联合刺激时NO水平均升高(均P<0.05),但高峰期时间不一样:IL-1最高峰为12h,TNF-α最高峰为8h,IFN-γ最高峰为4h,联合刺激最高峰在2~4h,见表4。
2.5 NF-κB抑制剂BAY对滑膜细胞p-p65蛋白表达以及核转移的影响 与C组表达水平0.71±0.04比较,联合刺激组滑膜细胞p-p65蛋白的表达水平升高,为1.71±0.20(P<0.05);与联合刺激组比较,联合刺激+BAY(2.5)组为 0.91±0.04,联合刺激+BAY(5)组为 0.68±0.02,两组表达水平均下降(均P<0.05),见图3。细胞免疫荧光结果显示,与C组比较,联合刺激组滑膜细胞NF-κB核转移明显增加;与联合刺激组比较,联合刺激+BAY(2.5)组和联合刺激+BAY(5)组滑膜细胞 NF-κB核转移均明显减少,见图4。
2.6 3组滑膜细胞iNOS蛋白、mRNA和NO表达水平比较 与C组比较,联合刺激组细胞iNOS蛋白、mRNA和NO表达水平均升高(均P<0.05);与联合刺激组比较,联合刺激+BAY(5)组iNOS蛋白、mRNA和NO表达水平均下降(均P<0.05)。见表5和图5。
3 讨论
NO是一种生物活性自由基,与许多生理功能有关,包括血管张力控制、神经传导、线粒体功能、细胞凋亡和炎症。一些研究表明,NO在许多自身免疫性炎症反应的发病机制中均有参与。RA等疾病中会产生过量的NO导致血管翳、炎症和关节破坏。iNOS是重要的促炎介质,能催化L-精氨酸生成NO,是NO生产过程中的关键酶。研究表明,iNOS在RA患者的滑膜和软骨中高表达,并且滑膜成纤维细胞是RA关节滑膜中iNOS的主要来源,同时,NO水平与RA滑膜中iNOS阳性滑膜细胞的数量强相关,这表明iNOS参与RA滑膜关节中的NO过量产生[2]。研究表明,RA关节滑膜组织中的一些炎性细胞因子如IL-1、TNF-α和IFN-γ可能诱导了NO生成[10]。
本研究显示,IL-1、IFN-γ、TNF-α 3 种炎症因子单独刺激滑膜细胞后NO与iNOS mRNA的表达均有升高趋势,而且其所达到最高峰的时间点各不相同。而当本研究团队将3种炎症因子联合进行刺激后,NO和iNOS表达均升高,特点是随着刺激时间的不同,呈现了先增高后降低趋于正常的趋势。
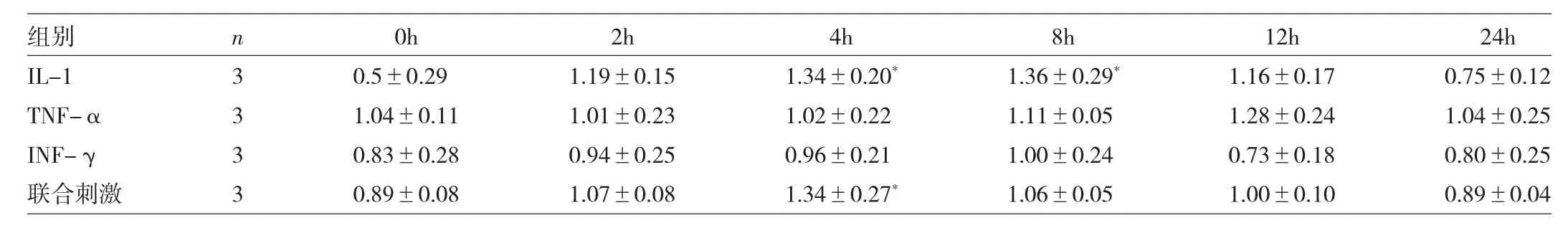
表1 3种炎症因子单独或联合刺激滑膜细胞p-p65蛋白水平比较
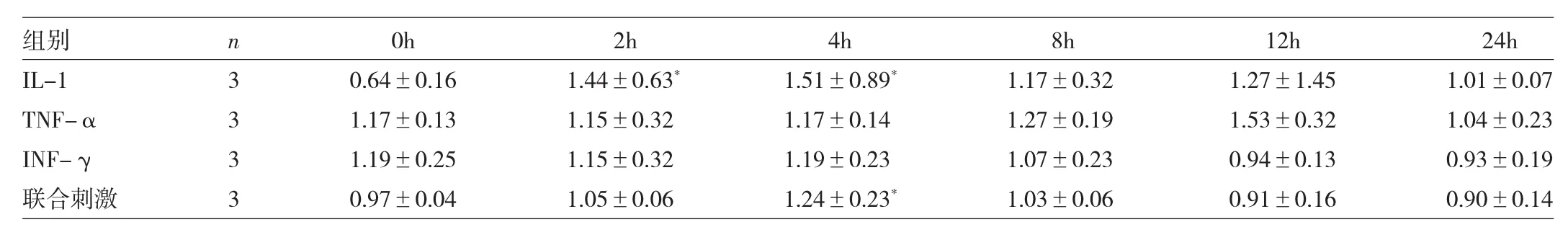
表2 3种炎症因子单独或联合刺激滑膜细胞iNOS蛋白水平比较

图1 3种炎症因子单独或联合刺激滑膜细胞p-p65、iNOS蛋白表达的电泳图(a:p-p65;b:iNOS)

图2 3种炎症因子单独或联合刺激细胞NF-κB核移位荧光显微镜所见(DAPI染色,×200)

表3 3种炎症因子单独或联合刺激细胞iNOS mRNA水平变化
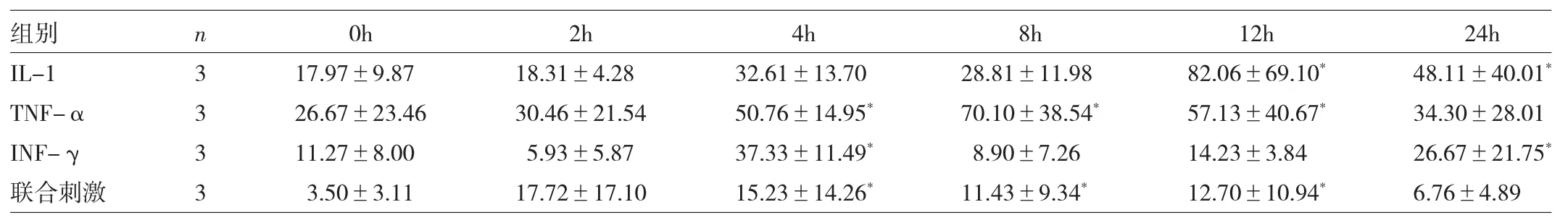
表4 3种炎症因子单独或联合刺激细胞培养上清液NO水平比较

图3 4组滑膜细胞中p-p65蛋白表达的电泳图

图4 4组滑膜细胞中p-p65核移位荧光显微镜所见(DAPI染色,×200)
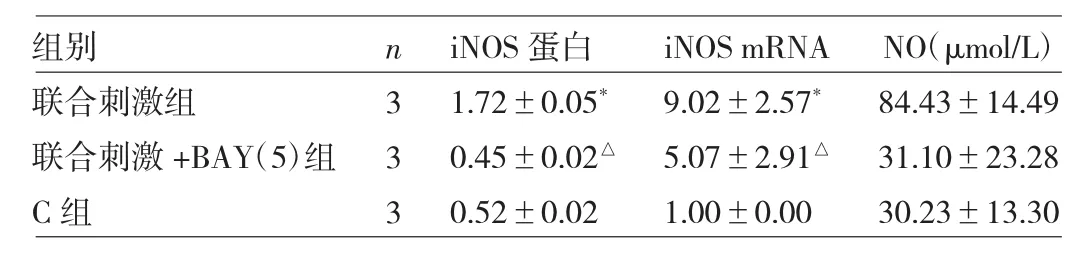
表5 3组滑膜细胞iNOS蛋白、mRNA和NO表达水平比较

图5 3组滑膜细胞中iNOS蛋白表达的电泳图
NF-κB通路作为在类风湿关节炎中发挥重要作用的信号通路之一,参与多种细胞因子的生成调节。有研究证实,IL-1、IFN-γ、TNF-α等炎症因子联合刺激巨噬细胞产生大量NO和iNOS表达,而NF-κB起基因转录的调节作用。本研究表明IL-1、IFN-γ、TNF-α单独刺激或联合刺激均能促进NF-κB活化,而NF-κB通路抑制剂BAY对于这3种炎症因子联合刺激所致滑膜细胞i-NOS和NO表达和生成显著抑制,说明NF-κB介导滑膜细胞iNOS和NO生成,这一调控作用通过NF-κB核转移来实现。但是,本研究结果可以看到与C组相比,抑制剂组的表达量仍旧较高,说明在滑膜细胞NO和iNOS生成的信号网络中除了NF-κB这条通路之外,不排除其他的信号通路参与其中,共同参与滑膜细胞NO和iNOS生成的调节。
总之,滑膜细胞在 IL-1、IFN-γ、TNF-α 刺激下能诱导NF-κB入核并活化,NF-κB活化与NO和iNOS生成调节有关。至于NF-κB是直接调节转录,还是与其他转录因子相互作用共同参与对iNOS和NO生成的调节,还需进一步研究。

