重组抗CD25人源化单克隆抗体结合活性测定法的建立及方法验证
翟志慧 梅彩英 王晓闻
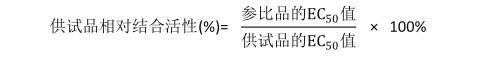

摘 要 目的:建立重组抗CD25人源化单克隆抗体结合活性测定法并对其进行方法验证。方法:采用间接ELISA法建立抗原-抗体-二抗结合反应体系,用四参数计算法拟合其结合曲线,计算供试品的结合活性。结果:方法具有良好的专属性、精密度、相对准确度、线性和耐用性。在64%~156%水平范围内,精密度验证各水平的GCV值均在15%以内;相对准确度验证各水平的相对偏倚置信区间均在±12%范围内,平均回收率均在80%~120%范围内;以五个水平实测值对数值对每个理论值对数值进行线性回归,线性关系良好。结论:该方法专属性好,精密度好,准确度高,可用于重组抗CD25人源化单克隆抗体结合活性的测定。
关键词 抗CD25人源化单克隆抗体 结合活性 验证
中图分类号:R967 文献标志码:A 文章编号:1006-1533(2019)15-0097-06
Establishment and validation of a method for the determination of the binding activity of recombinant anti-CD25 humanized monoclonal antibody
ZHAI Zhihui*, MEI Caiying, WANG Xiaowen
(Sansheng Guojian Pharmaceutical (Shanghai) Co., Ltd., Shanghai 201203, China)
ABSTRACT Objective: A method for determination of binding activity of recombinant anti-CD25 humanized monoclonal antibody was established and verified. Methods: An antigen-antibody-secondary antibody binding reaction system was established by indirect ELISA and four-parameter method was used to fit the binding curve and calculate the binding activity of samples. Results: The method has a good specificity, precision, relative accuracy, linearity and robustness. In the range of 64%-156%, the GCV values of each level were within 15% for precision validation, the confidence intervals of relative bias of each level were within ±12% for relative accuracy validation, and the average recovery rates were within 80%-120%, the linear regression of each theoretical log value with the measured log values at five levels showed a good linear relationship. Conclusion: The method has a good specificity, precision and accuracy, which can be used to determine the binding activity of recombinant anti-CD25 humanized monoclonal antibody.
KEy WORDS anti-CD25 humanized monoclonal antibody; binding activity; validation
急性排斥反應仍是器官移植术后导致移植物失功的重要危险因素,也是不良预后的一个重要影响因素[1-2]。T细胞的激活在急性排斥反应中处于中心角色,所以现在免疫抑制治疗的目标就是阻止T细胞的激活、聚集和发挥作用[3]。目前已证实,激活的T细胞可表达不同结构和数量的IL-2R[4]。
IL-2R由α链(CD25、Tac、P55)、β链(CD122、P70、P75)和γ链(CD132、P64)三个亚基组成。单独的α链只能构成低亲和力受体;β和γ链则能构成中等亲和力受体;只有三者的聚合体才能构成完整的高亲和力受体。高亲和力受体是T细胞增殖反应的关键,也是杀伤性T细胞增殖分化的必需因子。高亲和力受体的形成必须依赖IL-2Rα链(CD25)的参与[5-6]:IL-2Rα链并不转导信号,而是负责IL-2与IL-2R β链、γ链异二聚化,激活酪氨酸激酶Jak3,启动STAT分子上的Stat3、Stat5a和5b进入受体开始磷酸化[7],从而使抗原激活的T细胞开始有丝分裂和克隆扩增。
抗CD25的药物主要有重组IL-2蛋白[8-9]、抗CD25单克隆抗体(basiliximab、daclizumab)、抗CD25放射免疫结合物(131I-basiliximab[10]、90Y-daclizumab[11])、抗CD25免疫毒素(LMB-2[12]、OntakTM[13]、E7777[14])、抗CD25抗体药物偶联物(ADCT-301)等[15]。临床资料表明,抗CD25单克隆抗体作为新的免疫抑制剂的代表,特异性地作用于CD25,通过阻断T细胞的活化与增殖,能够有效降低急性排斥反应的发生率,显著提高移植物及移植受体的生存率,降低激素用量和缩短其使用时间[16]。
本公司生产的重组抗CD25人源化单克隆抗体注射液(健尼哌),是罗氏公司生产的赛呢派(daclizumab,zenapax)的生物类似药,其作用机制是通过与抗原CD25的特异结合而发挥作用的。《中国药典》2015版三部“人用重组单克隆抗体制品总论”中对效价的检定包括生物学活性和结合活性两个检项。因此,结合活性是产品重要的质控指标。本研究采用间接ELISA法测定重组抗CD25人源化单克隆抗体与抗原CD25的结合活性,并参考USP通则<1033>(Biological Assay Validation),对该方法进行方法验证。
1 材料与方法
1.1 参比品及供试品
参比品及供试品重组抗CD25人源化单克隆抗体理化对照品(简称002理化对照品,批号:S20110301)、空白辅料重组抗CD25人源化单克隆抗体原液缓冲液(简称002原液缓冲液,批号:180703)和其他IgG单抗重组抗HER2人源化单克隆抗体理化对照品(简称302理化对照品,批号:S200901)均由本公司提供。
1.2 试剂及仪器
CD25蛋白为北京义翘神州生物技术有限公司产品;Goat anti-Human IgG(Fc specific)-HRP为Sigma公司产品;EL-TMB显色试剂盒为生工生物工程(上海)股份有限公司产品;SpectraMax M5多功能酶标仪及SoftMax分析软件为美国Molecular Devices公司产品。
1.3 测定方法
将CD25蛋白用包被液稀释至0.1 mg/ml,包被酶标板,100 ml/孔,2~8 ℃过夜;用洗涤液洗板4次;用封闭液(含3% BSA的PBS缓冲液)300 ml/孔,25 ℃孵育2 h;用洗涤液洗板4次;用稀释液将重组抗CD25人源化单克隆抗体参比品及供试品分别稀释至2 500 ng/ml,再3倍比稀释10个浓度梯度达833.33、277.78、92.59、30.86、10.29、3.43、1.14、0.38、0.13和0.04 ng/ml,共11个浓度点。分别将稀释后的参比品和供试品100 ml/孔加入酶标板中,25 ℃孵育2 h;用洗涤液洗板4次;加入二抗Goat anti-Human IgG (Fc specific)-HRP(1 : 20 000),100 ml/孔,25 ℃孵育1 h;用洗涤液洗板4次;加入新配的TMB显色液,100 ml/孔,室温避光显色15~25 min,加入终止液50 ml/孔,于酶标仪检测波长450 nm参比波长650 nm处读取各孔吸收度(A)值,利用Softmax软件分析数据,以重组抗CD25人源化单克隆抗体蛋白浓度为横坐标,对应的A450-650吸光度均值为纵坐标,用四参数方程绘制剂量反应曲线。根据供试品及参比品的半数有效浓度(EC50),按以下公式计算供试品的相对结合活性。以参比品及供试品曲线的系数R2≥0.98,信噪比≥10,参比品与供试品的曲线斜率的比值在80%~120%之间,检测结果的变异系数(CV)不超过20%,作为试验成立的标准。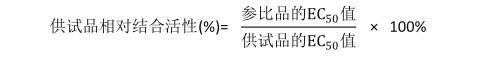
1.4 方法学验证
1.4.1 专属性
将002理化对照品用65 ℃水浴处理4 h作为强制破坏样本。取002理化对照品、002原液缓冲液、302理化对照品和强制破坏样本(65 ℃水浴处理4 h)按照上述测定方法进行相对结合活性测定,验证该方法的专属性。002理化对照品应有显著的量效曲线,实验结果拟合图应呈“S”曲线;002原液缓冲液和302理化对照品应无量效曲线;强制破坏样品的结合活性相对于参比品应呈下降趋势。
1.4.2 精密度
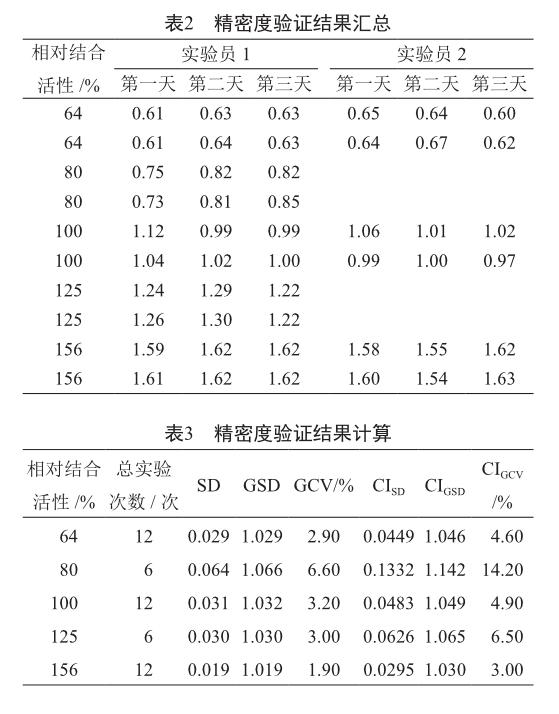
由2名实验人员,在3个不同的工作日内,对002理化对照品按照上述测定方法进行相对结合活性测定。其中实验人员1每天制备5个水平的供試品,相对结合活性分别是参比品的64%、80%、100%、125%和156%;实验人员2每天制备3个水平的供试品,相对结合活性分别是参比品的64%、100%和156%。2名实验人员每个水平的供试品需独立制备两份,在同一块板上进行测定。参比品和供试品均以双孔结果进行拟合作为一次结果,将各个水平的实测原始值取对数,计算每个水平的对数平均值、对数标准偏差(SD)、几何标准偏差(GSD)、几何变异系数(GCV)、对数标准偏差95%置信上限(CISD)、几何标准偏差95%置信上限(CIGSD)、几何变异系数95%置信上限(CIGCV)。以每一水平的几何标准偏差和几何变异系数来验证该方法的精密度。GCV应≤15%。

1.4.4 线性与范围
以相对准确度验证中的5个水平实测值对数值(纵坐标)对每个理论值对数值(横坐标)作图,评估相对结合活性的实测值对数值与理论值对数值之间的线性关系。用直线回归方程、方程斜率和回归系数来验证该方法的线性。直线回归方程斜率应在1.00±0.15,R2应≥0.95。
符合相对准确度、精密度和线性要求时的活性水平即为该方法的范围。
1.4.5 耐用性
1.4.5.1 抗原包被浓度
由同一实验人员,采用120、100和80 ng/ml 3种抗原包被浓度,按照上述测定方法测定002理化对照品的相对结合活性。每种浓度包被1块酶标板,每块板制备1份参比品和2份100%水平的供试品,参比品和供试品均以复孔结果进行拟合作为一次结果,统计6次实验结果的RSD。RSD应≤15%。
1.4.5.2 TMB显色时间
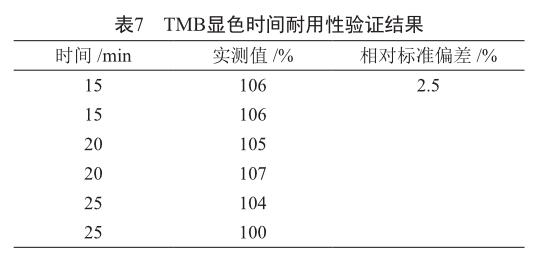
由同一实验人员,将TMB显色时间分别设置15、20和25 min,按照上述测定方法测定002理化对照品的相对结合活性。每个TMB显色时间1块酶标板,每块板制备1份参比品和2份100%水平的供试品,参比品和供试品均以复孔结果进行拟合作为一次结果,统计6次实验结果的RSD。RSD应≤15%。
2 结果
2.1 方法的专属性验证
实验结果显示,002理化对照品有显著的量效曲线,实验结果拟合图呈“S”曲线;002原液缓冲液和302理化对照品无量效曲线(图1)。强制破坏样本的相对结合活性为71%,相对于参比品呈下降趋势(图2,表1)。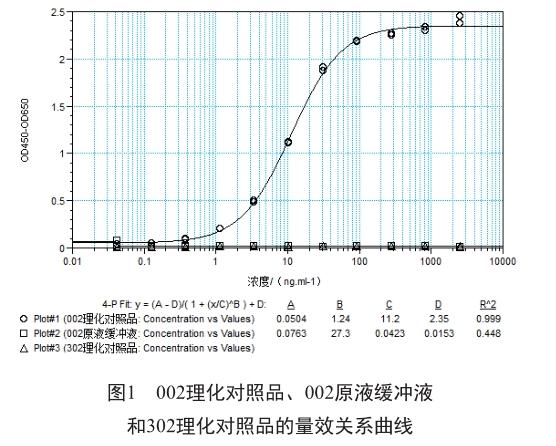
2.2 方法的精密度验证
对精密度验证的结果进行统计分析,结果显示,各水平的GCV值均在15%以内,符合可接受标准,证明该方法精密度良好(表2,表3)。
2.3 方法的相对准确度验证
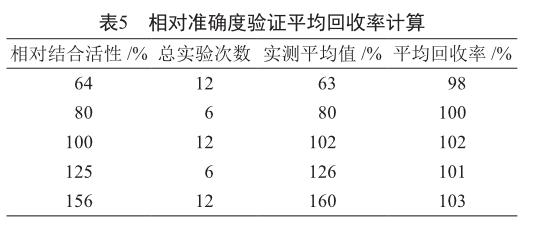
对相对准确度验证的结果进行统计分析,结果显示,各个水平的相对偏倚置信区间均在±12%范围内(表4),各个水平的平均回收率均在80%~120%范围内(表5)。两种评判方法的相对准确度指标均符合可接受标准,证明该方法相对准确度良好。
2.4 方法的线性与范围验证
以相对准确度验证中的5个水平实测值对数值(纵坐标)对每个理论值对数值(横坐标)进行线性回归,得回归方程y=1.042 2x+0.006 5,方程斜率在1.00±0.15范围内;回归系数R2=0.990 8,不小于0.95。实验结果显示,在64%~156%水平范围内,该方法的线性关系良好。
2.5 方法的耐用性验证
耐用性验证结果表明,两组实验实测值的相对标准偏差分别是2.9%和2.5%(表6,表7),说明方法的耐用性良好。

3 讨论
抗体药物对效价的评价主要包括结合活性测定和生物学活性测定。生物学活性测定方法主要包括基于细胞的生物活性测定方法(细胞增殖抑制法、细胞毒性法、补体依赖的细胞毒性法、抗体依赖性细胞介导的细胞毒性法、细胞ELISA法等)、基于转基因细胞生物活性测定方法及基于新技术的生物学活性测定方法(表面等离子共振效价测定法、均相时间分辨荧光、Alpha技术、荧光染料标记法)[17]。由于我司的重组抗CD25人源化单克隆抗体注射液(健尼哌)2011年就已经批准上市,当时并没有开发出一个操作简便、准确可靠、变异度小的生物学活性方法用于产品的批放行,而是用细胞膜表面表达CD25的人T淋巴瘤细胞系HUT-102作为靶细胞,用流式细胞技术检测抗CD25抗体与抗原CD25亲和力的方法作为产品的批放行检测方法。该方法操作繁琐、准确性差、变异度大,而且只能反映抗CD25抗体与细胞膜表面CD25之间的亲和力,并不能真正反映抗体在体内的作用机制,因此可以用操作简便、专属性强、准确可靠的间接ELISA法代替。当然,结合活性测定方法只能评价抗体药物与靶点分子在体外的相对亲和力,当前评价药效最常用的生物学活性测定方法应是开发转基因细胞生物活性测定方法。因此,后续计划构建转基因工程细胞株,开发一个操作简便、周期短、特异性好、变异度小的报告基因法用于产品批放行的生物学活性测定。
生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法。理化分析方法的验证与化学药品基本相同,可参照《中国药典》2015版三部通则<9101>“药品质量标准分析方法验证指导原则”进行,在具体验证时需要结合生物制品的特点具体考虑。而生物学测定方法相对于理化分析方法而言,存在更多的影响因素,由于通则<9101>并不涉及生物学测定方法验证的内容,目前国内可参考的只有药品审评中心发布的“生物制品质量控制分析方法验证技术审评一般原则”,但此原则尚未在生物学活性测定的基础上对方法验证参数的含义和适用性進行清楚的阐述。而USP通则<1033>则是从生物学活性测定的角度来阐明生物检定方法的验证。因此,本文参考USP通则<1033>进行了方法验证。
方法验证结果显示方法的专属性、精密度、相对准确度以及线性与范围各项指标均达到方法验证的要求。因此本方法可用于重组抗CD25人源化单克隆抗体结合活性的测定。
参考文献
[1] Asberg A, Midtvedt K, Line PD, et al. Calcineurin inhibitor avoidance with daclizumab, mycophenolate mofetil, and prednisolone in DR-matched de novo kidney transplant recipients[J]. Transplantation, 2006, 82(1): 62-68.

