富血小板血浆促进兔桡骨创伤性骨折愈合作用研究
贾春志, 金红旭, 韩龙飞, 王 玲
北部战区总医院 急诊医学部,辽宁 沈阳 110016
遭受外伤或暴力时发生的骨折为创伤性骨折,受伤肢体可产生疼痛、肿胀和瘀斑,并伴有肌腱损伤、血管损伤及关节脱位等。骨折愈合包括血肿期、炎症期、骨痂形成期和骨质再塑期4个阶段。尽早给予治疗,进行功能锻炼,争取早期愈合,避免形成畸形,丧失功能[1]。富血小板血浆(platelet rich plasma,PRP)是从自体全血中提取的富含血小板的血浆制品,含有多种生长因子,可降低炎症、感染的发生,促进骨和软组织的再生[2]。有研究发现,PRP对慢性伤口或术后切口有促进抗菌活性的作用。在骨折愈合方面,PRP可通过分泌多种细胞因子以促进骨折的愈合[2]。目前,PRP促进骨折愈合的具体机制尚未明确。本研究旨在探讨PRP对创伤性骨折愈合的促进作用。现报道如下。
1 材料与方法
1.1 实验动物与材料 健康新西兰大白兔10只,6~8个月龄,体质量2.5~3.0 kg,雌雄不限,单笼喂养,饲养环境为普通级,由青岛康大生物科技有限公司提供。电子万能试验机(岛津 AG-20K1VA),电泳仪(南京普阳仪器研究所),转印电泳槽(南京普阳仪器研究所),全自动凝胶成像分析系统(南京普阳仪器研究所),聚合酶链式反应(polymerase chain reaction,PCR)扩增仪(北京赛唯斯科技有限公司),PCR试剂盒(上海哈灵生物科技有限公司),甘氨酸、丙烯酰胺、丽春红、考马斯亮蓝、GAPDH、骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)和Ⅰ型胶原(Collagen Ⅰ)等抗体均购自Santa公司。
1.2 研究方法
1.2.1 PRP的提取 取大白兔耳缘静脉血2 ml注入乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝管中,700 r/min离心10 min;吸取上清液及1~2 mm红细胞层转移至另一EDTA抗凝管中,3 000 r/min离心5 min,弃去1/3上清液,将剩余部分吹打混匀即为PRP。按1∶9的比例向PRP中加入10%的CaCl2溶液,现用现配。
1.2.2 创伤性骨折模型的建立 应用10%水合氯醛,以3 ml/kg行腹腔麻醉,大白兔双腿备皮并消毒,切开皮肤显露桡骨中上段,切开骨膜并锯断桡骨,造成0.2 cm长的骨缺损,骨折不固定,压迫止血。将大白兔随机分为实验组和对照组,每组各5只。实验组于骨折处注射0.2 ml/kg的PRP,对照组给予同等剂量的生理盐水。两组均逐层缝合并包扎伤口。术后常规饮食,肌肉注射青霉素40 000 U/d,连续注射3 d,2次/d,隔日换药。术后第7、14、21、28、35天,实验组和对照组大白兔的骨折区分别注射PRP和生理盐水,各0.2 ml/kg[3]。
1.2.3 行为学观察及生物力学检测 观察并记录新西兰大白兔术前与术后当日、第7天的行走状态[3-4]。术后42 d,通过耳缘静脉空气栓塞处死动物,小心取下完整的双侧桡骨,置于电子万能试验机进行3点弯曲力学性能实验。以桡骨骨折处为加力点,支撑跨距为40 mm,加载速度为5 mm/min,根据载荷-变形曲线计算最大载荷、最大挠度、弹性载荷及弹性挠度[3-4]。
1.2.4 免疫印迹法检测 以骨折断端为中心,上下0.5 cm取材[3]。使用RIPA裂解组织,提取蛋白,BCA法测定蛋白浓度[5]。留取部分蛋白进行免疫印迹法检测,根据目的蛋白的分子量配制12%的分离胶和5%的浓缩胶,上样、电泳(80~130 V)、PVDF膜转膜(80 V,1 h)、封闭(5%脱脂奶粉室温封闭1 h),一抗(GAPDH,BMP-2和CollagenⅠ均购置于Santa公司,4℃过夜孵育均为1∶200配置)和二抗(购置于Santa公司,室温孵育2 h,1∶1 000配置)孵育后洗膜3次,ECL发光。
1.2.5 实时定量PCR检测 以骨折断端为中心,上下0.5 cm取材[3]。使用Trizol提取总RNA,反转录合成cDNA,定量PCR扩增后通过公式对数据进行处理[5]

2 结果
2.1 PRP对骨折愈合的作用 行为学观察结果显示,术后两组大白兔的饮食、活动均正常,伤口均Ⅰ期愈合。术后7 d,伤口缝线自行脱落,实验组大白兔行走状态基本恢复,对照组大白兔仍有轻微跛行。两组均无感染、脓肿等并发症。
2.2 PRP对骨折愈合的生物力学影响 术后42 d,实验组大白兔最大载荷、最大挠度、弹性载荷及弹性挠度均明显高于对照组,差异均有统计学意义(P<0.05)。见表1。
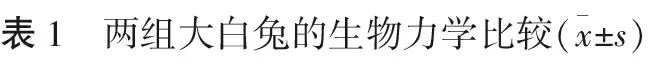

组别最大载荷/N最大挠度/mm弹性载荷/N弹性挠度/mm对照组24.28±5.870.65±0.02206.75±14.930.71±0.08实验组36.96±4.090.84±0.12223.41±12.170.89±0.21P值<0.05<0.05<0.05<0.05
2.3 两组BMP-2与CollagenⅠ检测结果比较 免疫印迹法检测以GAPDH为内参,检测两组大白兔桡骨中CollagenⅠ和BMP-2的表达。实验组CollagenⅠ和BMP-2的表达量(灰度值CollagenⅠ∶1.35;BMP-2∶1.63)明显高于对照组(灰度值CollagenⅠ∶0.84;BMP-2∶0.79),差异均有统计学意义(P<0.05)。见图1。实时定量PCR检测两组大白兔桡骨中Collagen Ⅰ和BMP-2相关mRNA的表达。其中,实验组大白兔CollagenⅠ和BMP-2的mRNA的表达为(0.78±0.13)和(1.36±0.11),均明显高于对照组的(0.47±0.16)和(0.96±0.39),差异均有统计学意义(P<0.05)。见图2。
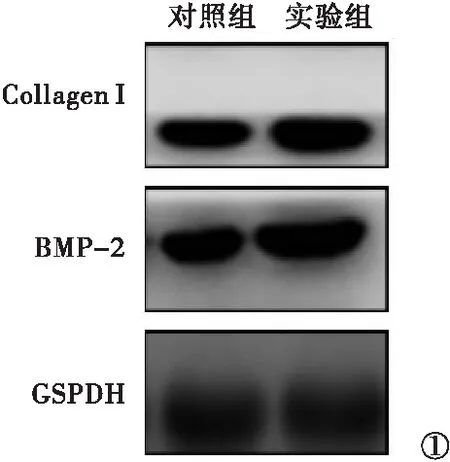
图1 两组相关蛋白表达情况比较

图2 两组相关mRNA表达情况比较
3 讨论
骨折愈合是涉及多种因子及成骨细胞、破骨细胞等多种细胞代谢的复杂过程,需要稳定的微环境。理想的骨折愈合应具备4个条件,即具有骨诱导性的生长因子、骨诱导信号通路的应答细胞、完整充足的血管和供细胞粘附增殖的支架。新西兰大白兔前肢桡骨骨折模型较好地模拟临床上的创伤性骨折,对临床治疗起指导作用。
载荷是衡量骨骼所能承受外力的指标,其数值与骨的强度成正比;挠度是反映骨骼柔韧性的指标,其数值与骨基质中胶原蛋白的含量有关[6]。本研究通过对生物力学指标的检测发现,实验组大白兔桡骨的最大载荷、最大挠度、弹性载荷和弹性挠度值均高于对照组,差异均有统计学意义(P<0.05)。这说明,PRP有助于重建骨组织结构,改善骨质量,促进骨骼强度和韧性的恢复。在对下颌骨缺损的临床研究中发现,PRP能够加速骨形成,提高骨密度[7]。在新西兰大白兔桡骨缺损的研究中,通过X线与HE染色发现,硫酸钙(calcium sulfate, CS)与PRP联合应用能够促进成骨因子的释放,加速骨生成并提高新生骨的强度,效果优于单纯CS治疗[8]。本研究结果与上述结论相似。PRP促进创伤性骨折愈合的作用机制可能是其中的血小板源性生长因子(platelet derived growth factor,PDGF)、转化生长因子-β(transforming growth factor-β,TGF-β)等与骨髓基质干细胞和骨祖细胞膜上相应的受体结合以发挥作用,刺激骨再生和修复[9-12]。CollagenⅠ在骨组织中约占骨胶原总量的95%,是骨形成过程中基本的骨基质蛋白,影响骨的强度和柔韧性,在骨结构重塑的过程中发挥重要作用[13]。免疫印迹法和实时定量PCR的测定结果显示,实验组大白兔桡骨中CollagenⅠ的表达显著高于对照组,差异有统计学意义(P<0.05)。这表明,PRP促进了骨组织的修复,对创伤性骨折的愈合具有积极作用。TGF-β能够促进成骨细胞中CollagenⅠ的合成,不仅有利于创伤愈合和骨形成过程中胶原基质、成骨细胞的沉积,还能抑制破骨细胞的形成和骨吸收,从而加速骨折的愈合。BMP是TGF-β超家族中的一员,能够有效调节成骨细胞的增殖和分化,具有较强的骨诱导活性,在骨缺损的修复中具有重要作用[14]。PRP中含有大量的生长因子,如PDGF、TGF-β1、血管内皮生长因子(vascular endothelial growth factor,VEGF)和胰岛素样生长因子(insulin-like growth factor,IGF)等,能诱导骨髓源性间充质干细胞的成骨分化,干扰破骨细胞的活化和分化,减少破骨细胞介导的骨胶原降解,在骨缺损的修复和重塑中发挥积极作用[15]。IGF-Ⅰ可促进骨胶原的合成、分泌以及成骨细胞的分化,IGF-Ⅱ能够促进软骨细胞的增殖[16]。本研究中,免疫印迹法和实时定量PCR的测定结果显示,实验组大白兔桡骨中BMP-2的表达显著高于对照组,差异有统计学意义(P<0.05)。这表明,PRP有助于上调BMP-2的表达水平,促进骨折的早期愈合。
综上所述,PRP中大量的生长因子有助于上调CollagenⅠ和BMP-2的表达水平,从而加速创伤性骨折的愈合。PRP作为一种生物制剂,具有制备简便、成本耗费低、无免疫排斥反应等优点,但今后尚需要大样本的临床研究以证实PRP的应用效果及其作用的最佳剂量。

