不同气相条件对单株产氢菌降解煤制氢的影响*
李 丹 赵伟仲 李 枫
0 引 言
为适应当今时代绿色发展,氢气作为一种高效清洁能源,它的开发利用将成为世界各国发展的主旋律。生物发酵产氢作为一种有广阔发展前景的能源制备技术应运而生。生物暗发酵制氢技术因成本低、耗能小以及发展前景优越引起广泛关注,众多学者对生物发酵产氢从宏观到微观进行了广泛的研究。HARUHIKO et al[1-2]培养的高效产氢菌取得了显著成效。有学者利用基因敲除法从小球藻抽脂残留物中获得了产气肠杆菌工程菌,产氢效率为54.61 mL/g[3]。目前,发酵产氢技术的底物仅仅限于有机废水[4]或秸秆[5]等,也有一些进行联合发酵制氢的研究[6],但以煤为发酵底物的产氢技术报道较鲜见。苏现波等[7]研究了煤厌氧发酵产氢条件,包括不同的培养基底物以及不同量的辅助菌种等,这对于生物采煤和生物采残煤有重要意义,为煤炭资源的安全和有效开采开辟了一条新的途径,具有增加能源储备和温室减排的社会效益和环境效益。
本实验在前期研究的基础上,从矿井水中对煤层本源菌进行富集筛选,成功分离出一株高效产氢菌,对菌株进行了鉴定,优选出最适碳源作为富集培养的底物。以煤为发酵底物,不同气相条件作为发酵产氢菌的影响因子,进行发酵产氢实验,测定菌种生长特性及发酵产氢能力。通过对产氢速率及产氢量来确定最优质的气相条件,对实验结束的煤样进行兰氏体积和密度分析,探讨单株产氢菌对煤样的降解情况,以便为煤发酵制氢工程提供参考依据。
1 实验部分
1.1 样品的制备及菌种来源
采集块状煤样,按照GB/T 474-2008《煤样制备方法》,利用粉碎机将煤样破碎、研磨,最后筛选粒径为0.180 mm~0.250 mm的煤样颗粒。以义马矿井水作为菌种来源。
1.2 培养基配方
为分离出产氢菌群,采用以下配方对义马矿井水中的菌群进行富集与培养:胰化酪蛋白,1.0 g;MgCl2·6H2O,0.1 g;K2HPO4·3H2O,0.4 g;NH4Cl,1 g;NaCl,2.0 g;酵母膏,1.0 g;EDTA二钠,2.0 g;L-盐酸半胱氨酸,0.5 g;NaHCO3,2.0 g;超纯水,1 000 mL;煤,10 g;微量元素液,10 mL;pH=7.0[8]。添加的碳源为:葡萄糖、乳糖、甘露醇,10 g。为了进一步筛选出单一产氢菌株,在富集培养基中加入琼脂粉制作筛选平板。
1.3 气体收集方法
采用倒置排水集气法对生成的气体进行收集。为避免集水瓶中液体因重力流入反应瓶造成反应液盐度增高而影响实验结果,集气瓶中采用超纯水。
1.4 实验方案
1.4.1 分离菌种
利用义马矿井水进行微生物暗发酵产氢实验,取产气高峰期菌液备用。
将初次分离的产氢菌液均匀涂布于平板培养基,放置于30 ℃的恒温培养箱中培养,观测菌落生长情况,按菌落的形态学特征使用接种环挑取形态一致、生长完好的单菌落进行多次重复筛选,取得单一菌株作为产氢实验的菌种来源。
1.4.2 菌种鉴定
按SK8255(细菌)试剂盒进行基因组DNA提取。采用通用引物7F1540R和27F1492R,将得到的细菌基因组16SrDNA作为模板进行PCR(体外基因扩增技术)扩增,PCR反应体系为:Template(基因组DNA 20 ng/μL~50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,脱氧核糖核苷酸三磷酸dNTP(2.5 mmol/L)1 μL,酶0.2 μL,上游引物F(10 μmol/L)0.5 μL,下游引物R(10 μmol/L)0.5 μL、加双蒸H2O至25 μL。PCR循环条件为:94 ℃预变性4 min,94 ℃高温变性45 s,55 ℃低温退火45 s,72 ℃引物延伸1 min,进行30个循环,72 ℃修复延伸10 min,4 ℃保存,并用1%琼脂糖电泳(150 V,100 mA,20 min)观察结果。回收的PCR产物用PCR引物直接测序,在NCBI上进行blast比对分析。
1.4.3 优选营养物质
为保证实验成功,选取鉴定出的高效产氢菌可利用的营养物质[9-11],对这些物质进行控制单一变量产氢实验,选择能使菌种发挥最大产氢能力的碳源。
1.4.4 发酵产氢
利用富集后的高效产氢菌进行产氢实验,培养基使用优选出来的营养物质。样品分装情况见表1。在反应瓶左侧通入相应气体,检测其产气速率,利用分光光度计定期测定菌液浓度的变化。对原煤与实验结束后的煤样进行密度及兰氏体积测试,烘干煤样,进行脱酸处理,测定反应前后煤样密度与兰氏体积值。
2 结果与讨论
2.1 菌种分离纯化结果
利用产氢培养基,从义马矿井水中分离筛选得到形态清晰完好,生长状况稳定,繁殖迅速,兼性厌氧型的单菌落,形态如图1所示。
图1 单菌落照片Fig.1 Photo of bacterial colonies
2.2 菌种鉴定结果
以分离纯化得到的单一菌株基因组16SrDNA作为模板进行PCR扩增lip基因,经1%琼脂糖电泳检测得到约为1 495 bp的DNA片段(见图2)。
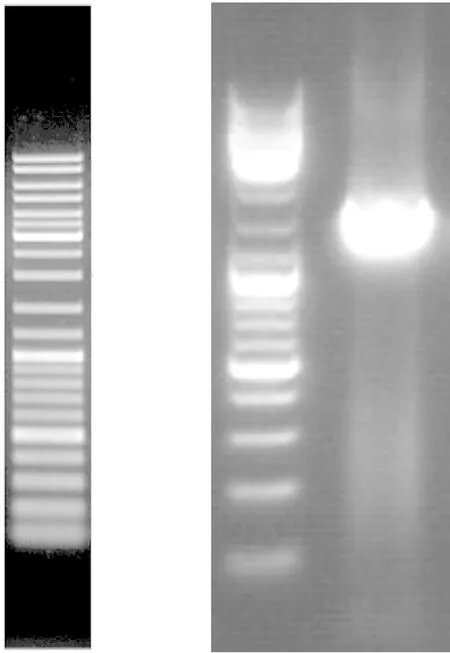
图2 菌株lip PCR扩增结果Fig.2 Electrophoresis result of PCR product of lip genes
一般认为,序列相似率在95%~99%之间定义为属,序列相似率达到99%定义为种[12]。菌株的16SrDNA测序结果见表2。由表2可知,在NCBI相关序列中blast对比后表明,该菌株属于肠杆菌属(Enterobacter)与Enterobactercloacaestrain AR0093 的序列同源性达到100%,为革兰阴性粗短杆菌,最适生长温度为30 ℃,兼性厌氧细菌,可利用大部分醇类和糖类作为底物产氢[13-14],已广泛用于研究生物降解制氢领域,本实验命名为EnterobactercloacaeYM-01。
2.3 不同碳源培养条件下菌种的产氢能力
为比较EnterobactercloacaeYM-01在不同碳源条件下的产氢能力,本实验选取三种成本低廉、能被多数细菌利用的糖类及醇(甘露醇、葡萄糖和乳糖)为底物。不同碳源条件下累积产气量见图3。由图3可知,在100 h之前,菌群降解不同的碳源得到的氢气产量差别较小,甘露醇先结束产氢。葡萄糖和乳糖的产氢周期相同,但葡萄糖在整个实验中始终处于领先地位,产氢速率最快,累积产气量达到127 mL。说明该菌对葡萄糖的利用更高效,此条件下的产氢能力最强。
表2 菌株16SrDNA核苷酸序列结果
Table2Strainsof16SrDNAnuclearacidsequence

2.4 不同气相条件下菌种浓度及其产气量的变化
本实验选用氦气、空气、一氧化碳和二氧化碳作为不同气相条件,控制通气速率和时间,研究它们对反应液中EnterobactercloacaeYM-01繁殖能力的不同气相条件下的累积产气量见图5。由图5可以看出,对于空气和一氧化碳来说,产气量开始较低,之后出现小幅度的提高,但产气量仍然很小,最大值分别为86 mL和98 mL。在氦气和二氧化碳条件下,产氢能力明显提高,产气速率较快,其最大产氢速率分别达到1.87 mL/h和1.30 mL/h,累计产气量分别为224 mL和156 mL,是空气条件下的2倍。由图4和图5还可以看出,相应产气总量的变化和菌液浓度值呈现较好的对应关系(菌液浓度越高,产气量越大)。
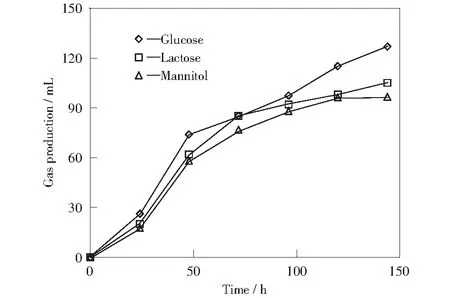
图3 不同碳源条件下累积产气量Fig.3 Cumulative gas production at different carbon sources
影响。用分光光度计(设定波长为420 nm)测定OD值表征不同气相条件下菌种浓度的变化(见图4)。由图4可知,在以空气和一氧化碳为气相条件下,随着时间的推移菌群浓度变化相似,均呈现先增后减的趋势,在45 h时达到峰值,之后菌群浓度下降,繁殖能力减弱;在以氦气和二氧化碳为气相条件下,菌种浓度与时间呈现正相关关系,分别达到0.983 Abs和0.732 Abs。
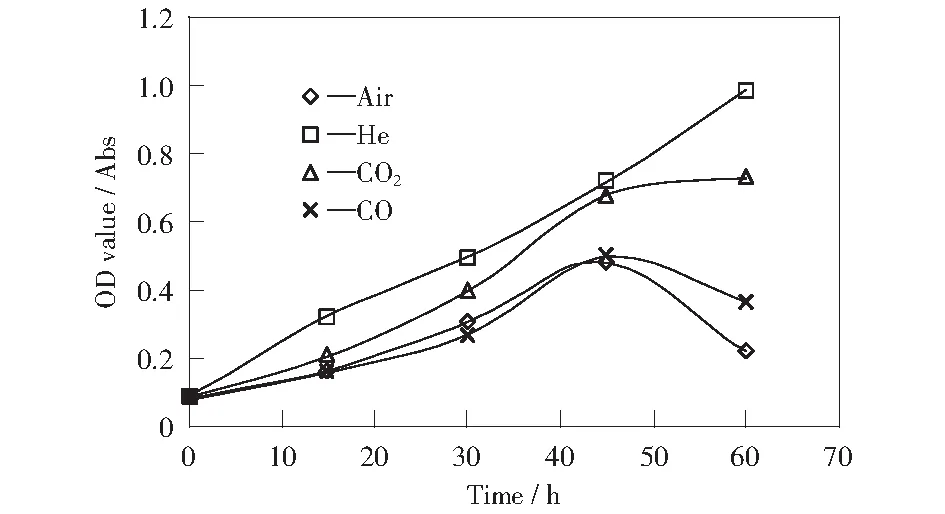
图4 不同气相条件下菌液OD值Fig.4 OD value of bacterium at different gas phases
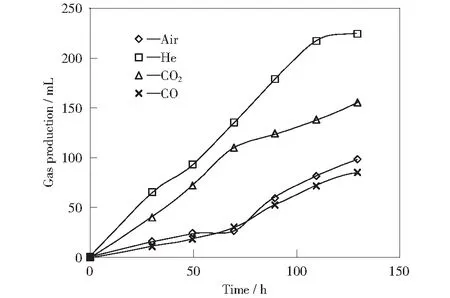
图5 不同气相条件下累积产气量Fig.5 Cumulative of gas production at different gas phases
综上分析,四种气相条件下细菌的生长繁殖能力均不同:1) 该菌在以空气为气相条件时仍能生长,但与煤反应产生的氢气量很少,这说明在该气相条件下菌种能够生长。当发酵时间足够长时,菌液浓度降低,菌株的生长代谢受到抑制,可能与氧气浓度有关:首先,空气中存在78%的氮气,但该条件下细菌的生长繁殖能力没有显著增强,氮气对其没有影响,说明该菌株为非固氮菌;其次,空气中存在21%的氧气,说明该氧气浓度下不利于菌株的生长;2) 以CO为气相时,细菌生长繁殖及产氢能力和以空气为气相时的情况类似,在反应时间达到45 h左右时,达到峰值,而后持续下降,说明细胞代谢繁殖受到抑制,CO累积到一定量使产氢菌细胞内的氢化酶处于抑制状态[15],因此菌液浓度下降;3) 以二氧化碳和氦气作为气相条件时,菌液浓度一直呈上升趋势,这是因为,反应装置中的氧被吹脱,能使培养基中保持较低的氧化还原电位和厌氧环境,有利于厌氧发酵产氢反应的进行[16],能够比较充分地发挥细菌的产氢能力;4) 与氦气相比,以二氧化碳为气相时,细菌的产氢能力较弱一些,这是由于二氧化碳溶解度较高,可以与培养基中的水进行反应生成碳酸,改变发酵环境的pH值,从而对细胞的代谢起到抑制作用[17]。气相中较高的二氧化碳浓度会产生反馈抑制,其对产氢反应的抑制性甚至高于氢气的抑制性。另外,从反应机制上分析,二氧化碳的浓度与NADH的残量成反比,而NADH途径是产氢反应重要途径之一[18],NADH的残量是产氢发酵细菌提高氢气释放的重要基础,所以较高的二氧化碳浓度减少了NADH残量,减少了总气量的产生;5) 以氦气作为通气气源时菌种的生长情况最好,氦气属于稀有气体较稳定,最大程度地保护了产氢菌的代谢环境。
2.6 煤样的变化
于不同气相条件下的产气实验结束后,煤样的密度与兰氏体积较原煤已经发生了显著的变化(见图6)。由图6a可知,兰氏体积变化波动较大,除了CO2气氛,其他气氛下的兰氏体积均较原煤的兰氏体积有所增加,尤其是通入氦气后变化最显著,比原煤增大近2 cm3/g。由图6b可知,和原煤比较,实验结束后煤样密度均有所增加,通入空气、CO和CO2,煤样密度反应前后变化波动不明显,均在1.2 g/cm3~1.3 g/cm3之间,通入氦气后的煤样密度值变化最大,超过1.3 g/cm3。
由图6还可以看出,反应后煤样密度均有所增加,说明经过微生物的作用改变了煤体结构,相比其他气氛,氦气条件下煤样密度变化最大,说明该状态下的细菌对煤样的利用率更高,反应较彻底,但其变化值不明显,所以并不能由此推断煤样结构的具体变化情况。通入氦气后与原煤样相比兰氏体积的变化最明显,说明通入氦气后,驱赶了煤厌氧发酵的氧气,使得细菌能够在专性厌氧条件下生长繁殖,经过产氢菌的作用改变了煤样吸附甲烷的能力,反应后煤样的开放型孔增加,孔隙连通性增强[19],该条件下细菌对煤的利用更彻底。
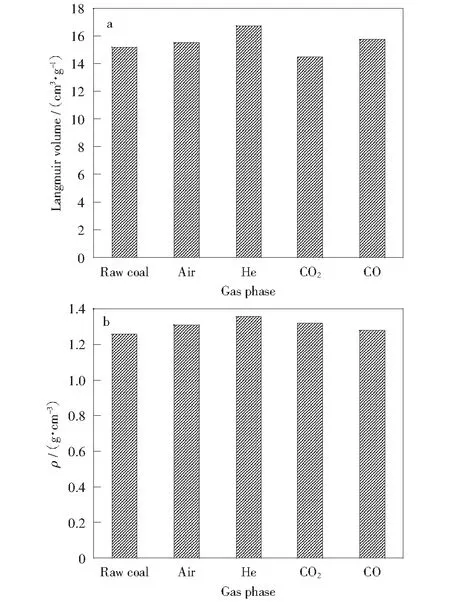
图6 不同气相条件下发酵结束后煤样兰氏体积及密度Fig.6 Langmuir volume and density of coal after fermentation at different gas phases a—Langmuir volume;b—Density
3 结 论
1) 通过涂布平板法重复实验有效筛选出一株高效产氢菌,该菌株与肠杆菌属(Enterobacter)的Enterobactercloacaestrain AR0093同16SrDNA序列同源性最高。
2) 改变产氢菌可利用的营养物质,优选出最适宜该菌的营养物质为葡萄糖。
3) 气相条件对产氢菌的生长和产氢量有着重要影响,通气条件下的菌浓度由强到弱依次为氦气、二氧化碳、空气、一氧化碳。累积产氢量与其也有相同次序,两者之间具有较好的相关性。
4) 氧分子对产氢菌的发酵产氢过程有明显的抑制作用,在进行发酵细菌的产氢实验过程中应尽量采用其他气体如氮气、氩气和二氧化碳来吹脱空气中的氧气。
5) 在反应前后煤样密度变化不大,对反应前后的煤样进行等温吸附后,发现通入氦气后兰氏体积变化较明显,说明氦气条件下产氢菌对煤的利用更充分更彻底。

