术前应用地舒单抗对骨巨细胞瘤瘤体血运的影响
杨勇昆 黄真 丁宜 张文 徐海荣 刘巍峰 牛晓辉
骨巨细胞瘤虽然病理表现为良性骨肿瘤,但是局部侵袭性明显,具有术后复发倾向,并影响患者肢体功能和生活质量[1-2]。骨巨细胞瘤中的多核巨细胞在细胞形态、组织化学和骨吸收功能调控等方面与破骨细胞相似[3],故又被称为破骨细胞样多核巨细胞。地舒单抗是一种新型人源化 RANKL 单克隆抗体,可特异性的与 RANKL 结合,从而阻断 RANKLRANK 通路。该药物可通过阻断破骨细胞的分化而达到抑制骨破坏的作用[4]。近年来,地舒单抗逐渐应用于骨巨细胞瘤的治疗,特别是复发病例和难以通过手术切除的病例。地舒单抗治疗可促进病灶边缘硬化、骨皮质增厚和新生骨形成等[5-6]。一些临床研究显示[7-11],术前用药可以减小肿瘤体积,使肿瘤周边硬化,更清楚的显示出肿瘤范围,从而将不可切除的肿瘤转化为可以手术切除的肿瘤。
骨巨细胞瘤最好发于四肢长管状骨,但也有许多病例发生于骶骨和骨盆[12-13]。由于骨巨细胞瘤属于良性骨肿瘤,大部分患者可接受刮除手术,同时由于肿瘤血运十分丰富,术中出血量较大。特别是骶骨和骨盆部位的肿瘤,存在术中不能通过止血带止血、局部解剖结构复杂和手术时间长等因素,这些因素可导致术中失血量大大增加,甚至危及患者生命[13-14]。因此,笔者通过本研究的主要目的是评价地舒单抗是否可以真正降低肿瘤血运,从而减少术中失血。本研究从影像学和组织学两方面的变化来评估骨巨细胞瘤接受地舒单抗治疗前后的肿瘤血运变化情况。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 从 2014 年 6 月至 2017 年6 月,年龄 ≥ 12 岁或骨成熟者;( 2 ) 病理证实为骨巨细胞瘤者;( 3 ) 有可评价的骨病灶者;( 4 ) 药物治疗前病变部位手术治疗困难或者不能进行手术或有可能通过药物治疗将切除手术转变为保留关节的刮除手术者;( 5 ) 药物治疗后接受最终手术治疗者。
2. 排除标准:( 1 ) 评价部位接受过动脉栓塞、放疗等可能影响病灶血运的治疗者;( 2 ) 有下颌骨坏死或骨髓炎病史者;( 3 ) 孕妇;( 4 ) 拒绝入组本研究者。
本研究共纳入 22 例,男 12 例,女 10 例。所有患者均有完整的用药前后影像学和组织学资料。患者平均年龄 32.1 ( 18~48 ) 岁。病灶部位如下:骶骨9 例,桡骨 4 例,胫骨 2 例,肱骨 2 例,髂骨、坐骨、尺骨、股骨和腓骨各 1 例。
二、研究和评价方法
1. 用药方案:患者每 4 周接受一次地舒单抗120 mg 治疗,在首次治疗的第 8 天和第 15 天各增加一次用药。用药前患者在我院接受骨病灶部位增强CT 检查,地舒单抗治疗后 3 个月在同一台 CT 再次接受增强 CT 检查,两次 CT 检查的注射造影剂的剂量和扫描时间一致。用药后 3 个月对肿瘤进行影像学评价,如用药前不可切除的病灶通过药物治疗转变为可手术的切除病灶或用药前不可保留关节的病灶,药物治疗后转变为可通过保留关节的刮除手术治疗的病灶,则停止用药,患者接受最终手术。如未达到上述标准,则继续用药后 3 个月再评价。本研究中全部患者均接受最终手术治疗,术前平均接受地舒单抗治疗 5 个月 ( 中位 4,范围 3~12 )。
2. 影像学测量:测量时根据肿瘤大小在 CT 中选取 4~8 个层面,每个层面分别选取肿瘤区域测量,先将明显囊性变、硬化或骨性分隔的区域排除,对剩余的肿瘤区域进行测量。用药前后分别测量病变相同层面的相同区域的 CT 值,并测量相同层面的主要血管 CT 值。CT 强化率=增强 CT 值 / 平扫CT 值。以血管强化率为参照,如用药前后血管强化率无显著差异,则用药前后的 CT 检查具有一致性和可比性。
3. 微血管密度检测:微血管密度的计数应由两位病理医师分别进行。对药物治疗前的穿刺标本和治疗后的术后标本,分别进行免疫组化染色和微血管密度 ( MVD ) 测量。通过 CD34 抗体的免疫组化染色显示病灶内微血管[15-16]。首先在低倍镜 ( 40×、100× ) 下浏览整张 HE 切片,寻找肿瘤范围内血管密度最高的区域,即热点区,将这些区域作为免疫组化标记计数血管的区域,然后于高倍镜 ( 200× )下进行微血管的计数。计数时,任何被临近血管、肿瘤细胞或者结缔组织所分隔的呈阳性染色的血管内皮细胞、内皮细胞团都计数为一个单独的血管,即使这些血管可能是临近血管的不同断面,也单独计数。最后对多个高倍视野下的血管密度取平均值,进行统计学分析。
三、统计学处理
采用统计软件 SPSS 20.0 进行数据分析。计算用药前后平扫和强化 CT 的平均值以及 CT 强化率;计算用药前后病灶微血管密度的平均值;采用均值t检验比较用药前后 CT 值、强化率和微血管密度的变化情况。P<0.05 为差异有统计学意义。
结 果
一、血管强化率
用药前血管平扫 CT 值平均为 44.2 ( 38~52 ),血管强化 CT 值平均为 136.8 ( 94~173 );用药后血管平扫 CT 值平均为 43.6 ( 35~55 ),血管强化 CT 值平均为 137.7 ( 93~165 );血管用药前和用药后的平均强化率分别为 3.10 ( 1.90~4.59 ) 和 3.16 ( 1.92~4.72 ),差异无统计学意义 (P=0.862,t=0.136 ),说明用药前后的 CT 值具有可比性 ( 表1 )。
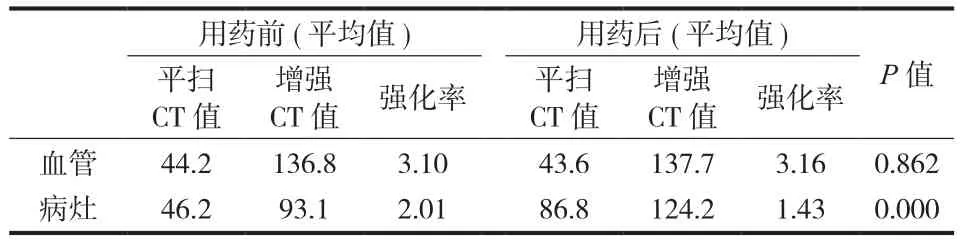
表1 血管与病灶用药前后强化率比较Tab.1 Comparison of enhancement rates of vessels and lesions before and after medication
二、病灶强化率比较
用药前病灶平扫 CT 值平均为 46.2 ( 33~68 ),病灶强化 CT 值平均为 93.1 ( 50~150 );用药后病灶平扫 CT 值平均为 86.8 ( 38~357 ),病灶强化 CT值平均为 124.2 ( 39~380 );病灶用药前和用药后的平均强化率分别为 2.01 ( 1.22~4.16 ) 和 1.43 ( 1.03~2.31 ),差异有统计学意义 (P=0.000,t=18.325 ),用药后的病灶 CT 强化率显著降低 ( 表1 )。
三、病灶平扫 CT 值比较
用药前平均值为 46.2,用药后平均值为 86.8,用药后病灶平扫 CT 值显著升高 (P=0.032,t=5.255 )。说明肿瘤的组织构成发生变化,新生骨形成显著增加,组织硬化明显。
四、骶骨或骨盆与四肢骨病灶的病灶强化率比较
骶骨或骨盆病例用药前后病灶平均强化率分别为 2.43 和 1.58,用药后病灶强化率降低至用药前的65.0%,显著降低 (P=0.001,F=15.657 )。四肢骨病例用药前后病灶平均强化率分别为 1.60 和 1.28,用药后病灶强化率降低至用药前的 80.0%,显著降低 (P=0.044,F=4.125 )。骶骨或骨盆病例用药后CT 强化率降低较四肢骨病例更为显著 (P=0.012,F=8.665 ) ( 表2 )。
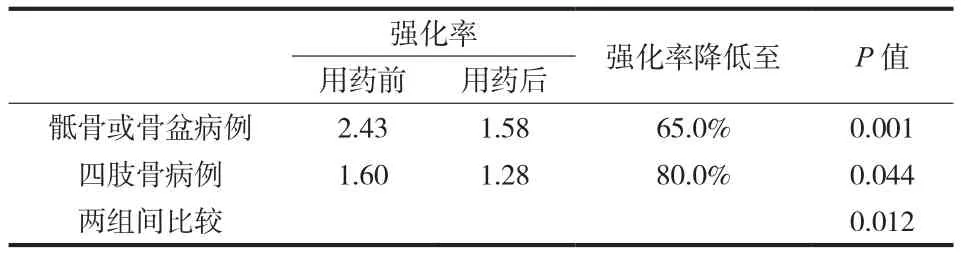
表2 骶骨或骨盆病例与四肢骨病例用药前后强化率比较Tab.2 Comparison of enhancement rates of sacral or pelvic cases and limb cases before and after medication
五、组织学和微血管密度变化
药物治疗后的术后大体标本显示标本组织硬化程度显著增加,周边硬化明显,病灶内新生骨和骨性分隔增加,肿瘤组织呈现出质地坚韧甚至坚硬如骨质的状态,明显不同于骨巨细胞瘤的典型表现。药物治疗前后的病灶内微血管密度平均值分别为224.4 ( 68~324 ) 和 106.8 ( 21~197 ),治疗后的微血管密度显著降低 (P=0.000,F=42.437 ) ( 图1 )。药物治疗后的组织学检查显示破骨细胞样多核巨细胞几乎消失,单核基质细胞明显减少 ( 图2 )。

图1 用药前的穿刺肿瘤组织 ( a ) 显示典型的骨巨细胞瘤的组织学特征,密集的单核基质细胞中夹杂大量的多核巨细胞;用药后的术后肿瘤组织 ( b ) 显示破骨细胞样多核巨细胞几乎完全消失,单核细胞显著减少Fig.1 Tumor biopsy tissues ( a ) before treatment showed typical histological features of bone giant cell tumors, with a large number of multinucleated giant cells mixed in dense mononuclear stromal cells.Postoperative tumor tissues ( b ) after treatment showed that osteoclast-like multinucleated giant cells almost disappeared and monocytes decreased significantly

图2 药物治疗前后肿瘤组织免疫组化微血管染色。治疗前的病灶 ( a ) 中可见大量的 CD34 抗体染色的微血管,治疗后的病灶 ( b ) 中 CD34 抗体染色的微血管显著减少F i g.2 I m m u n o h i s t o c h e m i c a l microvascular staining of tumor tissues before and after treatment. A large number of microvessels stained with CD34 antibody were observed in the lesions before treatment ( a ), and the microvessels stained with CD34 antibody decreased significantly in the lesions after treatment ( b )
六、术中情况
骶骨或骨盆病例的平均术中失血量和手术时间分别为 1883 ( 600~3000 ) ml 和 260 ( 180~390 ) min。四肢骨病例的平均术中失血量和手术时间分别为300 ( 30~800 ) ml 和 180 ( 120~270 ) min。
讨 论
新型单克隆抗体药物地舒单抗通过特异性的与 RANKL 结合,可以阻断破骨细胞活化所需要的RANKL-RANK 通路,从而达到抑制破骨细胞介导的骨破坏的效果[4,17]。该药物近年来逐步应用于多种骨病和骨肿瘤的临床治疗,并在难治性或复发骨巨细胞瘤的治疗中显示出一定的积极效果。由于骨巨细胞瘤血运丰富,特别是位于骶骨或骨盆等解剖结构复杂、毗邻重要血管和脏器的部位的肿瘤,术中失血和手术风险较大[12-14],如何在术前降低肿瘤血运是值得研究的课题。本研究着眼于新型药物地舒单抗在骨巨细胞瘤术前治疗中的意义,评价和分析术前地舒单抗治疗是否可以降低肿瘤血运,从而为提高手术安全性提供帮助。
关于地舒单抗在骨巨细胞瘤治疗中的临床效果,既往临床研究显示,应用地舒单抗治疗骨巨细胞瘤,可以使患者临床获益,缓解临床症状。一项2 期临床试验[5]显示,将地舒单抗用于 35 例不可切除或复发骨巨细胞瘤的治疗,经过平均 25 周的治疗后,86% 的病例达到显著的疗效和临床获益,包括疼痛缓解和功能改善。该研究还证实了地舒单抗在骨巨细胞瘤中具有显著地抑制破骨细胞形成和活性的作用。Dubory 等[18]报道脊柱骨巨细胞瘤接受地舒单抗 6 个月治疗后,患者的疼痛和神经症状有明显缓解,临床获益显著。
当骨巨细胞瘤导致的骨破坏范围较大且伴有巨大的软组织包块时,尤其是位于骶骨或骨盆的肿瘤,手术治疗非常困难。术中失血量往往较大,而术中失血不仅增加患者的围手术期风险,还会严重干扰术中视野和术者的操作,增加其它并发症的风险和获得安全的外科边界的难度。如果肿瘤血运和术中失血可以得到降低,手术操作将会更加从容和安全。研究显示[19-20],病灶部位的 CT 强化率可以反映肿瘤的血运丰富程度。本研究为了提高 CT 检查结果的一致性,用药前后均在同一台 CT 仪器进行检测。用药前后测量 CT 值时选择相同层面的相同病灶区域。结果显示用药前后的血管强化率相似,没有统计学差异,这提示用药前后 CT 的检查和测量值具有一致性和可比性,说明本研究方法的科学性。
本研究结果显示地舒单抗治疗后肿瘤的 CT 强化率显著降低,这提示了肿瘤血运的显著降低。同时笔者还对用药前后的肿瘤标本进行了微血管密度的染色和测算,并得到了相似的结果,药物治疗后的微血管密度有显著降低。因此,本研究从影像学和组织学两方面证实了地舒单抗治疗可以降低骨巨细胞瘤的肿瘤血运情况。组织学结果还显示,药物治疗后破骨细胞样多核巨细胞几乎完全消失,这与既往的研究报道结果相似[9,17,21]。关于药物治疗降低肿瘤血运的相关机制还有待进一步研究,这一现象是否与多核巨细胞的消失和肿瘤基质细胞的显著减少相关,值得今后开展更深入的研究。
笔者通过对本研究数据进一步分析还发现,骶骨或骨盆病例的肿瘤 CT 强化率降低更为明显。本组病例中骶骨或骨盆病例的术中失血量平均为 1883( 600~3000 ) ml,病灶内的出血速度和出血量相对于没有接受地舒单抗治疗的病例有显著减少,同时肿瘤的硬化程度有显著增加。因此,术前应用地舒单抗在骶骨或骨盆病例中具有更好的减少术中失血的效果。
本研究的组织学结果显示药物治疗后破骨细胞样巨细胞几乎消失和单核细胞的显著减少。Branstette 等[9]报道一项将地舒单抗用于复发或不可手术切除的骨巨细胞的 2 期临床试验显示相似的组织学变化结果,用药后破骨细胞样巨细胞数量减少90% 以上,而肿瘤基质细胞也有显著减少。Isabella等[21]报道经过 6 个月的地舒单抗治疗后,呈现显著的影像学和组织学变化,多核巨细胞和 RANKL 表达几乎完全消失,影像学检查显示皮质骨显著增厚和新生骨显著增加,使得一些病例可以接受肿瘤刮除而非切除。
用药后病灶平扫 CT 值的显著提高提示病灶硬化程度的增加,影像学上病灶变化非常显著,本研究显示的这一结果与既往一些研究报道结果[5-6,9,21-22]相似。这些硬化和新生骨增加可以使肿瘤的边界更为清晰,从而使肿瘤的整块切除更为容易操作,但同时会增加刮除的难度,尤其是骶骨肿瘤的刮除。尽管新生或增厚的骨鞘允许术者在这个硬化的边界内进行刮除,但硬化的骨鞘中很可能包含有肿瘤细胞,并会成为术后复发的源头和风险。Mak 等[23]报道当应用地舒单抗治疗时,肿瘤基质细胞处于休眠状态,而一旦停药,这些细胞就会恢复增殖和活性。一项最新的系统回顾性研究[24]对 686 例行数据分析,结果显示术前应用地舒单抗虽然可以通过抑制破骨细胞来缩小肿瘤体积,但并不能有效降低术后复发。
综上所述,本研究提示骨巨细胞瘤接受地舒单抗治疗后,肿瘤的 CT 强化率和术后标本的微血管密度显著降低,术前应用地舒单抗治疗可显著降低骨巨细胞瘤的肿瘤血运。降低肿瘤血运的相关机制以及该药物对患者预后的影响有待进一步的深入研究。

