长链非编码RNA ITGβ2-AS1对胰腺癌MAPK信号通路的作用及机制*
陈世裕,喻超,潘耀振,陈玲,李琳,杨哲豪,吕彦霖,邓路,孙诚谊**
(1.贵州医科大学,贵州 贵阳 550004;2.贵州医科大学附院 肝胆外科,贵州 贵阳 550004;3.贵州医科大学 肝胆胰脾重点实验室,贵州 贵阳 550004;4.贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
胰腺癌(pancreatic cancer,PC)是恶性程度极高、进展迅速及预后极差的肿瘤,目前治疗PC最有效的方式为早期手术切除[1-2],但全球PC死亡率一直居高不下,5年生存率仅7%[3-4]。PC诊断及治疗的困难与肿瘤细胞的增殖速度快和转移能力强密切相关[5],因此,寻找更为有效的治疗方案成为当前PC研究的关键。长链非编码RNA(long non-coding RNA,LncRNA)是长度>200 nt、但不具有编码蛋白质功能的一类RNA[6-7]。研究认为LncRNA在肿瘤的侵袭及迁移过程中发挥重要的生物学功能[8-10]。LncRNA在各种疾病的发生发展过程中所起到的作用不断被发现,有望成为临床诊疗的新方向。Prensner等[11]发现 LncRNA SChLAP1 在前列腺癌中表达上调,与患者生存呈负相关,其可能通过影响染色体重塑促进前列腺癌的侵袭及迁移。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是介导PC细胞增殖、侵袭及迁移功能的一条关键信号通路[12-14],可被细胞因子及细胞黏附因子等激活,将信号转导至胞内最终转录调控相关靶基因的表达进而影响细胞功能[15-16],研究发现LncRNA可能在MAPK信号通路中发挥重要的生物学作用[17-18]。然而,LncRNA 整合素β2(ITGβ2)-AS1是否能调控MAPK信号通路下游相关靶基因以实现其功能仍不清楚,因此,在课题组前期研究的基础上,本研究利用癌症基因组图谱(TCGA)数据库分析ITGβ2-AS1可能发挥的细胞学功能和参与的信号通路、分析ITGβ2-AS1与人PC细胞株PANC-1细胞中MAPK信号通路的调控关系,以进一步阐明其在PC的增殖、侵袭及迁移过程中的分子机制。
1 材料与方法
1.1 细胞株与主要试剂
人PC细胞株PANC-1细胞株为中山大学肿瘤防治中心惠赠,胎牛血清(FBS)、胰蛋白酶(TRYPSIN)、DMEM及RPMI-1640培养基均购自美国gibco公司,RNA提取试剂Trizol购自美国Invitrogen公司,BCL2、MMP9及MYC等引物购自Sangon Biotech公司,相应Western blot一抗购自proteintech公司,ITGβ2-AS1-sh购自RIBOBIO公司,逆转录试剂盒及SYBR Premix ExTaq试剂盒均购自日本TaKaRa公司。
1.2 方法
1.2.1生物信息学分析 利用cBioPortal网站在线分析TCGA数据库(http://www.cbioportal.org/),选择胰腺导管腺癌数据库PAAD,数据类型选择mRNA表达谱,根据TCGA数据库分析结果,选取与ITGβ2-AS1相关的基因中相关系数较大(Person系数>0.6)的基因进行GO富集分析,包括细胞组成(cellular component,CC)、生物过程(biological process,BP)及分子功能(molecular function,MF)分析。
1.2.2细胞培养 人PC细胞株PANC-1使用含10%FBS及1%青-链霉素双抗的DMEM培养基培养于37 ℃、含5% CO2的恒温恒湿培养箱中,分为ITGβ2-AS1干扰对照组(Negative Control组)及ITGβ2-AS1干扰组(ITGβ2-AS1-sh组)。
1.2.3mRNA表达 选择处于对数生长期的PANC-1细胞,提取其总RNA,分别测量A260/A280时的吸光度,选取吸光度值在1.8~2.0的样品进行实验。依照逆转录试剂盒的说明,分别将样品逆转录为cDNA,再选择GAPDH作为内参,使用SYBR Premix ExTaq试剂盒进行qPCR实验。
1.2.4蛋白表达 选择处于对数生长期的PANC-1细胞,提取其总蛋白,根据蛋白定量结果点样、电泳、转膜、封闭、孵一抗、洗膜、孵二抗、洗膜、曝光,用Image Lab软件分析所得条带的灰度值,检测各相关指标的蛋白表达量。
1.3 统计学处理
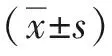
2 结果
2.1 ITGβ2-AS1的生物学功能
根据TCGA数据库分析结果,选取与ITGβ2-AS1相关的基因中相关系数较大(Person系数>0.6)的基因进行GO富集分析。CC分析结果显示:ITGβ2-AS1可能负调控细胞凋亡过程,正调控GTP酶活性和各信号通路转导MAPK信号通路(图1A); BP分析结果显示ITGβ2-AS1可能存在于细胞膜外区域、外泌体及高尔基体膜区域(图1B), MF分析结果显示ITGβ2-AS1可能与氧转运体活性、离子通道结合及RAS活性调控等功能相关(图1C),提示ITGβ2-AS1可能与PC的增殖及相关肿瘤信号通路转导密切相关。
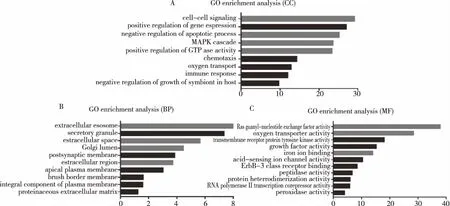
图1 GO富集分析ITGβ2-AS1的生物学功能Fig.1 GO enrichment analysis of the biological function of ITGβ2-AS1
2.2 ITGβ2-AS1的下游信号通路
根据TCGA数据库分析结果,选取与ITGβ2-AS1相关的信号通路中相关系数位于前12的信号通路进行分析,结果显示:多条信号通路与PC的发生发展过程显著相关,如癌症信号通路(Pathways in cancer)、钙信号通路(Calcium signaling pathway)、MAPK信号通路(MAPK signaling pathway)及缺氧诱导因子1信号通路(HIF-1 signaling pathway)等(图2);提示ITGβ2-AS1可能参与多条癌症信号通路如MAPK信号通路的转导与调控。

图2 生物信息学分析ITGβ2-AS1的下游信号通路Fig.2 KEGG analysis of ITGβ2-AS1-associated signaling pathway
2.3 对MAPK信号通路靶基因表达的影响
生物信息学分析结果显示:ITGβ2-AS1可能与MAPK信号通路靶基因BCL2、MMP9及MYC的表达显著相关且存在共表达的关系(图3A);qPCR结果(图3B)表明与干扰对照组比较,ITGβ2-AS1干扰组PANC-1细胞BCL2、MMP9及MYCmRNA表达水平显著下调(P<0.05);这些结果提示ITGβ2-AS1可能正调控MAPK信号通路靶基因的表达。

注:(1)与Negative Control组比较,P<0.05。图3 ITGβ2-AS1对MAPK信号通路靶基因表达的影响Fig.3 Effect of ITGβ2-AS1 on the expression of target genes of MAPK signaling pathway
2.4 ITGβ2-AS1对MAPK信号通路活性的影响
如图4所示,ITGβ2-AS1干扰组PANC-1细胞总ERK1/2蛋白表达水平与干扰对照组比较,差异无统计学意义(P>0.05),而磷酸化的ERK1/2蛋白表达水平则显著低于干扰组,差异有统计学意义(P<0.05)。提示ITGβ2-AS1可能通过调控ERK1/2的磷酸化水平从而影响MAPK信号通路的活性。

注:(1)与Negative Control组比较,P<0.05。图4 ITGβ2-AS1对MAPK信号通路活性的影响(Western blot)Fig.4 Effect of ITGβ2-AS1 on the activity of MAPK signaling pathway
3 讨论
PC由于其发病过程隐匿、进展迅速、早期诊断及手术切除困难导致治疗效果不佳。近年来,尽管各种治疗方法不断完善,但PC患者的 5 年生存率仍低于7%,其重要原因之一就是其侵袭能力极强[4-5]。
整合素蛋白家族 (integrin family,ITG) 是广泛分布于细胞表面的四类细胞黏附分子之一,是由α和β两个亚基组成的异源二聚体跨膜蛋白整合素家族,可以改变肿瘤的增殖、侵袭及迁移等多种生物学功能[19-20]。其中,ITGβ2主要在各种白细胞的表面表达,并能够与肿瘤细胞表面的黏附分子结合,从而赋予肿瘤细胞向远处转移的能力[21-22]。有研究报道,长链非编码RNA ITGβ2-AS1起源于ITGβ2的启动子,LncRNA ITGβ2-AS1通过上调ITGβ2的表达从而促进乳腺癌的侵袭和迁移[23],并在骨肉瘤的增殖和转移过程中发挥着重要作用[24]。LncRNA的表达失常与包括恶性肿瘤在内的多种疾病的发生发展密切相关[8]。然而,对于 LncRNA 在肿瘤中所起到的作用目前尚处于初步探索阶段,特别是对LncRNA ITGβ2-AS1在PC的侵袭转移过程中所发挥的作用更是知之甚少,因此,进一步深入研究其发挥作用的分子机制有助于为临床提供更为有效的治疗措施。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)是MAPK信号通路的重要成员之一,是将信号从细胞表面受体传导至细胞核的关键,参与细胞的增殖、分化、凋亡和癌变等多种生物学反应[25-26],其因在激活的生长因子受体与基因表达的变化中的作用最为人们所熟知,激活的ERK1/2进入细胞核并磷酸化转录因子;ERK1/2也可转移到内质网、核小体及高尔基体和线粒体等其他细胞器激活特定的底物从而影响细胞的生理过程[27-28]。然而,目前对于LncRNA在PC细胞ERK1/2的磷酸化激活过程中的调控方式仍不完全清楚。本研究先通过生物信息学分析发现ITGβ2-AS1可能与PC的增殖及相关肿瘤信号通路转导密切相关,并可能参与下游MAPK信号通路的转导与调控;通过相关性分析及qPCR实验验证,结果显示ITGβ2-AS1可显著调控MAPK信号通路中与PC细胞增殖、侵袭及异常代谢显著相关的靶基因BCL2、MMP9及MYC的表达,推断ITGβ2-AS1可能激活MAPK信号通路进而调控下游的靶基因。最后通过Western blot实验验证上述推断,结果提示ITGβ2-AS1可显著影响ERK1/2的磷酸化水平,从而发挥调节MAPK信号通路的作用。
综上所述,本研究通过生物信息学分析并结合相关实验验证,ITGβ2-AS1在PC细胞相关肿瘤信号通路——MAPK信号通路的激活过程中发挥重要作用,ITGβ2-AS1通过调控MAPK信号通路中关键分子ERK1/2的磷酸化水平,进而调控下游靶基因的表达。课题组今后将进一步通过相关分子生物学实验及临床样本信息深入探讨ITGβ2-AS1介导MAPK信号通路激活在PC的发生发展过程中的具体分子机制及临床意义,为发现可能针对PC治疗的新靶点提供理论依据。

