异柠檬酸脱氢酶1对替莫唑胺干预下U87细胞细胞凋亡的影响*
王举波, 权瑜, 吕健, 董丹凤
(1.西安交通大学第二附属医院 神经外科, 陕西 西安 710004; 2.西安交通大学第一附属医院 肿瘤内科, 陕西 西安 710061)
脑胶质瘤是发病率最高、且最具危险性的颅内原发恶性肿瘤,尽管近年来外科技术及各种综合治疗方法不断更新,但仍然难以改变其高居不下的致死率及致残率[1-4]。肿瘤细胞增殖同时存在细胞死亡[5],主要包括坏死与凋亡,后者是细胞自身增殖调控的重要方式,是由几条经典凋亡通路控制的程序性死亡[6],与肿瘤的进展关系密切[7-8],研究胶质瘤细胞的凋亡与增殖特性具有重要的临床价值[9]。柠檬酸脱氢酶1(isocitrate dehydrogenase1,IDH1)在胶质瘤中有着广泛的突变率,且突变型患者具有相对较好的预后[10-11],但目前国内外对突变型胶质瘤患者良好预后的机制鲜有报道,本研通过研究异柠檬酸脱氢酶1(mutant isocitrate dehydrogenase1,mIDH1)基因过表达对替莫唑胺(temozolomide,TMZ)干预下人脑恶性胶质瘤细胞系U87凋亡的影响,探讨mIDH1影响胶质瘤患者预后的原因,为临床治疗提供参考。
1 材料与方法
1.1 材料与试剂
U87人脑恶性胶质瘤细胞系由西安交通大学医学院中心实验室提供,Caspase-3及Caspase-9兔抗人单克隆抗体购买于Santa Cruze公司,胎牛血清购自四季青公司,脂质体Lip2000系购自Sigma公司,Western blot试剂盒购自上海锐赛公司;研究所用的相关基本试剂及试验耗材均购自西安交通大学实验耗材供应中心,基本操作仪器由西安交通大学环境重点实验室提供。
1.2 方法
1.2.1细胞培养 U87细胞用含有双抗(青霉素、链霉素各100 000 IU/L)、10%胎牛血清的DMEM培养基在37 ℃培养箱、5% CO2条件下培养,定时换液、传代。
1.2.2真核表达载体构建与目的基因细胞稳定转染 采用Primer5 软件设计IDH1 PCR扩增引物,模板为Pcmv-IDH1、参考文献进行扩增,PCR产物大小为225~1 466 bp ;采用限制性内切酶BamH I和Sac1进行双酶切,回收酶切片段,T4 DNA 连接酶对载体与双酶切产物进行重组,构建(wild isocitrate dehydrogenase1,wIDH1)真核表达载体,利用点突变试剂盒突变技术构建mIDH1真核表达载体。U87细胞接种培养融合率达60%~70%时,以脂质体Lip2000转染细胞,G418筛选,直至稳定的单细胞克隆株出现,对单细胞克隆株传代培养,冻存留种。
1.2.3mIDH1对体外U87细胞凋亡的影响 采用流式细胞术,转染成功的U87细胞传代培养24、48 h,适量0.25%的胰酶消化液消化细胞,收集细胞,室温,800 r/min离心5 min;再次重悬细胞并计数,室温,800 r/min离心5 min;弃去上清液,加入binding buffer 400 μL重悬细胞;加入Annexin V-RFP 5 μL,室温避光孵育15 min;30 min内检测(激发光波长545 nm,发射波长>575 nm)。
1.2.4TMZ对mIDH1过表达胶质瘤细胞凋亡的影响 采用流式细胞术,转染成功的U87细胞传代培养,加入0.25%胰酶消化、计数细胞,种入6孔培养板;按照0、50及100 mg/L的TMZ浓度计算需要补加入的培养基和TMZ溶液量,将二者混合后缓慢加入培养孔中,设置3个复孔,培养24 h;胰酶消化,收集细胞,加入binding buffer 400 μL,重悬细胞;加入Annexin V-RFP 5 μL,避光孵育15 min,30 min内检测(激发光波长采用545 nm,发射波长>575 nm)。
1.2.5TMZ对mIDH1过表达细胞凋亡相关蛋白表达的影响 采用Western blot法,转染成功的U87细胞细胞胰酶消化,离心收集,用50 mg/L的TMZ培养液重悬细胞并传代;培养24 h时,置于冰上,RIPA裂解液裂解15~30 min。收集细胞,超声粉碎,4 ℃ 12 000 r/min离心15 min;吸取上清液,蛋白定量分装保存。SDS蛋白质聚丙烯酰胺凝胶电泳及转膜,取待测蛋白样品40 μg上样,进行半干式法转膜,TBST漂洗PVDF膜,5%脱脂奶粉封闭2 h;加入封闭液稀释配制的一抗,4 ℃孵育过夜;分别加入以牛奶封闭的HRP标记的二抗(1 ∶5 000),室温孵育2 h;TBST溶液洗膜、显色,显影定影;凝胶成像系统扫描记录目的蛋白的表达强弱,用光密度表示,目的蛋白与β-actin比值来表示相对表达水平,全自动凝胶成像系统对结果拍照并分析。
1.2.6TMZ对裸鼠移植瘤凋亡相关蛋白表达的影响 采用免疫组织化学法,皮下注射法构建裸鼠移植瘤模型,计算裸鼠体表面积(S),S= 体型系数(0.06)×2/3体质量,根据裸鼠的体表面积及TMZ用药参考确定TMZ给药剂量,将TMZ用DMEM配成混悬液,按裸鼠体表面积每日灌胃给药,连续5 d,实验终末处死裸鼠,留取移植瘤标本,石蜡包埋,做5 μm石蜡组织切片、烘干、二甲苯及梯度酒精脱蜡, 3% H2O2浸泡,加入柠檬酸缓冲液暴露抗原结合位点,加一抗(利用PBS代替一抗作空白对照),4 ℃过夜,加入二抗,37 ℃孵育30 min,滴上适量的SABC,37 ℃孵育30 min,滴加显色剂,中性树胶封片,显微镜下观察瘤细胞内见棕黄色或者棕褐色颗粒为阳性细胞。按阳性细胞面积计分:不表达记0分、<10%记1分、10%~50%记2分、51%~80%记3分、>80%记4分,按着色强度计分:不表达记0分、弱表达记1分、中度表达记2分、强表达记3分;两者积分乘积为0表示阴性、>1为阳性、1~3表示弱阳性、4~7表示阳性、8~12为强阳性。
1.3 统计学方法
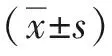
2 结果
2.1 mIDH1稳定转染U87细胞系构建
如图1所示,mIDH1基因稳定转染U87细胞后,经G418单克隆筛选,最终筛选出稳转细胞单克隆株,因目的基因与荧光报告基因有共同的启动子,故而目的基因得到稳定表达,荧光显微镜下可见稳定表达的EGFP荧光报告基因。
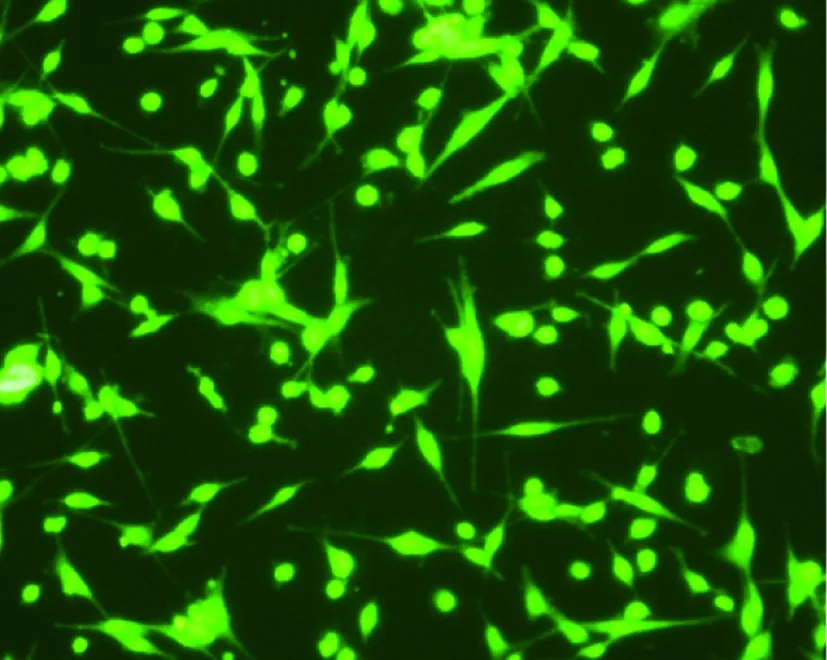
图1 U87稳定转染细胞内EGFP表达(40×)Fig.1 Expression of EGFP in U87 stable cell line
2.2 U87细胞凋亡率
如图2,将mIDH1、wIDH1及对照组稳定转染U78细胞常规培养进行细胞凋亡检测,结果显示,与对照组比较,mIDH1组细胞凋亡率无显著改变,经培养24 及48 h时3组细胞的细胞凋亡率均接近于1%,差异无统计学意义(P>0.05);因未检测到mIDH1/wIDH1对体外培养细胞的凋亡有明显影响,故未再对体内凋亡蛋白进行检测。
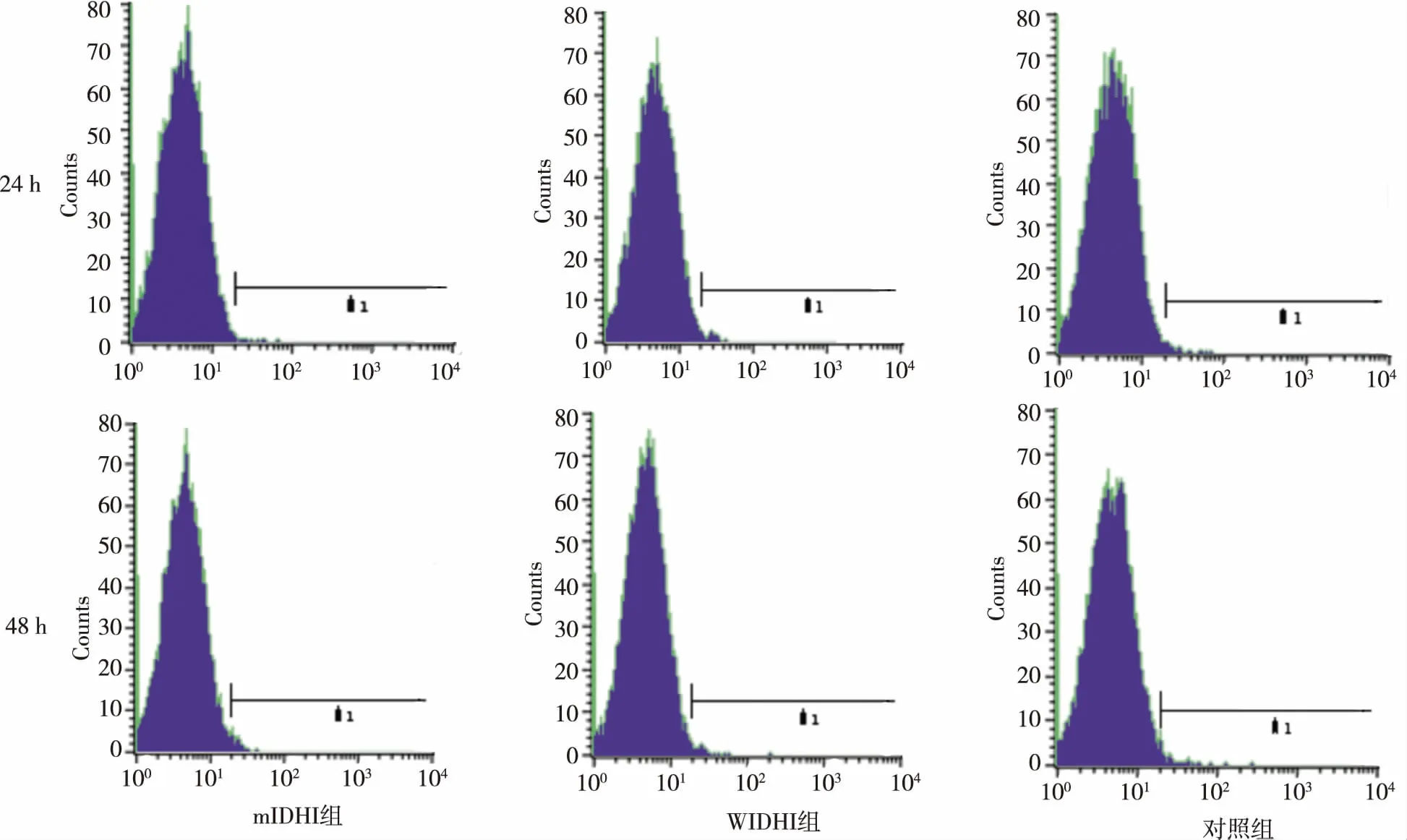
图2 3组U87细胞培养24 h及48 h的细胞凋亡率Fig.2 Apoptotic rate of the three cell line cultured for 24 hand 48 h
2.3 TMZ干预后U87细胞凋亡率
流式细胞检测结果显示, TMZ干预浓度为50 mg/L时,mIDH1过表达组U87细胞即表现出较高的凋亡率,且随TMZ浓度的升高,细胞凋亡比例升高,与其它两组比较,差异有统计学意义(P<0.05),wIDH1组细胞凋亡率显著低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 不同浓度TMZ 作用下三组细胞的凋亡率(%)Tab.1 The effect of different concentrations of TMZ on cellular apoptosis
注:(1)与对照组比较,P<0.05;(2)与 mIDH1组比较,P<0.05
2.4 TMZ干预后U87细胞Bcl-2、Bax、Caspase-3及Caspase-9蛋白表达
转染mIDH1、wIDH1及空载体的胶质瘤U87细胞经TMZ干预后,Western blot结果显示,与对照组比较,mIDH1组脑胶质瘤U87细胞的Bcl-2蛋白表达水平降低, Bax、Caspase-3及Caspase-9蛋白表达水平升高,wIDH1组脑胶质瘤U87细胞Bax、Caspase-3及Caspase-9蛋白表达水平降低,差异有统计学意义(P<0.05),Bcl-2则差异无统计学意义(P>0.05)。见图3、表2。
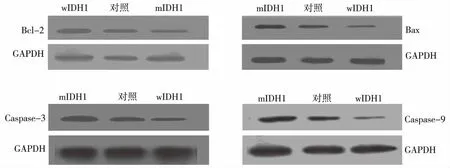
图3 TMZ干预后U87细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3及Caspase-9表达(Western blot)Fig.3 The effect of TMZ on the expression levels of apoptosis-associated proteins

组别细胞凋亡相关蛋白Bcl-2BaxCaspase-3Caspase-9对照组0.89±0.190.43±0.170.55±0.160.52±0.14mIDH1组0.33±0.14(1)0.88±0.21(1)0.83±0.24(1)0.69±0.14(1)wIDH1组0.92±0.21 (2)0.27±0.14(1) (2)0.26±0.15(1) (2)0.25±0.16(1) (2)
注:(1)与对照组比较,P<0.05;(2)与 mIDH1组比较,P<0.05。
2.5 TMZ干预后裸鼠移植瘤Bcl-2、Bax、Caspase-3及Caspase-9蛋白表达
免疫组织化学结果显示, mIDH1组移植瘤中Bcl-2蛋白表达水平显著低于对照组和wIDH1组,Caspase-9蛋白表达水平显著高于对照组和wIDH1组,差异有统计学意义(P<0.05);wIDH1组Bax、Caspase-3蛋白表达水平显著低于对照组和mIDH1组,差异有统计学意义(P<0.05)。见图4、表3。

图4 TMZ干预后移植瘤Bcl-2、Bax及Caspase-3表达(免疫组织化学法,×400)Fig.4 The effect of mutIDH1 expression on TMZ-mediated apoptosis-associated protein expression

组别细胞凋亡相关蛋白Bcl-2BaxCaspase-3Caspase-9对照组10.2±1.38.9±1.210.3±1.410.2±1.3mIDH1组3.5±0.6(1)9.8±1.210.7±1.63.5±0.6(1)wIDH1组10.5±1.4(2)2.8±0.4(1)(2)2.1±0.4(1)(2)10.5±1.4(2)
注:(1)与对照组比较,P<0.05;(2)与 mIDH1组比较,P<0.05。
3 讨论
肿瘤的形成是细胞增殖过度与细胞凋亡减少的累积效应[12],抗凋亡作用不仅在肿瘤的形成中起重要作用,而且与肿瘤的放化疗敏感性有着密切的关系[13]。细胞的凋亡调控是在凋亡与抗凋亡因素的共同作用下完成的,是一个多因素参与的复杂过程,调控基因分为凋亡基因和抗凋亡基因,前者如野生型p53、Bax、FAS/Apo-1、Bcl-xs等,后者如Bcl-2、Bcl-xl等。新生肿瘤的产生,往往伴随抗凋亡基因表达上调及凋亡基因表达的下调。Bcl-2是目前研究最深入的凋亡调控基因,属于抗凋亡基因[14],其功能蛋白定位于线粒体外膜、核膜和粗面内质网上,具有膜通透活性适配子双重功能[15]。
研究报道,上调抗凋亡因子的表达,可在一定程度上抑制过氧化物和自由基增加所诱导的细胞凋亡[16]。目前认为,Bcl-2/Bax比值决定细胞是否凋亡。在最近一项关于侵袭性垂体瘤的研究中发现Bcl-2下调与细胞凋亡增加有关,且Bcl-2、Bax的表达水平与Caspase-3、Caspase-9 的表达水平有关,在胶质瘤细胞系的相关研究中也有类似发现[17]。Caspase家族成员的激活是细胞凋亡过程中的重要事件[18]。Caspase-3是其中的一个关键酶,对许多蛋白的降解都起到了重要的参与作用,Caspase-9主要发生于凋亡起始期,由药物化疗激活,进而激活下游Caspase-3,导致凋亡。Bcl-2与Bax基因是凋亡调控的两个重要基因,Bcl-2的激活抑制细胞色素C的释放,从而抑制Caspase激活而抑制凋亡[19]。在细胞外凋亡途径中,死亡配体与受体,激活死亡信号,活化Caspase-8,细胞色素C释放或者通过直接作用于Caspase-3及其它下游Caspase活化凋亡途径。在细胞内途径中,细胞内的一切异常改变都可作为死亡通知信号,诱发细胞死亡,这些改变可导致线粒体释放细胞色素C与Caspase-9结合形成凋亡复合体而进一步被激活,其下游的Caspase-3等被激活而导致细胞凋亡。TMZ在体内转化为活性产物,导致DNA甲基化加成物的错配修复,发挥细胞毒作用,启动内源性凋亡途径[20]。
本研究发现,TMZ作用于体外胶质瘤细胞后,mIDH1组U87细胞Bcl-2表达下调,Bax、Caspase-3、Caspase-9表达均有不同程度的上调,其凋亡率较wIDH1组及对照组高,mIDH1通过改变凋亡相关蛋白的表达水平对TMZ的抗肿瘤效应起到了协同叠加作用,从而提高了化疗敏感性,这与调控Bcl-2水平增强化疗敏感性的文献报道相符[14]。而wIDH1组U87细胞Bcl-2表达有所上调,Bax、Caspase-3、Caspase-9表达均有不同程度的下调,与mIDH1组表现相反,在一定程度上表现出化疗抵抗性。同样,TMZ干预移植瘤模型后,mIDH1组移植瘤样本中Bcl-2的表达下调,Bax表达上调,Caspase-3及Caspase-9表达上调,在干预中表现出协同作用。wIDH1组则表现出一定的拮抗作用,究其原因可能是wIDH1通过正常的三羧酸循环维持良好的能量代谢水平及还原底物,避免细胞氧化损伤导致的凋亡[20]。而mIDH1通过异常代谢途径,不能为提供正常的细胞供能及抗氧化还原底物,以对抗过度的氧化应激,细胞微环境的改变导致内源途径激活,加之能量代谢不足,经典的MAPK和Akt途径中的Bad磷酸化不足,使Bad去磷酸化而活化,活化下游的Bax基因,促使细胞色素C的释放,最终诱发细胞凋亡。
综上,本研究发现mIDH1通过上调TMZ作用后U87细胞及裸鼠移植瘤组织的Caspase-3、Caspase-9、Bax表达、下调Bcl-2表达促进胶质瘤细胞凋亡,增强治疗敏感性,协同TMZ抗肿瘤,增加化疗敏感性,改善胶质瘤患者预后。

