EB病毒新近感染患者IgG类抗体实验室检测分析①
陈礼文 程 娟 王 秀 梁 伟 管世鹤
(安徽医科大学第二附属医院检验科,合肥230601)
EB病毒(Epstein barr virus,EBV)是一种嗜人类淋巴细胞的γ疱疹病毒,其原发感染导致淋巴系统和单核-巨噬细胞系统急性增生,同时病毒在记忆B淋巴细胞持续潜伏并可重新激活致再感染。我国EBV感染非常普遍[1],婴幼儿多为隐性感染,儿童(4~6岁高发)则主要表现为传染性单核细胞增多症,并增加成年后系统性红斑狼疮等多种自身免疫性疾病的发病风险[2]。EBV原发感染过程中首先产生VCA-IgM和VCA-IgG,前者是EBV新近感染标志;在急性感染晚期和恢复期晚期分别出现EA-IgG和NA-IgG,前者在原发感染和再感染均为一过性升高,后者可终生存在[3,4]。本研究探讨VCA-IgM+EBV新近感染患者NA-IgG、VCA-IgG和EA-IgG表达特点及其临床意义。
1 资料与方法
1.1研究对象 选取2016年2月至2018年5月在安徽医科大学第二附属医院检验科检测EBV抗体并且VCA-IgM阳性的住院和门诊患者160例,其中男93例,女67例,年龄分布8个月~64岁,中位年龄4.2岁。EBV感染诊断依据中华医学会儿科学分会感染学组和全国儿童EB病毒感染协作组发布的《儿童主要非肿瘤性EB病毒感染相关疾病的诊断和治疗原则建议》[5],综合临床和实验室指标确诊并排除慢性活动性EBV感染(CAEBV)病例。成人EB感染诊断主要依据临床表现、EB病毒DNA或抗体的检测结果并排除外其他感染和鼻咽癌病例。本研究经安徽医科大学第二附属医院伦理委员会批准,所有受试者均签署知情同意书。
1.2方法
1.2.1标本采集 入选病例血液标本置入惰性分离胶促凝管内,待充分凝固30 min后1 000 g离心15 min,收集血清标本待测。
1.2.2EBV抗体检测 VCA-IgM、VCA-IgG、NA-IgG和EA-IgG抗体检测在MAGLUMI2000全自动化学发光免疫分析仪(新产业生物)上进行,采用配套微粒子化学发光试剂盒,按照仪器和试剂说明书进行操作。血清样本用样本稀释液1∶11自动预稀释,采用低点和高点标准品,借助于由主曲线经两点定标而得到一条工作曲线,计算样本EBV抗体浓度,以AU/ml表示。每批样本检测前均进行质控品测定,确定其测量值在定值范围内并且符合Westgard质控规则。抗体浓度截断值(Cut-off)采用试剂说明书推荐标准:VCA-IgM为3 AU/ml,VCA-IgG、NA-IgG和EA-IgG均为2 AU/ml。
1.3统计学分析 VCA-IgG与EA-IgG浓度比较采用Mann-WhitneyU检验,数据以中位数(四分位间距)表示。NA-IgG、VCA-IgG和EA-IgG阳性率比较采用Pearsonχ2检验或连续校正卡方检验(当n≥40且有1≤理论频数<5时)。数据经统计软件SPSS 19.0加权处理并分析,以P<0.05为差异有统计学意义。
2 结果
2.1总体160例VCA-IgM+患者VCA-IgG、NA-IgG和EA-IgG阳性例数分布 均以2 AU/ml作为NA-IgG、VCA-IgG和EA-IgG抗体浓度的截断值,统计分析总体160例VCA-IgM+患者中IgG类抗体的阳性例数分布,见图1。NA-IgG、VCA-IgG和EA-IgG阳性例数分别为50例(31.25%)、91例(56.88%)和16例(10%),全阴性60例(37.5%),全阳性9例(5.63%)。其中NA-IgG、VCA-IgG和EA-IgG单阳性比例分别为8%(4/50)、47.25%(43/91)和31.25%(5/16)。160例VCA-IgM+患者中,NA-IgG和VCA-IgG、NA-IgG和EA-IgG以及VCA-IgG和EA-IgG双阳性例数分别为37例(23.13%)、0例(0%)和2例(1.25%)。另外,50例NA-IgG阳性患者中有46例(92%)VCA-IgG阳性,4例(8%)VCA-IgG阴性。
2.2VCA-IgM+/NA-IgG-和VCA-IgM+/NA-IgG+患者VCA-IgG与EA-IgG浓度与阳性率比较 依据《EB病毒感染实验室诊断及临床应用专家共识》[3],将EB病毒VCA-IgM+界定为EB病毒新近感染状态,VCA-IgM+/NA-IgG-界定为EB病毒原发感染早期/急性期;VCA-IgM+/NA-IgG+界定为原发感染恢复期或再感染,比较二类患者VCA-IgG与EA-IgG浓度与阳性率差异,分别见表1和表2。
2.3不同年龄段VCA-IgM+患者NA-IgG、VCA-IgG和EA-IgG阳性率比较 我国EBV原发感染高发年龄段为4~6岁[5],因此本研究统计分析160例VCA-IgM+患者中<7岁和≥7岁患者NA-IgG、VCA-IgG和EA-IgG抗体阳性例数(阳性率),并分别比较3种抗体阳性率差异,结果见表3。

图1 EB病毒IgG类抗体在160例VCA-IgM+患者中的例数分布Fig.1 Distribution of EB virus IgG antibodies in 160 patients with VCA-IgM+
表1 VCA-IgM+/NA-IgG-和VCA-IgM+/NA-IgG+患者VCA-IgG与EA-IgG浓度比较
Tab.1 Comparison of VCA-IgG and EA-IgG concentrati-ons between VCA-IgM+/NA-IgG-and VCA-IgM+/NA-IgG+patients

GroupsnVCA-IgG (AU/ml)EA-IgG (AU/ml)VCA-IgM+/NA-IgG-1101.27 (0.32-3.90)0.80 (0.50-1.35)VCA-IgM+/NA-IgG+5022.93 (7.26-50)0.76 (0.54-1.61)P value0.0001)0.5461)
Note:1)Mann-WhitneyUtest,the data are presented as median (interquartile range).
表2 VCA-IgM+/NA-IgG-和VCA-IgM+/NA-IgG+患者VCA-IgG与EA-IgG阳性率比较
Tab.2 Comparison of positive rates of VCA-IgG and EA-IgG between VCA-IgM+/NA-IgG-and VCA-IgM+/NA-IgG+patients

GroupsnVCA-IgGEA-IgGVCA-IgM+/NA-IgG-11045 (40.91%)7 (6.36%)VCA-IgM+/NA-IgG+5046 (92%)9 (18%)P value0.0001)0.0231)
Note:1)Pearsonχ2test.
表3 不同年龄段VCA-IgM+患者NA-IgG、VCA-IgG和EA-IgG阳性率比较
Tab.3 Comparison of positive rates of NA-IgG,VCA-IgG and EA-IgG between VCA-IgM+patients from two different age groups
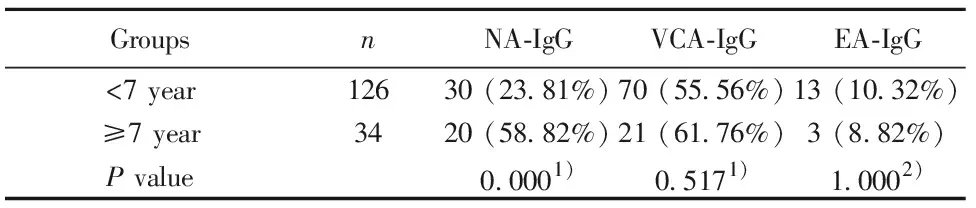
GroupsnNA-IgGVCA-IgGEA-IgG<7 year12630 (23.81%)70 (55.56%)13 (10.32%)≥7 year3420 (58.82%)21 (61.76%)3 (8.82%)P value0.0001)0.5171)1.0002)
Note:1)Pearsonχ2test;2)Continuity correction forχ2(Yates′ correction).
3 讨论
不同患者感染EBV后到实验室检测抗体的时间间隔存在较大差异,并且EBV抗体随着感染病程的进展此消彼长,不同抗体都有其独特的动力学特点和窗口期,这为探索EBV抗体表达规律带来一定的困扰和难度。如VCA-IgM在患者出现临床症状时即可出现,但持续时间仅为4~8周;EA-IgG在急性感染晚期(发病后3~4周)出现,持续3~6月后消失;VCA-IgG稍晚于VCA-IgM出现,其与恢复期晚期(5~6周)才出现的NA-IgG均可终生存在[3,4]。本研究选择门诊或住院的EB病毒VCA-IgM+患者160例,分析NA-IgG、VCA-IgG和EA-IgG等IgG类抗体表达,结果显示NA-IgG、VCA-IgG和EA-IgG阳性例数分别为50例(31.25%)、91例(56.88%)和16例(10%)。其中NA-IgG阳性率远低于文献报道的EBV感染患者和健康人群(均超过90%)[1,6],EA-IgG阳性率也低于朱耀武等[6]在EB病毒相关疾病中报道的42.0%,略高于健康对照人群(7.5%)。NA-IgG和EA-IgG阳性率较其他研究偏低可能与本研究所选择的研究对象有关:VCA-IgM+新近感染患者大多为儿童(中位年龄4.2岁),是EB病毒原发感染的高发年龄段,而且抗体检测时间大多处于EBV原发感染的早期/急性期,此时尚未产生EA-IgG和NA-IgG或浓度较低达不到检测限值。并且,本研究中单独VCA-IgM阳性,NA-IgG、VCA-IgG和EA-IgG全阴性病例达到60例(37.5%),进一步表明研究对象大多处于EBV原发感染的早期/急性期,是导致NA-IgG和EA-IgG阳性率低于其他研究的主要原因。而VCA-IgG阳性率与王晓亮等[7]在儿童传染性单核细胞增多症(IM)报道的57.06%(97/170)较为接近,但低于马闪珊等[8]报道的86.8%阳性率。需要指出的是,以上抗体阳性率差异也可能与各实验室所使用的试剂和检测方法差异有关。
在EBV原发感染过程中VCA-IgG紧随VCA-IgM出现,一般早于NA-IgG并可持续存在,与NA-IgG一起作为EBV既往感染的标志。但本研究50例NA-IgG阳性患者中有4例(8%)出现VCA-IgG阴性。究其原因,有以下两种可能:①微粒子化学发光免疫法相较于传统酶免疫测定法敏感性和特异性均有较大提高,但在NA-IgG和VCA-IgG检测中仍存在一定的假阳性和假阴性[9]。Guerrero-Ramos等[10]使用线性免疫分析技术(Line immunoassays,LIA)作为参考检测标准(Reference standard),在58例经参考标准检测归类为原发EBV感染的患者(VCA-IgM阳性/弱阳性,NA-IgG阴性/弱阳性和VCA-IgG阳性/弱阳性)中有6例(10.34%)使用磁微粒化学发光法未检出VCA-IgG阳性;②与EBV感染后血清学反应的个体差异有关。文献报道EBV抗体表达规律复杂多样,例如5%~10%健康个体感染EBV后并不出现NA-IgG抗体,在免疫功能低下人群NA-IgG阴性比例更高[11];在有的EBV既往感染个体中,采用基因重组免疫印迹RecomLine法不能检测出VCA-IgG表达[12]。
EA-IgG在EBV感染中的诊断价值尚有争议[13]。本研究依据《EB病毒感染实验室诊断及临床应用专家共识》[3],将VCA-IgM+/NA-IgG-界定为EB病毒原发感染早期/急性期;VCA-IgM+/NA-IgG+界定为原发感染恢复期或再感染,分析比较两类患者EA-IgG浓度(中位数)分别为0.80 (四分位间距0.50~1.35) AU/ml和0.76 (四分位间距0.54~1.61) AU/ml(P=0.546);EA-IgG阳性率分别为6.36%和18%(P=0.023)。以上结果提示虽然EBV原发感染恢复期或再感染患者的EA-IgG阳性率显著高于原发感染早期/急性期患者,但其浓度升高幅度不大,导致浓度之间无显著差异。另一方面,两类患者VCA-IgG浓度(中位数)分别为1.27 (四分位间距0.32~3.90) AU/ml和22.93 (四分位间距7.26~50) AU/ml(P=0.000),VCA-IgG阳性率分别为40.91%和92%(P=0.000),提示VCA-IgG在鉴别原发感染早期/急性期和原发感染恢复期或再感染中的显著作用,与EA-IgG形成鲜明对比。
儿童非肿瘤性EBV原发感染疾病主要为IM,国内儿童IM发病的高峰年龄为4~6岁[5]。因此本研究比较了<7岁(126例)和≥7岁(34例)VCA-IgM+患者IgG类抗体的阳性率差异。结果显示<7岁和≥7岁患者的NA-IgG阳性例数分别为30例(23.81%)和20例(58.82%)(P=0.000);VCA-IgG阳性例数分别为70例(55.56%)和21例(61.76%)(P=0.517);EA-IgG阳性例数分别为13例(10.32%)和3例(8.82%)(P=1.000)。其中与年龄相关的NA-IgG阳性率差异与Xiong等[1]对1 778 例0~10岁健康儿童进行的流行病学调查结论基本一致,因为NA-IgG是EBV既往感染的主要标志物,阳性率随着年龄的增加而逐步提高。虽然VCA-IgG阳性率也与年龄相关[1],但本研究显示<7岁和≥7岁年龄组之间VCA-IgG阳性率差异无显著意义,可能与VCA-IgG在EBV原发感染过程中出现较早且持续存在有关。而研究对象的特性(VCA-IgM+早期/急性期患者)和EA-IgG表达特点(出现迟、消失快)导致EA-IgG阳性率与年龄无关。
总之,本研究对EBV VCA-IgM+新近感染患者的NA-IgG、VCA-IgG和EA-IgG抗体实验室检测结果进行分析,结果表明IgG类抗体在EBV新近感染患者具有显著的分布特征,联合检测EBV抗体有助于EB新近感染的实验室确诊以及感染时相判断,从而裨益于EBV感染的基础研究与临床诊治。

