芦荟素抑制p65的磷酸化对大鼠脑缺血再灌注诱导的组织损伤和炎症的调节作用①
赵 杨 孙 波 杜书章
(郑州大学第五附属医院药学部,郑州450000)
脑缺血再灌注(CIRI)是脑组织血流供应突然中断后再灌注,可引起严重的神经功能障碍,在临床上给患者及家人的生活带来了严重的危害[1]。已有研究表明,CIRI早期诱发的炎症反应是造成脑组织继发性损伤的重要原因,会激活机体一系列的病理级联反应[2]。因此,有效控制机体炎症反应是保护脑组织不受损伤的关键。芦荟是我国传统中药,已有2000多年的药用历史,其常用的药用成分包括芦荟素、芦荟苷、芦荟多糖、芦荟大黄素等,具有抗氧化、抗炎、调节机体免疫功能等多种药理作用[3]。芦荟素(Aloin)是芦荟的主要成分,具有抗菌、抗炎、抗癌、抗衰老等作用[4]。近年来已有研究者证实,Aloin具有很好的抗炎效用,可以调节多种炎症因子的表达,但临床上对Aloin在CIRI中的应用尚未见报道[5]。因此,本研究建立了大鼠缺血再灌注模型,旨在分析Aloin保护大鼠CIRI损伤的具体作用机制,为临床应用提供一定的依据。
1 材料与方法
1.1仪器、试剂与动物 SPF级SD雄性大鼠64只,体重250~280 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2017-0022,饲养于本院动物中心实验室,保持室温恒定为25℃,模拟昼夜每12 h更换一次光照条件,动物自由摄食与饮水。芦荟素购自中国药品制品生物检定所,批号0852-9902;白介素(IL)-6和IL-10酶联免疫吸附(ELISA)试剂盒购自武汉博士德生物工程有限公司;细胞黏附分子-1(ICAM-1)抗体购自北京中山生物技术有限公司;兔抗人p-NF-κB p65、NF-κB p65、肿瘤坏死因子(TNF-)α、Caspase-3和Caspase-9单克隆抗体购于美国Santa Cruz公司;辣根过氧化物酶(HRP)标记羊抗兔IgG,购于DAKO公司。
1.2方法
1.2.1动物造模及给药 大鼠预饲养1周后,将64只SD大鼠随机分为对照组、Aloin组、MCAO组和Aloin+MCAO组各16只。MCAO组和Aloin-MCAO组大鼠采用Longa法制备动物脑中动脉缺血再灌注(MCAO)模型[6],以6 ml/kg 5%水合氯醛腹腔内注射麻醉,于颈部行纵行切口,用长6 cm、直径0.26 mm尼龙线于近心端结扎脑中动脉,并缝合,缺血2 h后拔出栓线实现再灌注;对照组和Aloin组仅暴露脑中动脉,插入栓线约10 mm,不进行结扎。若术后24 h内,MCAO组和Aloin-MCAO组出现神经缺损症状,则为造模成功[6]。造模成功后,Aloin组和Aloin-MCAO组腹腔注射Aloin 50 mg/kg,连续7 d;MCAO组和对照组腹腔注射等量生理盐水。于治疗后处死大鼠,迅速断头取脑,无菌取脑皮层及海马组织。
1.2.2各组大鼠存活率和神经病学评分 检测10 d 内大鼠存活率,参照Zea Longa 5分制标准[7]对各组大鼠进行神经病学评分。
1.2.3HE染色和TUNEL法检测各组大鼠脑组织损伤 处死大鼠,取大鼠脑组织,采用4%多聚甲醛固定,进行常规脱水、透明、包埋和切片。一份切片进行HE染色,在光镜下观察组织的病理变化,每张切片随机取5个视野拍照。另一份切片严格按照TUNEL试剂盒说明操作染色,置于荧光显微镜下观察,采用ImageJ对图像进行分析处理,每张图像随机选取10个视野用以计算阳性细胞数与总细胞数,计算细胞凋亡率,细胞凋亡率=阳性细胞数/总细胞数×100%。
1.2.4Western blot检测NF-κB p65信号通路相关蛋白的表达 取对数生长期神经元细胞,使用细胞裂解液严格按照蛋白裂解步骤提取总蛋白,Lowry法蛋白定量,依次SDS-PAGE凝胶电泳,电转膜至PVDF膜、室温密封2 h,洗膜并加一抗4℃孵育过夜,洗膜加二抗室温孵育2 h。再用ECL化学发光显示,收集影像,通过积分吸光度(Integrated absorbance,IA)值分析对比条带强弱,选用β-actin作为内参,采用半定量分析。
1.2.5脑组织中相关因子的测定 取之前制作的切片,进行免疫组化染色,检测脑组织ICAM-1的表达量。取脑组织,匀浆,离心(3 500 r/min,10 min),取上清,用ELISA法测定IL-6、IL-10的表达水平,严格按试剂盒说明书进行测定。

2 结果
2.1Aloin对CIRI大鼠神经功能和存活率的影响 与对照组相比,Aloin组大鼠存活率和神经功能缺损评分均无显著差异(P>0.05),MCAO组大鼠存活率显著下降(P<0.05),神经功能缺损评分显著升高(P<0.05);与MCAO组相比,Aloin-MCAO组大鼠存活率显著升高(P<0.05),神经功能缺损评分显著下降(P<0.05),见图1。
2.2Aloin对CIRI大鼠脑组织损伤和凋亡的影响 HE染色结果显示,对照组和Aloin组大鼠脑组织未见明显病理变化,脑组织细胞结构完整,未见炎性细胞浸润;MCAO组大鼠脑组织缺血区皮质出现水肿,胞间隙变宽,结构较疏松,空泡样改变明显,细胞核固缩深染,核仁消失,伴随大量炎性细胞浸润;Aloin-MCAO组大鼠脑缺血区皮质病理损伤减轻,间质水肿程度减轻,细胞排列较整齐,缺血区变性和坏死的神经元数量明显减少。TUNEL染色显示,与对照组相比,Aloin组大鼠脑组织细胞凋亡率无显著差异(P>0.05),MCAO组大鼠脑组织细胞凋亡率显著升高(P<0.01);与MCAO组相比,Aloin-MCAO组脑组织细胞凋亡率显著下降(P<0.01),见图2。
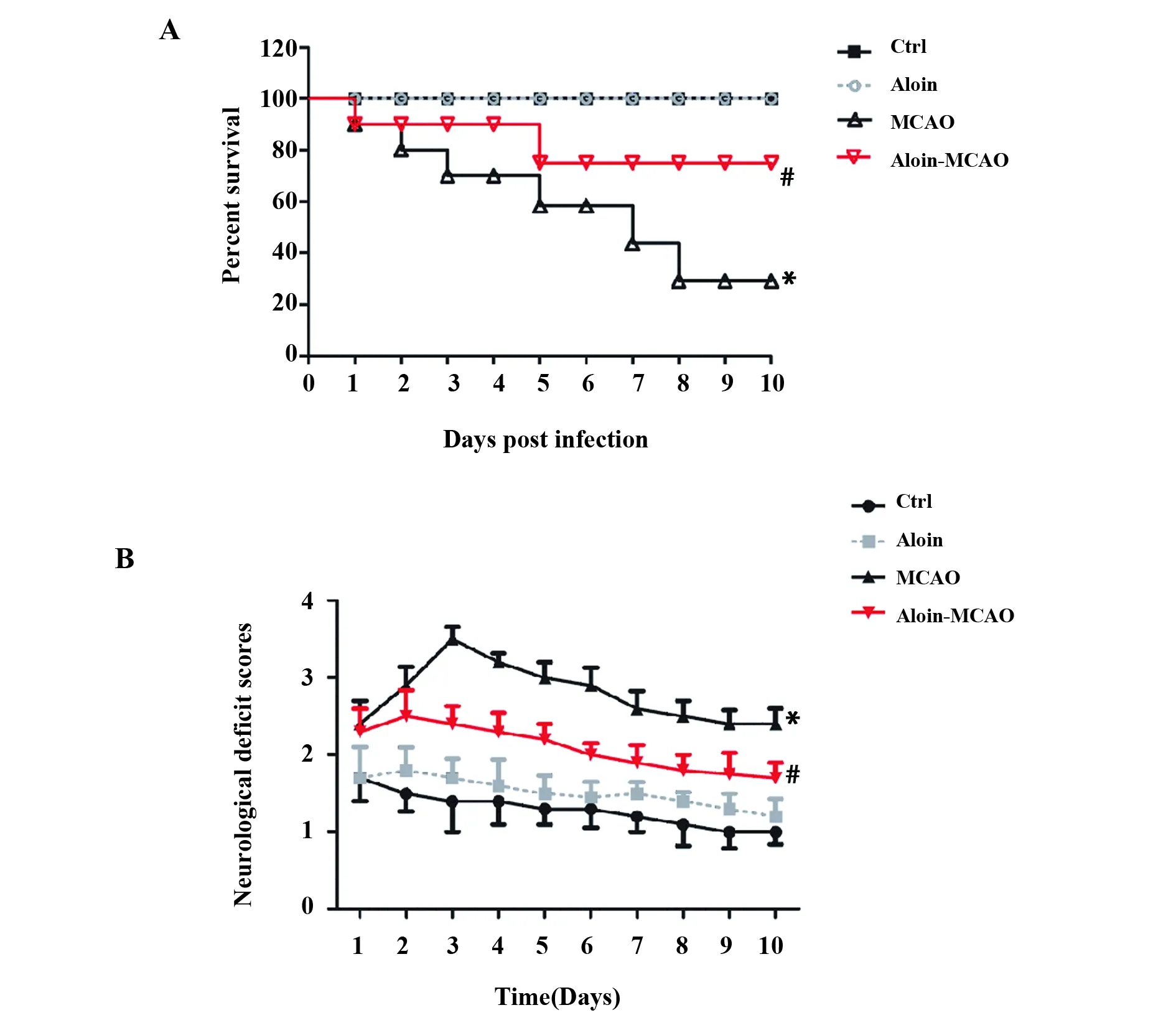
图1 各组大鼠的存活率和神经功能评分Fig.1 Survival rate and neurological function score in each groupNote: Compared with control group,*.P<0.05;compared with MCAO group,#.P<0.05.
2.3Aloin对CIRI大鼠脑组织凋亡标记分子Caspase-3和Caspase-9表达的影响 与对照组相比,Aloin组大鼠脑组织Caspase-3和Caspase-9的表达无显著差异(P>0.05),MCAO组大鼠脑组织Caspase-3和Caspase-9的表达显著上调(P<0.01);与MCAO组相比,Aloin-MCAO组脑组织Caspase-3和Caspase-9的表达显著下调(P<0.01),见图3。
2.4Aloin对CIRI大鼠脑组织ICAM-1、IL-6和IL-10表达的影响 与对照组相比,Aloin组大鼠脑组织ICAM-1、IL-6和IL-10的表达无显著差异(P>0.05),MCAO组大鼠脑组织ICAM-1和IL-6的表达显著升高(P<0.01),IL-10的表达无显著差异(P>0.05);与MCAO组相比,Aloin-MCAO组脑组织ICAM-1和IL-6的表达显著下降(P<0.01),IL-10的表达显著升高(P<0.01),见图4。
2.5Aloin对CIRI大鼠脑组织NF-κBp65磷酸化及下游靶基因TNF-α表达的影响 与对照组相比,Aloin组大鼠脑组织p-NF-κBp65/NF-κBp65和TNF-α的表达无显著差异(P>0.05),MCAO组大鼠脑组织p-NF-κBp65/NF-κBp65和TNF-α的表达显著上调(P<0.01);与MCAO组相比,Aloin-MCAO组脑组织p-NF-κBp65/NF-κBp65和TNF-α的表达显著下调(P<0.01),见图5。
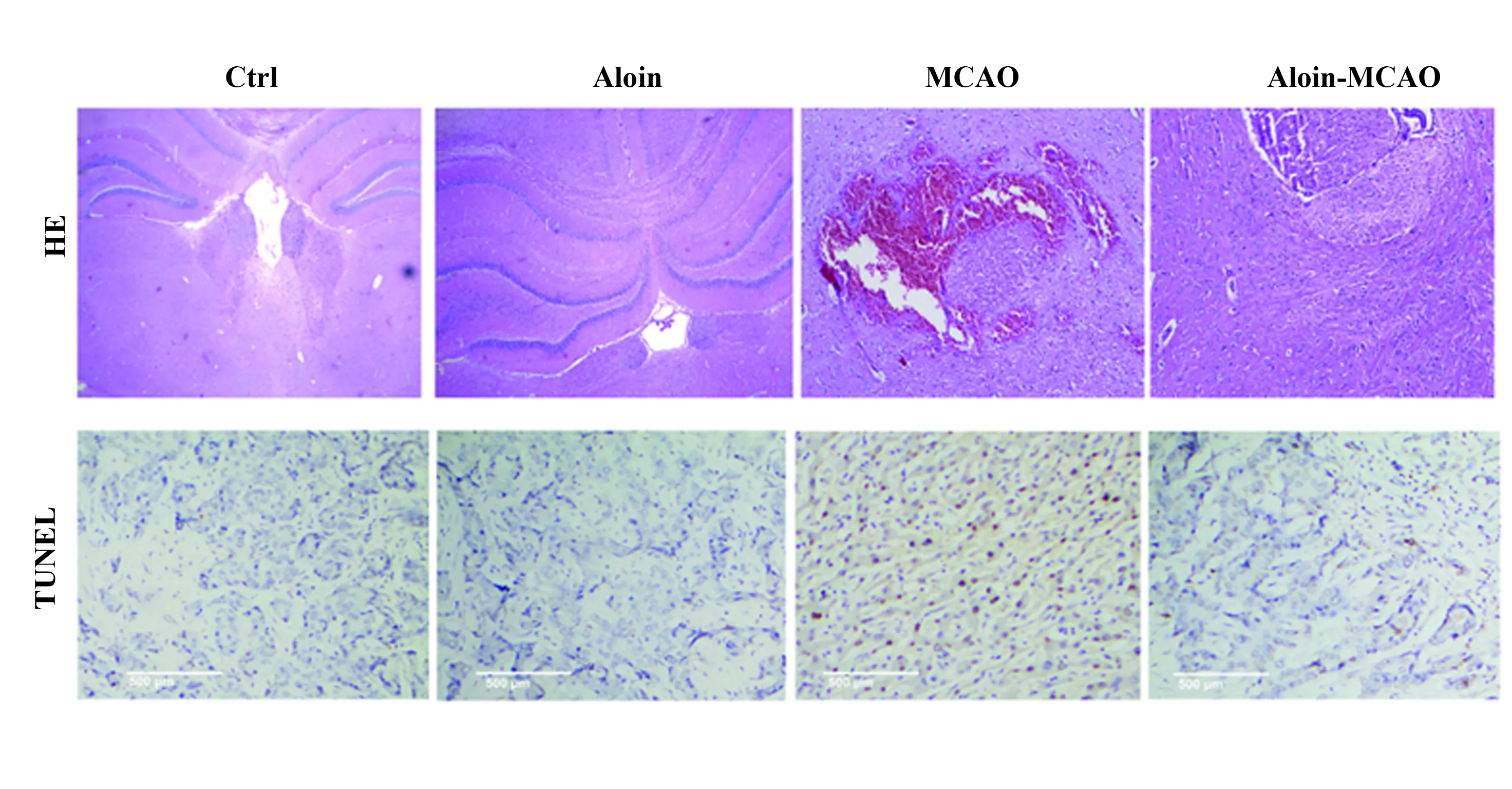
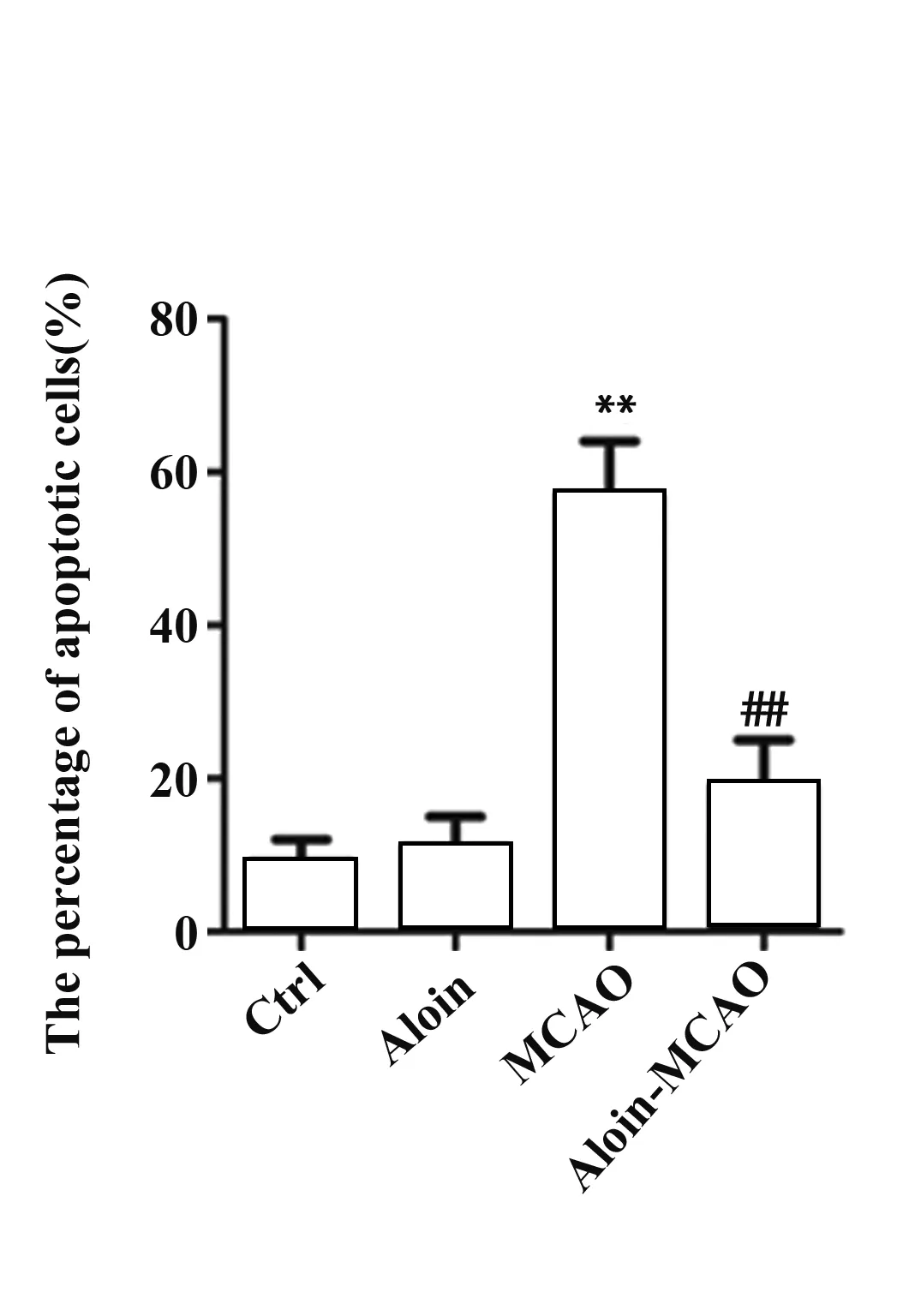
图2 各组大鼠脑组织损伤和凋亡
Fig.2 Brain tissue damage and apoptosis in each group
Note: Compared with control group,**.P<0.01;compared with MCAO group,##.P<0.01.

图3 各组大鼠脑组织凋亡标记分子Caspase-3和Caspase-9的表达Fig.3 Expression of apoptosis marker molecules Caspase-3 and Caspase-9 in brain tissues in each groupNote: Compared with control group,**.P<0.01;compared with MCAO group,##.P<0.01.
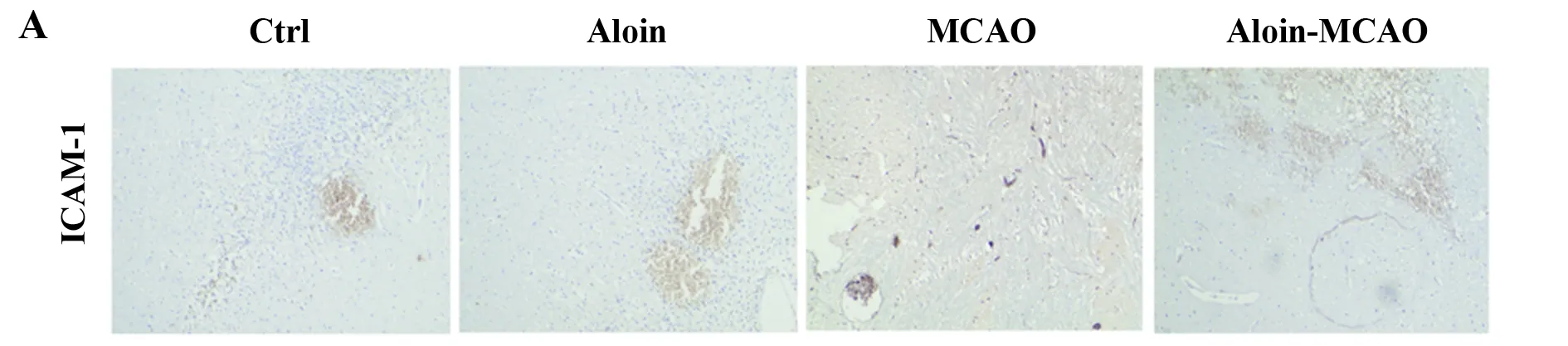
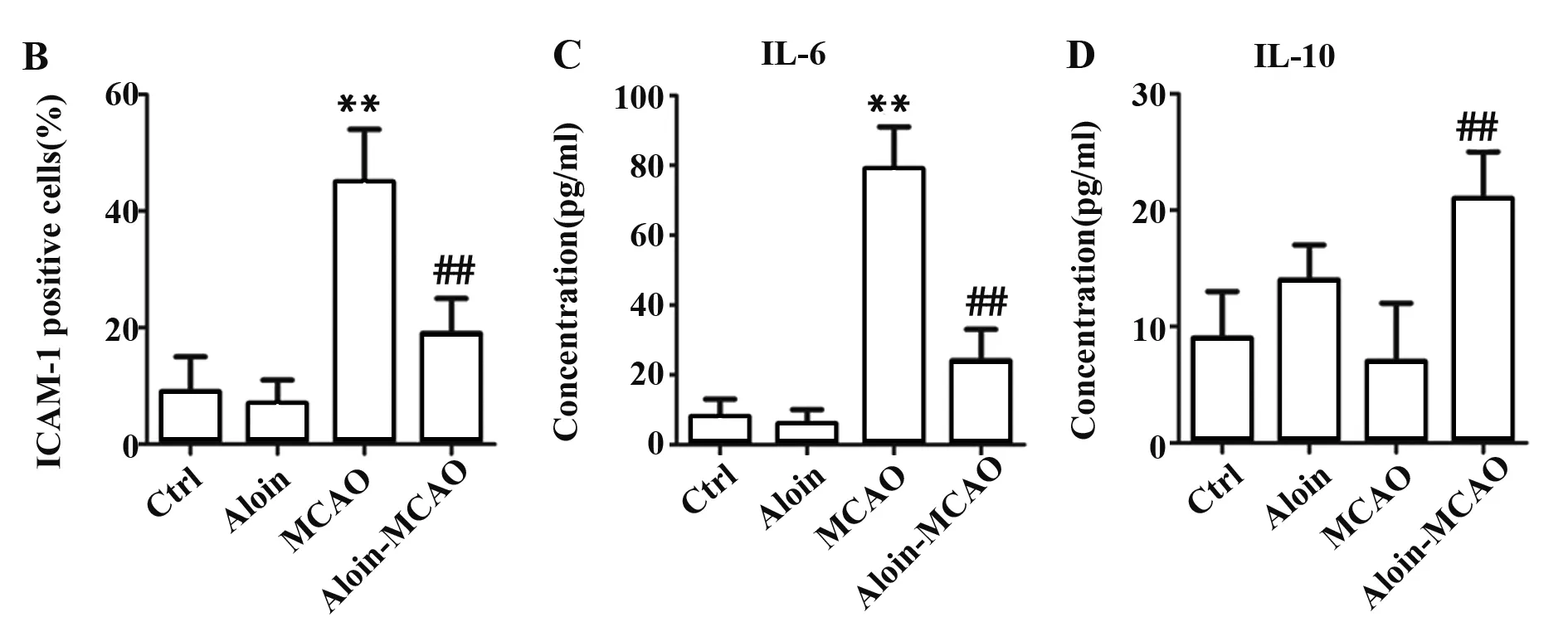
图4 各组大鼠脑组织ICAM-1、IL-6和IL-10的表达
Fig.4 Expression of ICAM-1,IL-6 and IL-10 in brain tissues in each group
Note: Compared with control group,**.P<0.01;compared with MCAO group,##.P<0.01.
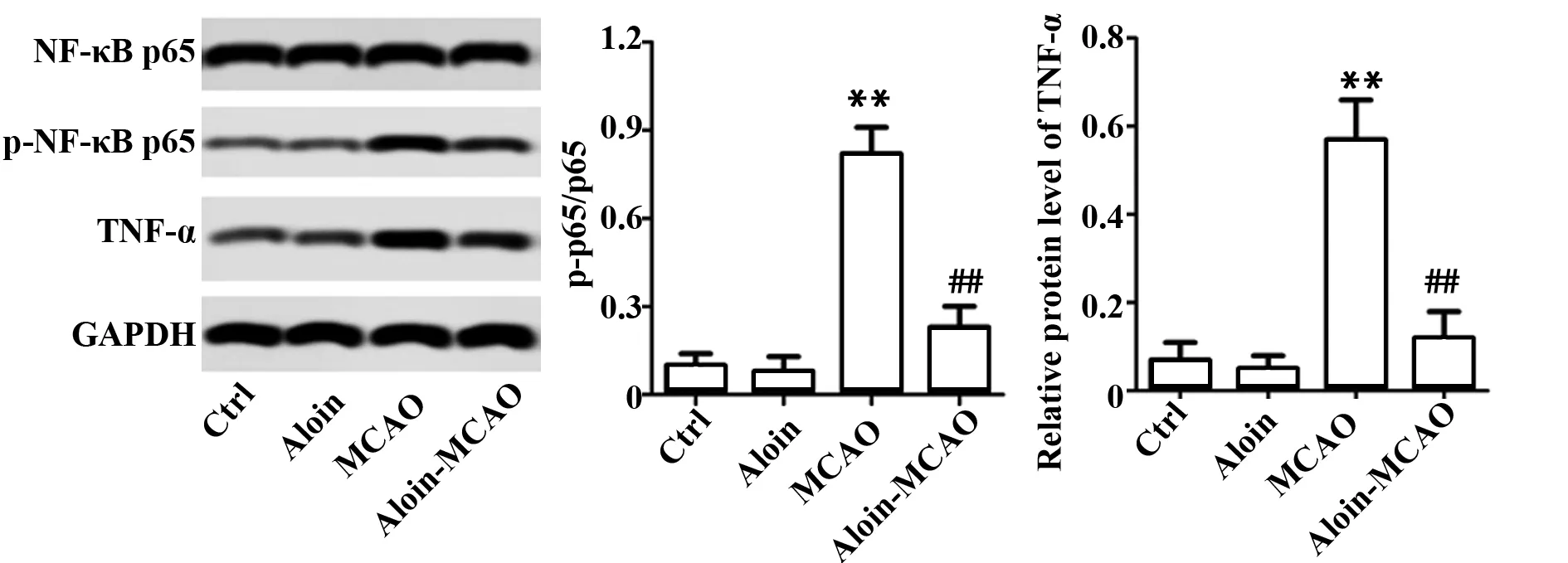
图5 各组大鼠神经元细胞JNK/p38 MAPK信号及其下游凋亡相关蛋白的表达Fig.5 Expression of JNK/p38 MAPK signal and its downstream apoptosis-related proteins in rat neuronal cellsNote: Compared with control group,**.P<0.01;compared with MCAO group,##.P<0.01.
3 讨论
CIRI主要是由于脑缺血一定时间血液再灌注后,导致的结构损伤和功能障碍[8]。已有多项研究表明,炎症反应是CIRI损伤的主要病理机制之一,会引起一系列病理反应[9,10]。Aloin是芦荟的主要活性成分,现代药理学研究表明,其具有抗肿瘤、抗菌、抗炎等药理作用[11]。Chang等[12]的研究表明,芦荟素可以降低氧糖剥夺/复氧引起的过高的氧化应激水平,抑制细胞凋亡,保护神经细胞损伤。本研究发现Aloin可以显著改善CIRI大鼠的神经功能,提高存活率,提示Aloin可以保护CIRI大鼠的神经功能。Palencia等[13]的研究表明,CIRI后高水平的炎症反应、氧化应激、蛋白酶激活等均会诱导细胞凋亡。本研究发现,CIRI大鼠脑组织缺血区出现明显病变,伴随大量炎性细胞浸润,并出现细胞凋亡,经Aloin治疗后,病变明显减轻,脑组织细胞凋亡率显著降低,提示Aloin能抑制脑组织细胞凋亡,改善CIRI大鼠脑组织损伤。
已有研究发现,CIRI早期机体的氧自由基、前炎症细胞因子(如IL-1β、TNF-α)等多种因素可特异性激活NF-κB,激活的NF-κB进入胞核与靶序列结合,可以促进IL-6、IL-8、TNF-α、ICAM-1等炎性细胞因子的表达,加重脑组织损伤[14]。IL-6是一种主要由单核-巨噬细胞分泌的前炎症因子,可促进多种炎症因子的生成,在继发性脑损伤中发挥重要作用[15]。IL-10是一种炎性抑制因子,能全面抑制炎性细胞因子IL-6、IL-1等受体的表达,减轻组织损伤[16]。ICAM-1为脑损伤后的主要促炎性因子,CIRI后ICAM-1即可与白细胞上的巨噬细胞活化趋化因子-1(Mac-1)和淋巴细胞功能相关抗原-1(LFA-1)结合,使大量白细胞与微血管内皮细胞发生黏附,导致再灌注损伤[17]。黄小平等[18]的研究表明,CIRI小鼠NF-κB被激活,脑组织 TNF-α、IL-1β、ICAM-1等炎症因子具有高表达。Luo等[19]的研究表明,Aloin可以抑制NF-κB信号通路,抑制脂多糖诱导的炎症反应和细胞凋亡。本研究发现Aloin可以降低CIRI大鼠脑组织中高表达的ICAM-1和IL-6,升高CIRI大鼠脑组织中低表达的IL-10,从而降低机体的炎症因子水平,与上述研究一致,提示Aloin可以改善CIRI大鼠的炎症反应。
已有研究表明,CIRI后NF-κB信号通路被激活,NF-κB/p65被释放,进而促进下游多种黏附分子、炎症因子等表达,过表达的这些细胞因子均可反馈性加重CIRI损伤[20]。杨擎等[21]的研究表明,激活NF-κB可以上调下游靶基因TNF-α的表达,激活细胞凋亡的级联反应,诱导细胞凋亡。TNF-α主要由巨噬细胞和T淋巴细胞产生,是一种能直接造成肿瘤细胞死亡的细胞因子,参与脑缺血后的多种病理反应,包括脑水肿、血脑屏障损伤、炎症反应、细胞凋亡等[22]。Li等[23]的研究表明,TNF-α可以激活NF-κB p65和凋亡基因Bax的转录,一旦NF-κB p65沉默后,则可以抑制TNF-α诱导的细胞凋亡。Carotenuto等[24]的研究表明,TNF-α可以调控凋亡相关蛋白Bcl-2/Bax和Caspase-3的表达,调控细胞凋亡。Caspase家族是凋亡执行分子,活化的Caspase可以降解细胞内的重要蛋白,诱导细胞凋亡[25]。Lee等[26]的研究表明,Aloin可以诱导非小细胞肺癌细胞的细胞周期阻滞、细胞凋亡和自噬。本研究发现,Aloin可以下调CIRI大鼠脑组织中高表达的磷酸化和非磷酸化的NF-κB p65、TNF-α、Caspase-3和Caspase-9,抑制细胞凋亡,提示Aloin可能通过抑制NF-κB p65的磷酸化,抑制下游靶基因TNF-α的表达,从而抑制TNF-α所诱导的凋亡蛋白Caspase-3和Caspase-9的表达。
综上所述,Aloin可以抑制NF-κB p65的磷酸化,抑制下游靶基因TNF-α的表达,抑制凋亡蛋白Caspase-3和Caspase-9的表达,降低CIRI大鼠体内过高的炎症反应,有效改善CIRI大鼠的神经功能,提高CIRI大鼠的存活率,为临床上Aloin治疗CIRI提供一定的理论依据。

