高脂饮食诱导青春期前雌性大鼠多囊卵巢综合征的实验研究
古兰·托合提木拉提,叶尔努尔·吐苏甫汗,马玉兰,玛依努尔·尼亚孜
(1.新疆自治区人民医院,新疆 乌鲁木齐 830001;2.新疆医科大学第二附属医院, 新疆 乌鲁木齐 830028)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是女性不育不孕的主要病因之一[1]。为研究PCOS 病因及其发病机制,目前已经复制了多种PCOS动物模型,但这些模型均未能全面反映PCOS 患者常见的卵巢形态、功能及代谢特征变化[2-4]。本研究拟探讨高脂饮食(high-fat diet,HFD)对青春期前大鼠卵巢形态、功能、胰岛素敏感性和激素水平的影响。现报道如下。
1 材料与方法
1.1 实验动物
SPF 级SD 雌性大鼠18 只,8 ~10 周龄,体重200 ~250 g;SPF 级SD 雌性大鼠18只,3 ~4 周龄,体重45 ~55 g,均购于新疆医科大学实验动物中心[许可证号:SYXK(新)2013-0002]。饲养温度(22±2)℃,相对湿度(55±5)%,12 h 昼夜交替,清洁饲养,自由饮水,环境安静,饲养环境符合SPF 要求。
1.2 试剂与仪器
普通颗粒饲料(100%基础饲料,含65%碳水化合物、21.5%蛋白质、4%脂肪及9.5%其他)和高脂肪饲料(50%基础饲料、17%猪油、19%豆油、6%蔗糖、6%酪蛋白及2%其他,含36%碳水化合物、20%蛋白质、40%脂肪及4%其他)购自新疆医科大学实验动物中心。来曲唑购自江苏恒瑞医药股份有限公司(批号:15011956,国药准字H19991001),羧甲基纤维素钠购自美国Sigma 公司(批号1002004856),Trizol 试剂购自美国英杰生命技术有限公司,ACS-1.51A 电子秤购自上海友声衡器有限公司,XS205 分析天平购自瑞士梅特勒-托利多仪器(上海)有限公司,血糖仪购自德国罗氏诊断有限公司,全自动生化分析仪购自美国Beckman 公司,ABI-7900 实时荧光定量PCR 仪购自美国ABI Biosystem 公司。
1.3 方法
1.3.1 动物分组及模型复制 PCOS 阳性对照:将8 ~10 周龄SD 大鼠随机分为A组和B组,各9 例。A组作为B组的对照,A组和B组采用普通颗粒饲料喂养21 d,A组每日同时灌胃1%羧甲基纤维素(LET溶解剂),B组每日同时灌胃1%羧甲基纤维素+来曲唑[1 mg/(kg·d)][5]。
PCOS 实验对照:将3 ~4 周龄SD 大鼠随机分为C组和D组,各9 例。C组为D组的对照,采用普通颗粒饲料连续喂养105 d;D组则采用高脂饲料连续喂养105 d[6]。
1.3.2 大鼠体重及动情周期监测 每日称4组大鼠体重并记录。A组和B组于第14 ~21 天,C组和D组于第42 ~49 天、第70 ~77 天及第98 ~105 天每只大鼠进行阴道涂片检查,用生理盐水(0.9%氯化钠NaCl)清洗阴道,收集阴道壁上的细胞并涂抹在玻片上。在显微镜下检查玻片上的有核上皮细胞、角化上皮细胞和白细胞的相对丰度,观察大鼠动情周期 变化。
1.3.3 糖耐量试验、胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)及胰岛素敏感检测指数 ①糖耐量试验:禁食过夜后,次日空腹采尾静脉血,测定空腹血糖(fasting blood glucose,FBG),随后以葡萄糖2 g/kg 灌胃大鼠,在0、30、60 和120 min 后通过尾静脉取血,测定血糖值。采用Med Calc 11.4.1.0 统计软件分析曲线下面积(area under the curve,AUC)[7]。②HOMA-IR:采用放射免疫法检测空腹胰岛素(fasting insulin,FINS),HOMAIR=FINS×FBG/22.5。③定量胰岛素敏感性检测指 数=1/[log(FBG)+log(FINS)][7]。
1.3.4 血清血脂及性激素检测 禁食过夜后,次日空腹采尾静脉血检测血清总胆固醇(total cholesterol,TC)和甘油三酯(Triglycerides,TG)。采用放射免疫法测定促黄体生成激素(Luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)、雌二醇(Estradiol,E2)、孕酮(Progesterone,P)及睾酮(Testosterone,T)。
1.3.5 LH 受体(luteinizing hormone receptor,LHR)及FSH受体(follicle stimulating hormone receptor,FSHR) mRNA 表达处死大鼠并分离卵巢。采用Trizol 试剂提取卵巢细胞总RNA。逆转录聚合酶链反应将总RNA 逆转录成cDNA。采用实时荧光定量PCR反应检测LHR和FSHR mRNA表达。LHR正向引物:5’-TCCGTGGACTCCCAAACA-3’,反向引物:5’-ATCGTGGCGATCAGCGTA-3’。FSHR 正向引物:5’-ACTGTGCATTCAACGGAA-3’,反向引物:5’-GCCTCCATGAGGGTGACA-3’。β-actin正向引物:5’-CTGGAGAAGAGCTATGAGCTGCCTG-3’,反向引物:5’-AGGAAGGAAGGCTGGAAGAGAGCCT-3’。以2-△△Ct法计算。
1.3.6 卵巢重量及组织学检查 A组和B组于第21天,C组和D组于第105 天,处死大鼠并分离卵巢,称取卵巢重量后,以卵巢最大平面作为待检面,将其包埋在石蜡中,切成4 ~5μm 厚的切片,用苏木精-伊红染色后观察。
1.4 统计学方法
数据分析采用Graph pad Prism 6 和Med Calc 11.4.1.0 统计软件。计量资料以均数±标准差(±s)表示,比较用配对t检验或重复测量设计的方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组体重增长情况
A组和B组0、7、14 及21 d 体重比较,采用重复测量设计的方差分析,结果:①不同时间点体重比较,差异有统计学意义(F=201.542,P=0.000);②两组体重比较,差异有统计学意义(F=23.863,P=0.000),B组低于A组;③两组体重变化趋势比较,差异有统计学意义(F=16.021,P=0.000)。见表1和图1A。
C组 和D组0、7、14、21、28、35、42、49、56、63、70、77、84、91、98 及105 d 体重比较,采用重复测量设计的方差分析,结果:①不同时间点体重比较,差异有统计学意义(F=30.560,P=0.000);②两组体重比较,差异无统计学意义(F=2.432,P=0.051);③两组体重变化趋势比较,差异无统计学意义(F=0.739,P=0.744)。见表2和图1B。
表1 A、B组不同时间点体重比较 (n =9,g,±s)

表1 A、B组不同时间点体重比较 (n =9,g,±s)
组别 0 d 7 d 14 d 21 d A组 219.43±6.21 235.76±7.87 252.13±8.34 261.65±8.65 B组 211.21±6.87 242.23±8.35 261.41±9.81 288.53±7.62
表2 C、D组不同时间点体重比较 (n =9,g,±s)
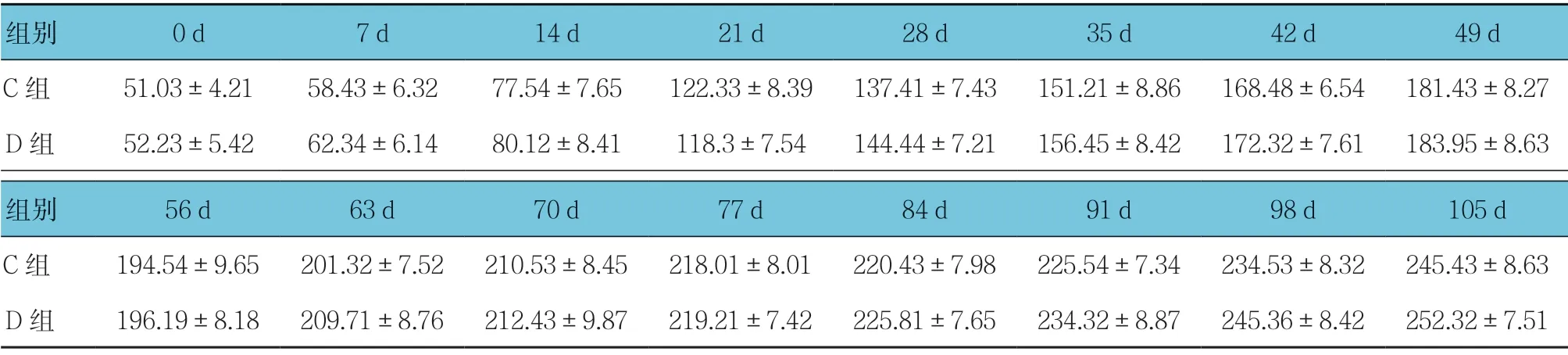
表2 C、D组不同时间点体重比较 (n =9,g,±s)
组别 0 d 7 d 14 d 21 d 28 d 35 d 42 d 49 d C组 51.03±4.21 58.43±6.32 77.54±7.65 122.33±8.39 137.41±7.43 151.21±8.86 168.48±6.54 181.43±8.27 D组 52.23±5.42 62.34±6.14 80.12±8.41 118.3±7.54 144.44±7.21 156.45±8.42 172.32±7.61 183.95±8.63组别 56 d 63 d 70 d 77 d 84 d 91 d 98 d 105 d C组 194.54±9.65 201.32±7.52 210.53±8.45 218.01±8.01 220.43±7.98 225.54±7.34 234.53±8.32 245.43±8.63 D组 196.19±8.18 209.71±8.76 212.43±9.87 219.21±7.42 225.81±7.65 234.32±8.87 245.36±8.42 252.32±7.51
2.2 各组动情周期变化
阴道涂片评估动情周期发现,A、C组动情周期规律,均为4 ~5 d。B组在第14 ~21 天阴道涂片仅观察到白细胞,提示B组失去了规律的动情周期。D组第42 ~49、70 ~77 及98 ~105 天发情周期持续时间逐渐延长,表明发情周期不规律。
2.3 各组卵巢重量和卵巢组织形态学比较
A组观察结束后卵巢重量为(54.26±4.51)mg,B组为(70.91±5.23)mg,经t检验,差异有统计学意义(t=7.233,P=0.000),B组高于A组。
C组观察结束后卵巢重量为(41.84±5.98)mg,D组为(46.62±5.32)mg,经t检验,差异无统计学意义(t=1.792,P=0.092)。
B组和D组均观察到多个囊状扩张卵泡、小卵泡及闭锁卵泡,黄体数量下降,颗粒细胞层数减少。B组卵泡直径为(865.32±32.25)μm,D组为(475.32±26.54)μm,经t检验,差异有统计学意义(t=28.013,P=0.000),B组大于D组。见图2。
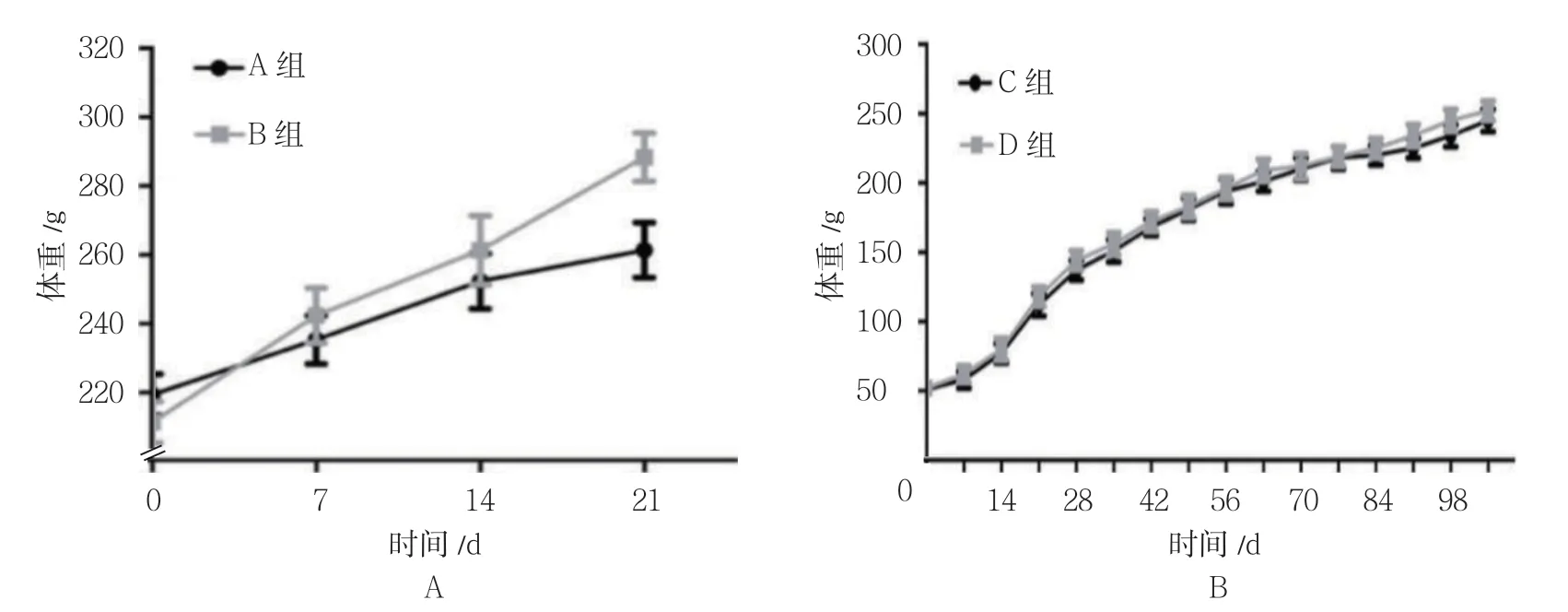
图1 各组体重增长曲线 (n =9,±s)
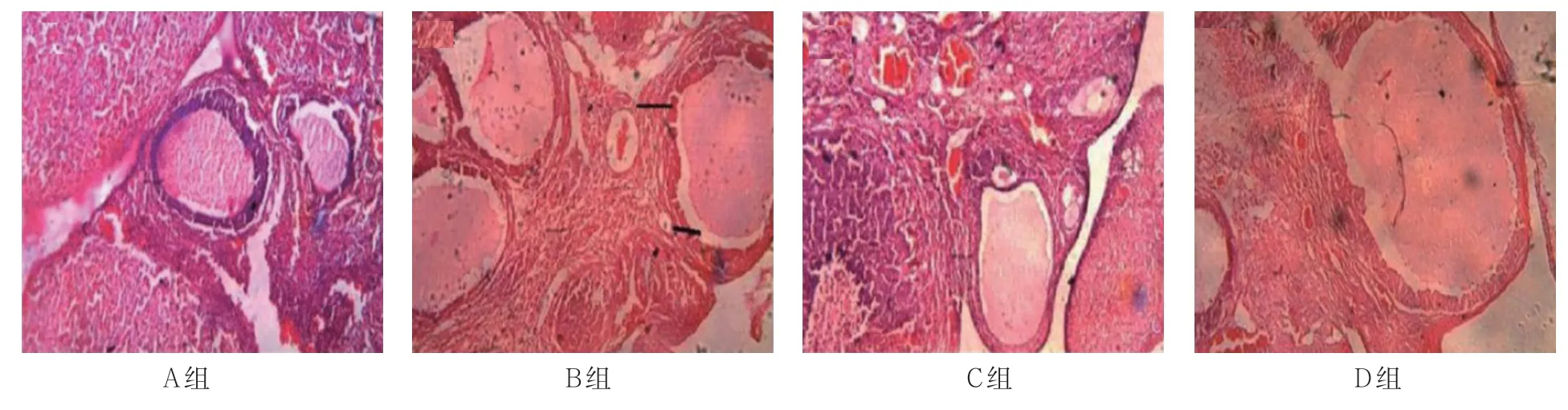
图2 各组卵巢组织形态变化 (HE 染色×100)
2.4 各组FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较
A组与B组喂养21 d 后糖耐量比较,差异有统计学意义(t=14.723,P=0.000);两组FBG、FINS、HOMA-IR 和定量胰岛素敏感性检测指数比较,差异无统计学意义(t=0.643、0.843、0.752 和0.154,P=0.423、0.132、0.298 和0.638)。见表3。
C组与D组49、77 及105 d 检测的FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较,采用重复测量设计的方差分析,结果:①不同时间点FBG 比较,差异无统计学意义(F=0.422,P=0.654),不同时间点FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较,差异有统计学意义(F=2.943、3.131、3.452 和3.354,P=0.042、0.034、0.031和0.038);②两组FBG 比较,差异无统计学意义(F=0.436,P=0.543),两组FINS、糖耐量、HOMAIR 及定量胰岛素敏感性检测指数比较,差异有统计学 意 义(F=13.541、12.321、18.496 和10.321, 均P=0.001),D组FINS、糖耐量、HOMA-IR 高于C组,C组定量胰岛素敏感性检测指数高于D组;③两组FBG 变化趋势比较,差异无统计学意义(F=0.651,P=0.342),两组FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数变化趋势比较,差异有统计学意义(F=9.433、7.769、8.762 和3.354,P=0.002、0.008、0.003 和0.038)。见表4。
2.5 各组TG、TC 水平比较
A组和B组第21天TG分别为(96.42±4.36)和(136.91±7.65)mg/dl,经t检验,差异有统计学意义(t=13.80,P=0.000)。A组和B组第21 天TC 分别为(94.35±5.85)和(95.68±4.98)mg/dl,经t检验,差异无统计学意义(t=0.801,P=0.107)。
C组与D组49、77及105 d的TG、TC比较,采用重复测量设计的方差分析,结果:①不同时间点TG、TC 比较,差异无统计学意义(F=0.324 和0.662,P=0.931 和0.322);②两组TG 比较,差异无统计学意义(F=0.962,P=0.121);两组TC 比较,差异有统计学意义(F=3.232,P=0.039),D组TC 高于C组;③两组TG 变化趋势比较,差异无统计学意义(F=0.931,P=0.152),两组TC 变化趋势比较,差异有统计学意义(F=2.419,P=0.042)。见 表5。
表3 A、B组检测21 d 后FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较 (n =9,±s)
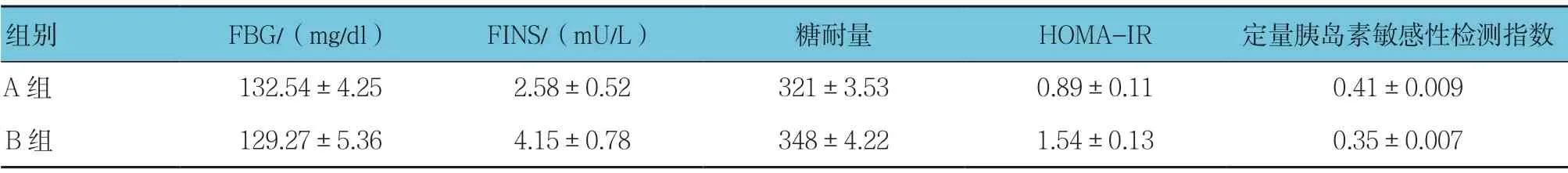
表3 A、B组检测21 d 后FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较 (n =9,±s)
组别 FBG/(mg/dl) FINS/(mU/L) 糖耐量 HOMA-IR 定量胰岛素敏感性检测指数A组 132.54±4.25 2.58±0.52 321±3.53 0.89±0.11 0.41±0.009 B组 129.27±5.36 4.15±0.78 348±4.22 1.54±0.13 0.35±0.007
表4 C、D组不同时间点的FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较 (n =9,±s)
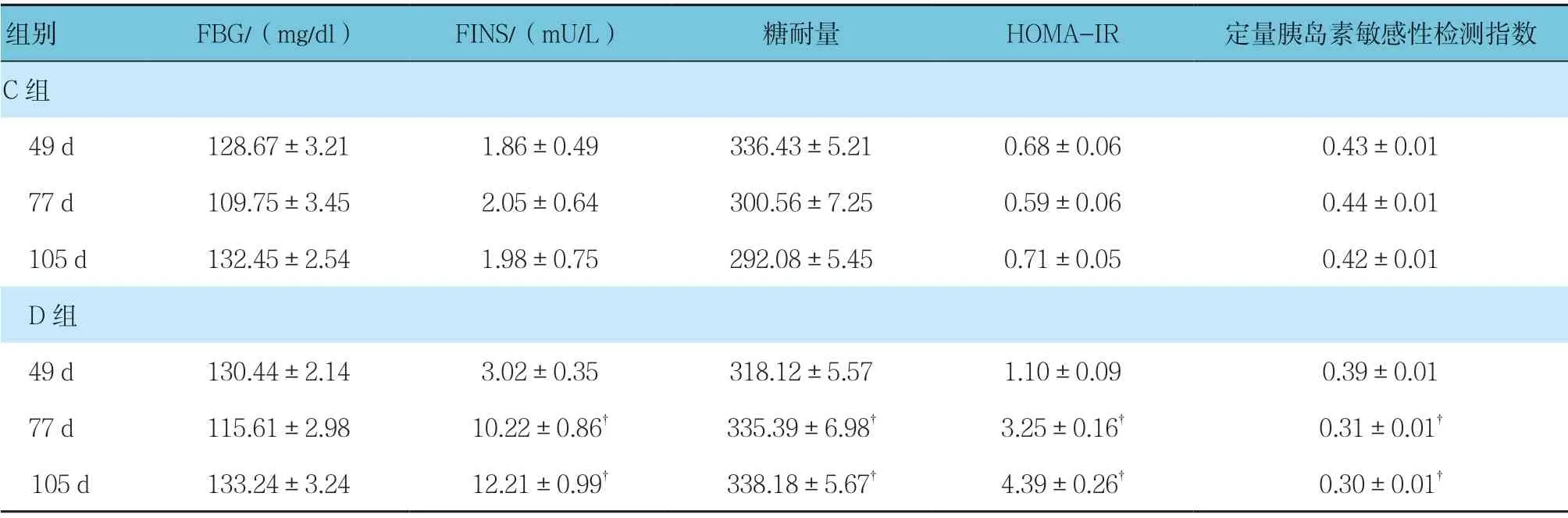
表4 C、D组不同时间点的FBG、FINS、糖耐量、HOMA-IR 及定量胰岛素敏感性检测指数比较 (n =9,±s)
注:†与C组比较,P <0.05。
组别 FBG/(mg/dl) FINS/(mU/L) 糖耐量 HOMA-IR 定量胰岛素敏感性检测指数C组 49 d 128.67±3.21 1.86±0.49 336.43±5.21 0.68±0.06 0.43±0.01 77 d 109.75±3.45 2.05±0.64 300.56±7.25 0.59±0.06 0.44±0.01 105 d 132.45±2.54 1.98±0.75 292.08±5.45 0.71±0.05 0.42±0.01 D组 49 d 130.44±2.14 3.02±0.35 318.12±5.57 1.10±0.09 0.39±0.01 77 d 115.61±2.98 10.22±0.86† 335.39±6.98† 3.25±0.16† 0.31±0.01† 105 d 133.24±3.24 12.21±0.99† 338.18±5.67† 4.39±0.26† 0.30±0.01†
2.6 各组血清性激素水平比较
A组与B组21 d 的E2、T 水平比较,差异有统计学意义(t=7.420 和14.200,均P=0.000),两组LH、FSH、LH/FSH 及P 水平比较,差异无统计学意义(t=0.109、0.073、0.433 和0.773,P=0.759、0.859、0.532 和0.299)。见表6。
表5 C、D组不同时间点的TG、TC 水平比较 (n =9,mg/dl,±s)
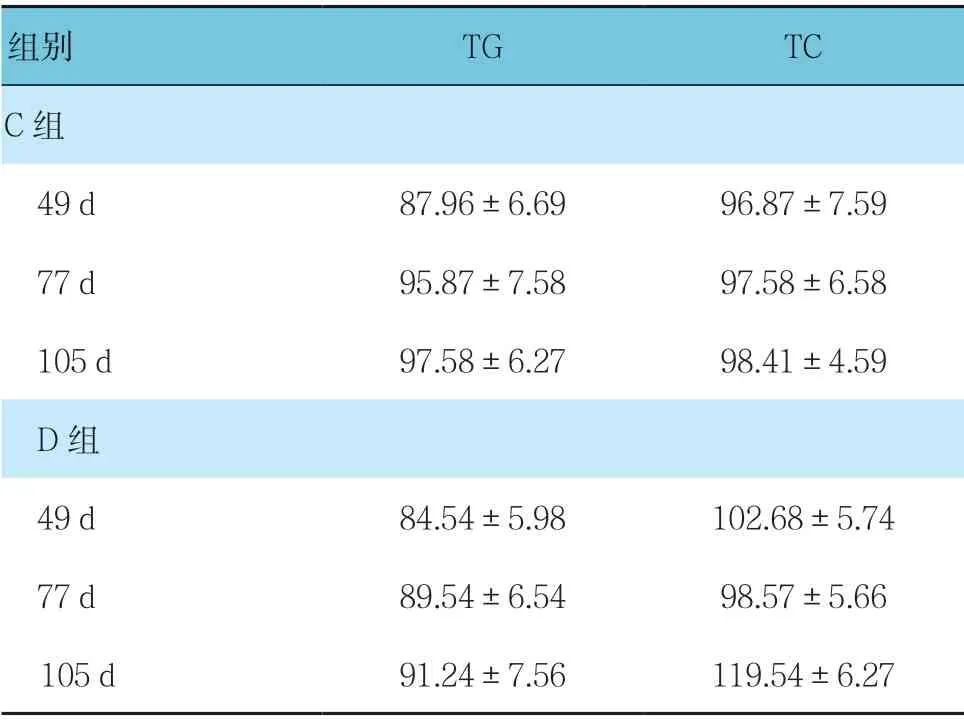
表5 C、D组不同时间点的TG、TC 水平比较 (n =9,mg/dl,±s)
组别 TG TC C组 49 d 87.96±6.69 96.87±7.59 77 d 95.87±7.58 97.58±6.58 105 d 97.58±6.27 98.41±4.59 D组 49 d 84.54±5.98 102.68±5.74 77 d 89.54±6.54 98.57±5.66 105 d 91.24±7.56 119.54±6.27
表6 A、B组21 d 的血清性激素水平比较 (n =9,±s)
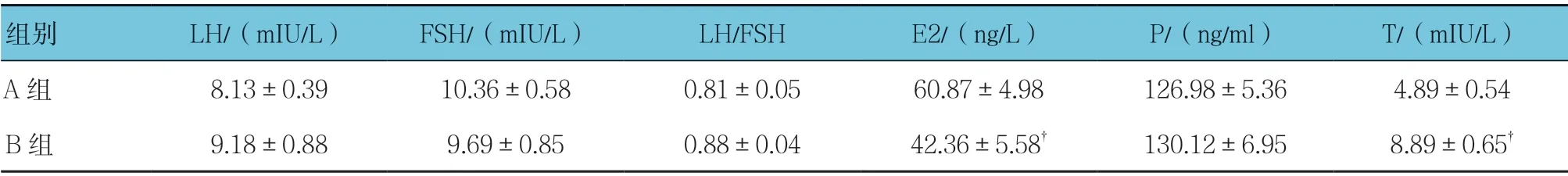
表6 A、B组21 d 的血清性激素水平比较 (n =9,±s)
注:†与A组比较,P <0.05。
组别 LH/(mIU/L) FSH/(mIU/L) LH/FSH E2/(ng/L) P/(ng/ml) T/(mIU/L)A组 8.13±0.39 10.36±0.58 0.81±0.05 60.87±4.98 126.98±5.36 4.89±0.54 B组 9.18±0.88 9.69±0.85 0.88±0.04 42.36±5.58† 130.12±6.95 8.89±0.65†
C组与D组49、77 及105 d 的LH、FSH、LH/FSH、E2、P 及T 比较,采用重复测量设计的方差分析,结果:①不同时间点LH、FSH 及LH/FSH 比较,差异无统计学意义(F=0.834、0.932 和0.822,P=0.721、0.432 和0.651);不同时间点E2、P 和T 水平比较,差异有统计学意义(F=32.321、14.543 和25.363,均P=0.001);②两组LH、FSH 和LH/FSH 比较,差异无统计学意义(F=0.883、0.793 和0.812,P=0.552、0.871和0.512);两组E2、P 和T 比较,差异有统计学意义(F=23.654、32.654 和12.343,均P=0.001),D组E2、P 水平低于C组,D组T 水平高于C组;③两组LH、FSH、LH/FSH,E2、P 及T 变化趋势比较,差异有统计学意义(F=3.212、2.121、1.987、21.235、7.643和25.439,P=0.022、0.038、0.041、0.001、0.001 和0.001)。见表7。
2.7 各组LHR 和FSHR mRNA 相对表达量比较
A、B、C 及D组患者LHR mRNA 相对表达量分 别 为(1.02±0.12)、(1.25±0.63)、(1.08±0.14)和(2.68±0.64),FSHR mRNA 相对表达量分别为(1.01±0.11)、(0.82±0.36)、(1.02±0.12) 和(1.17±0.35)。各组患者LHR mRNA比较,经方差分析,差异有统计学意义(F=26.580,P=0.001);D组高于C组(P<0.05);各组FSHR 比较,经方差分析,差异无统计学意义(F=2.648,P=0.065)。见图3。
表7 C、D组不同时间点的血清性激素水平比较 (n =9,±s)
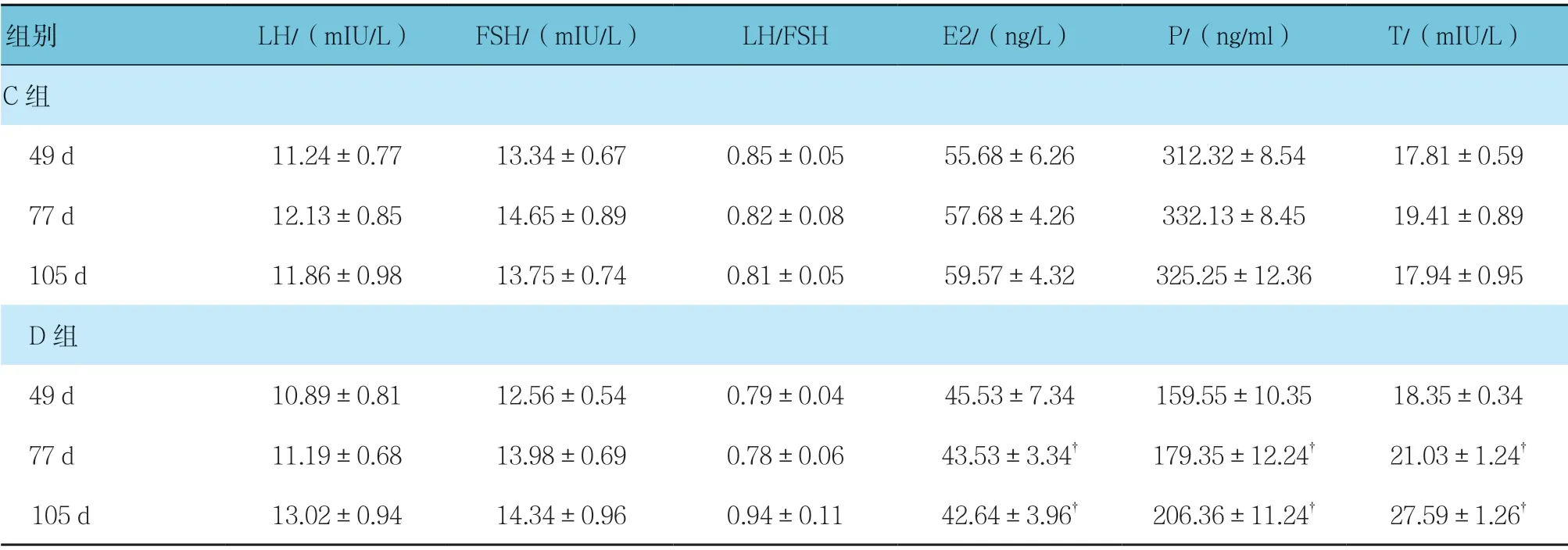
表7 C、D组不同时间点的血清性激素水平比较 (n =9,±s)
注:†与C组比较,P <0.05。
组别 LH/(mIU/L) FSH/(mIU/L) LH/FSH E2/(ng/L) P/(ng/ml) T/(mIU/L)C组 49 d 11.24±0.77 13.34±0.67 0.85±0.05 55.68±6.26 312.32±8.54 17.81±0.59 77 d 12.13±0.85 14.65±0.89 0.82±0.08 57.68±4.26 332.13±8.45 19.41±0.89 105 d 11.86±0.98 13.75±0.74 0.81±0.05 59.57±4.32 325.25±12.36 17.94±0.95 D组 49 d 10.89±0.81 12.56±0.54 0.79±0.04 45.53±7.34 159.55±10.35 18.35±0.34 77 d 11.19±0.68 13.98±0.69 0.78±0.06 43.53±3.34† 179.35±12.24† 21.03±1.24† 105 d 13.02±0.94 14.34±0.96 0.94±0.11 42.64±3.96† 206.36±11.24† 27.59±1.26†
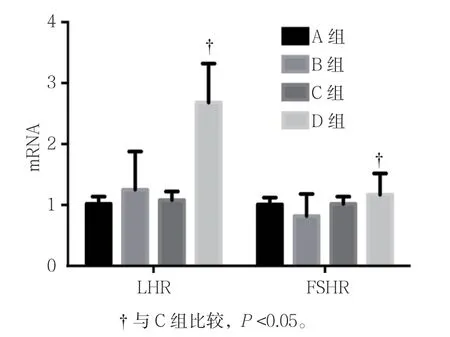
图3 各组LHR 和FSHR mRNA 相对表达量的变化 (n =9,±s)
3 讨论
临床PCOS 患者常见高雄激素血症和高胰岛素血症[8]。本研究发现HFD 可诱导青春期前大鼠PCOS,其特征与临床PCOS 患者症状相似。目前PCOS 动物模型复制主要是通过给予啮齿类动物雌激素、抗孕酮、雄激素及来曲唑来诱导[9]。为观察PCOS 的卵巢形态特征和代谢功能变化,本研究同时让一组成年大鼠服用来曲唑以作为对照,结果显示D、B组均出现PCOS卵巢特征,提示HFD 喂养青春期前大鼠与来曲唑诱导一样均可复制PCOS 模型。
本研究中HFD 喂养的大鼠动情期阶段的持续时间逐渐延长,表明改大鼠发情周期中断。来曲唑喂养大鼠也出现发情不规律。在这2 种情况下,生育力都显著受损。性激素水平的不平衡也造成了卵巢的结构改变。囊肿卵泡数增加,囊壁增厚,颗粒细胞层减少或消失,B、D组大鼠颗粒细胞层减少,卵巢也显示闭锁卵泡增加和黄体减少。大鼠卵巢的这些组织病理学变化与PCOS 相似。
本研究连续HFD 喂养49 d 后逐渐观察到大鼠糖耐量、FINS 及TG 异常。有学者临床观察到PCOS 患者伴随胰岛素抵抗会引起脂肪酶活性下降并导致TG异常[10]。HFD 喂养逐渐增加TC 而非TG 水平。在脱氢表雄酮联合HFD 处理的C57BL/6 小鼠中也有报道TC 水平升高[11]。本研究中,HFD 喂养大鼠的激素变化可能是胰岛素抵抗和高胰岛素血症的结果。来曲唑可减少雄激素在卵巢向雌激素的转化,因此观察到来曲唑喂养的大鼠中雌激素水平较低、睾酮水平较高。另有研究发现孕酮水平也降低[12],与本研究观察结果相似。
本研究中HFD 喂养大鼠的LH 和FSH 水平及其比例均未改变,但LHR 表达上调,对FSHR 表达影响不大。HFD 喂养的大鼠LH 水平未改变,可能是因为LH 处于动态变化过程中,清晨采血样LH 可能并不是其变化区间。虽然相当比例的PCOS 患者有LH/FSH改变,但LH/FSH 并不能作为PCOS 诊断指标。高胰岛素血症可增加LHR 的表达,继而可增强促性腺激素的卵巢类固醇的生成反应,使其过早的颗粒分化,阻止卵泡生长并导致排卵[13]。由于LHR 表达未改变,所以单独来曲唑治疗的大鼠通常不存在高胰岛素 血症。
综上所述,大鼠青春期前开始的HFD 诱导代谢功能紊乱和卵巢形态改变进展缓慢,与临床PCOS 患者观察到的变化相似。与来曲唑诱导PCOS 模型相比,青春前期HFD 可能是通过产生高胰岛素血症诱导雄激素增多,诱导大鼠PCOS。该模型研究对于进一步阐明PCOS 的发病机制具有重要意义。

