甜瓜果实糖含量的主基因+多基因遗传分析
叶红霞,吕律,海睿,胡雨晴,汪炳良
(浙江大学农业与生物技术学院蔬菜研究所,杭州 310058)
甜瓜(Cucumis meloL.)是世界各地普遍栽培的一种水果型蔬菜,而中国是世界上甜瓜栽培面积最大、总产量最高的国家。优质是甜瓜生产者和消费者的共同追求,也是甜瓜新品种选育的一个永恒目标。在构成甜瓜果实品质的诸多因素中,糖含量是最重要的因素之一[1]。甜瓜果实中最主要的可溶性糖是葡萄糖、果糖和蔗糖[2-3],但在成熟果实中糖分含量存在明显的变种间、品种间差异[4-6],其中厚皮甜瓜果实中的可溶性糖,特别是蔗糖含量远高于越瓜果实[7]。
无论是选育高糖型甜瓜品种还是选育低糖型甜瓜品种,其前提必须明确甜瓜果实糖分组分的遗传规律。BURGER等于2002年报道,发现了一个控制甜瓜果实蔗糖积累的隐性基因[8],但后来多数学者认为甜瓜果实糖含量属于多基因控制的数量性状[2,9-10],且容易受环境因素影响[11-13]。本文以低糖自交系和高糖自交系构建的6个世代群体为材料,利用植物数量性状主基因+多基因混合遗传模型分析方法,探讨甜瓜果实糖组分的遗传规律,旨在明确甜瓜果实糖组分的遗传方式,为甜瓜优质育种提供科学依据。
1 材料与方法
1.1 试验材料
本试验以低糖越瓜(Cucumis melovar.conmmonMakino)自交系‘花皮菜瓜’(P1)和高糖厚皮甜瓜(Cucumis melovar.saccharinusNaud.)自交系‘XLH’(P2)为亲本,通过杂交、自交和回交获得P1、P2、F1、F2、B1(F1×P1)和B2(F1×P2)共6个世代的种子。其中:P1果实圆柱形,果皮墨绿色、具浅绿色斑纹,果肉淡绿色、质地松脆,瓜瓤浅橘红色;P2果实椭圆形,果皮白色、具淡绿色斑纹,果肉橘红色、质地脆;F1群体果形、皮色、肉色等性状偏向P1(图1);F2、B1、B2群体的果形、皮色、肉色等性状发生分离。

图1 双亲及F1果实Fig.1 Fruits of the two parents and F1generation
1.2 试验方法
将得到的6个世代的种子于2017年春季在浙江省湖州市吴兴金农生态农业发展有限公司移沿山基地的塑料大棚中种植。2017年2月13日育苗,3月15日定植,畦宽(连沟)2.0 m、株距0.5 m。P1、P2、F1、F2、B1和 B2等 6 个群体分别定植 10、10、10、100、80和80株左右。田间管理同常规生产管理,棚架栽培,开花后人工授粉,单蔓整枝,选择主蔓第11—13节位的侧枝结果,待果实达到生理成熟时选择生长正常、无机械伤害的果实逐株采收。果实采收当天运回实验室取样,取样时切取果实赤道部分的果肉,厚度2 cm左右,每个果实重复取样3次,保存于-80℃冰箱中,备用。
糖的提取参考管学玉的方法[14],糖组分含量测定参考朱勇等的方法[15]。色谱仪为Waters 2695高效液相色谱仪(配Waters 2414型示差折光检测器),色谱条件为:流动相V(乙腈)∶V(重蒸水)=80∶20,流速1.0 mL/min,柱温40℃,检测器温度35℃,进样量10 μL。柱型为美国Waters公司Spherisorb-5NH2柱。以色谱级果糖、葡萄糖和蔗糖标准品等比例混合配制标准工作液,进行液相色谱分析,以浓度为X轴,峰面积为Y轴进行线性回归,制作标准曲线,并根据标准曲线计算糖组分含量。
1.3 数据分析
利用Excel 2016对P1、P2和F1葡萄糖、果糖、蔗糖含量及总糖(葡萄糖+果糖+蔗糖)含量[16]进行差异显著性分析,并对F2、B1和B2分离世代果实葡萄糖、果糖、蔗糖和总糖含量绘制频次分布图(同一糖组分在3个分离世代中均分成9组,组中值相同)。
试验数据利用章元明教授课题组开发的Windows软件包中的SEA-G6[17]在Lenovo PC机上运行,采用植物数量性状主基因+多基因混合遗传模型分析方法对6个世代糖含量相关性状进行联合分析:先通过极大似然法(maximum likelihood method)和迭代期望条件最大化(iterated expectation and conditional maximization,IECM)算法对混合分布中的有关成分分布参数作出估计,根据赤池信息量准则(Akaike’s information criterion,AIC),选出 AIC值最小的模型及与最小值比较接近的模型作为备选模型,然后利用均匀性检验检验(nW2)和Kolmogorov检验(Dn)对选出的备选模型的各世代进行适合性检验,并选择统计量达到显著水平个数最少的模型作为该性状的最优模型,最后根据最小二乘法估计主基因和多基因效应值、方差等遗传参数。
2 结果与分析
2.1 6个世代糖组分含量表型特点
由表1可知:双亲及F1葡萄糖含量无显著差异;F1果糖和蔗糖含量介于双亲之间且偏向低亲(P1),显著低于高亲(P2),但与P1差异不显著;P2总糖含量显著高于P1和F1,而F1总糖含量偏向低亲但显著高于低亲。同时,在高糖亲本甜瓜果实总糖构成中,蔗糖占比最高,达63.98%;而在低糖亲本及F1中,蔗糖占比较低,分别为2.95%和18.54%。
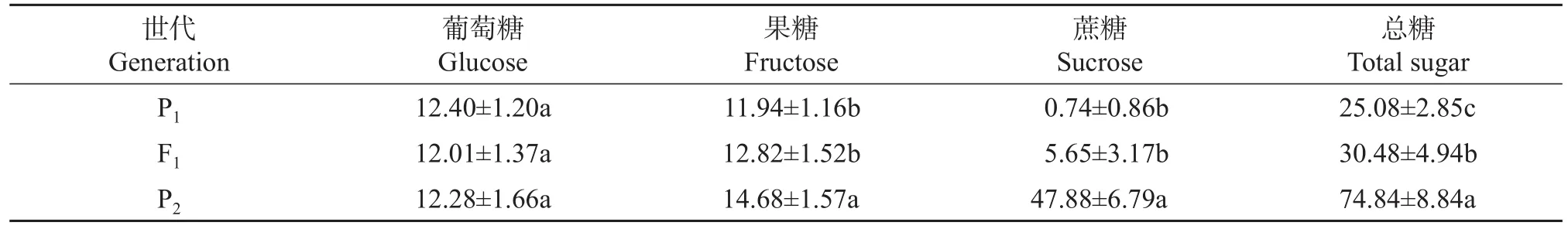
表1 双亲及F1果实糖含量Table 1 Fruit sugar content in the two parents and F1generation mg/g
同时,从图2可以看出,甜瓜果实葡萄糖、果糖、蔗糖及总糖含量在分离世代呈现单偏峰分布,符合主基因+多基因表型分布特征。
2.2 遗传模型选择与检测
对6个世代果实的果糖、葡萄糖、蔗糖、总糖含量分别进行主基因+多基因混合遗传模型分析,得到5类24种模型的AIC值(表2)。根据遗传模型选取的AIC值最小原则,选取AIC值最小的模型及与最小AIC值差异不大的遗传模型作为备选模型,其中:对于葡萄糖含量,AIC值最小的模型为E-1(MX2-ADI-AD,即2对主基因加性-显性-上位性+多基因加性-显性模型),模型D-0(MX1-ADADI,即1对主基因加性-显性+多基因加性-显性-上位性模型)的AIC值与E-1接近;对于果糖含量,AIC值最小的模型为E-0(MX2-ADI-ADI,即2对主基因加性-显性-上位性+多基因加性-显性-上位性模型),模型E-1的AIC值与E-0接近;对于蔗糖含量,AIC值最小的模型为E-1,模型E-5(MX2-AED-AD,即2对主基因完全显性+多基因加性-显性模型)的AIC值与E-1接近;对于总糖含量,AIC值最小的模型为E-1,模型D-0的AIC值与E-1接近。

图2 甜瓜分离世代(F2、B1、B2)果实糖含量的频次分布Fig.2 Frequency distribution for fruit sugar content in the segregation populations(F2,B1,B2)

表2 甜瓜果实糖含量相关性状遗传模型的赤池信息量准则(AIC)值Table 2 Akaike’s information criterion(AIC)value of various genetic models for fruit sugar content correlated traits in melon
对于甜瓜各糖组分含量中AIC值最低的2个备选模型进行适合性检验,以选择最优模型。对于葡萄糖含量,模型D-0和模型E-1的所有统计量均未达到显著性水平(表3),但E-1模型的AIC值最小(表2),因此,在甜瓜果实中葡萄糖含量的最适遗传模型为E-1,即2对主基因加性-显性-上位性+多基因加性-显性模型;对于果糖含量,模型E-1有2个统计量达到显著水平,模型E-0所有统计量均未达到显著水平(表4),且其AIC值最小(表2),因此,模型E-0(2对主基因加性-显性-上位性+多基因加性-显性-上位性模型)为甜瓜果实果糖含量的最优遗传模型;对于蔗糖含量,模型E-1的所有统计量均未达显著水平,而模型E-5有4个统计量达显著水平(表5),且E-1的AIC值最小,因此,甜瓜果实蔗糖含量的最适遗传模型是E-1,即2对主基因加性-显性-上位性+多基因加性-显性模型;对于总糖含量,模型E-1和D-0的所有统计量均未达显著水平(表6),但模型E-1的AIC值最小,因此,甜瓜果实总糖含量的最适遗传模型为E-1。
2.3 最适模型的遗传参数估计
根据最小二乘法原理对甜瓜果实果糖、葡萄糖、蔗糖、总糖选择的最优模型进行一阶和二阶遗传参数估计,结果如表7和表8所示。
从表7可以看出,控制葡萄糖含量的2对主基因加性效应均为正向且效应值相等(0.542);2对主基因显性效应值分别为-4.669和-5.620,均大于正向的加性效应,且第2对主基因的显性效应大于第1对主基因的显性效应,说明主基因以第2对的负向显性效应为主;多基因以正向显性效应为主(2.889)。在主要互作效应中,显性×加性互作为负向,加性×加性、加性×显性和显性×显性互作均为正向,其中显性×显性互作的作用最明显(7.940)。由表8可知,在B1、B2、F2中控制葡萄糖含量的主基因遗传率分别为0.773、0.852和0.862,而多基因遗传率几乎为0,表明主基因对控制葡萄糖含量遗传的作用较大。
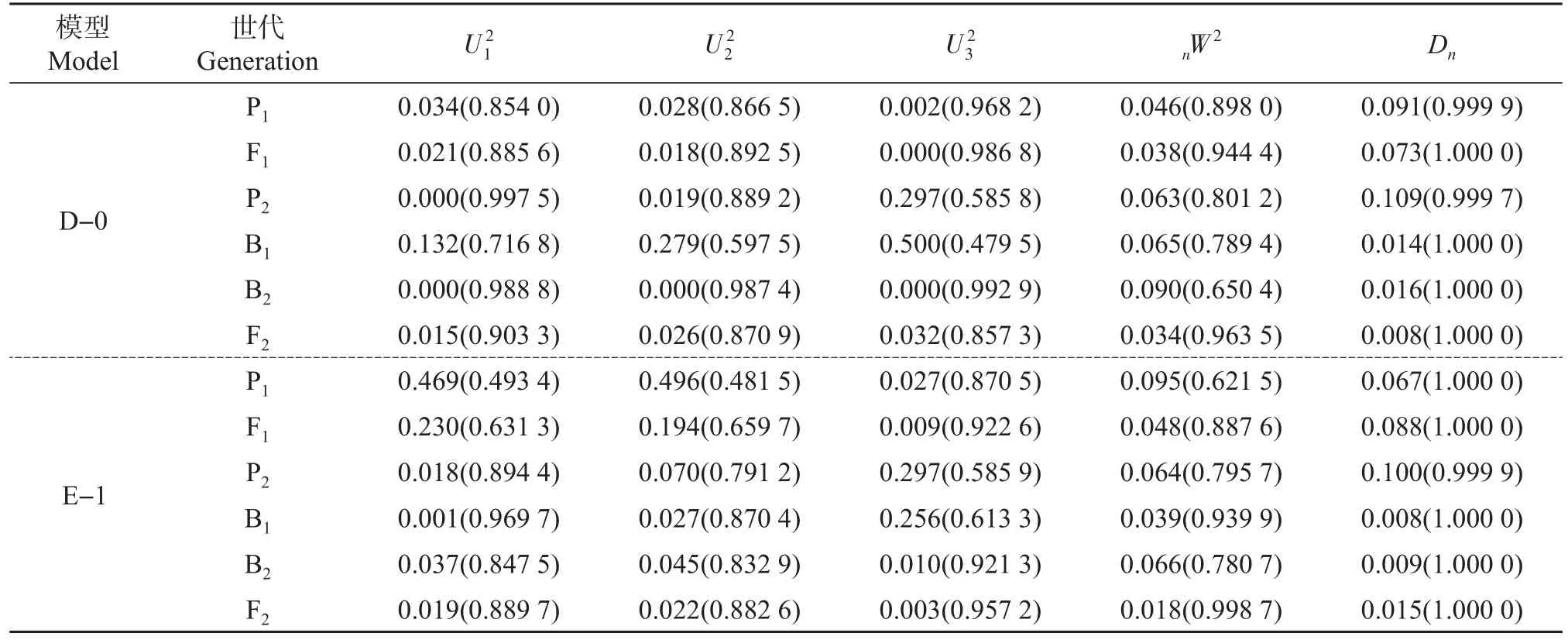
表3 甜瓜果实葡萄糖含量备选模型适合性检验Table 3 Fitness test of alternative inheritance models for fruit glucose content in melon

表4 甜瓜果实果糖含量备选模型适合性检验Table 4 Fitness test of alternative inheritance models for fruit fructose content in melon
由表7可知,控制甜瓜果实中果糖含量的2对主基因的加性效应和显性效应均为负向增效,2对主基因的加性效应值和显性效应值分别相等,且加性效应值(-4.083)比显性效应值(-3.532)稍大,说明主基因以负向增效的加性效应为主。在上位效应作用中,主基因的互作效应均为正向,显性×显性互作效应的值最大(7.725),加性×显性互作效应的值最小(3.751)。由表8可知,在B1、B2、F2中控制果糖含量的主基因遗传率均高于多基因遗传率,分别为0.569、0.543和0.857,表明主基因在F2中对控制果糖含量的遗传作用较大。

表5 甜瓜果实蔗糖含量备选模型适合性检验Table 5 Fitness test of alternative inheritance models for fruit sucrose content in melon

表6 甜瓜果实总糖含量备选模型适合性检验Table 6 Fitness test of alternative inheritance models for fruit total sugar content in melon
从表7可以看出,控制蔗糖含量的2对主基因的显性效应一正一负,负向的显性效应(-3.478)稍大于正向的显性效应(3.214),2对主基因的加性效应值相等(-6.024)且均大于显性效应,说明主基因以负向的加性效应为主。多基因也以负向的加性效应(-12.383)为主。在主要互作效应中,加性×加性和显性×加性互作为正向,加性×显性和显性×显性互作为负向,其中显性×加性互作(10.488)的作用最强。在B1、B2、F23个世代中,控制蔗糖含量的主基因遗传率分别为0.652、0.786、0.927(表8),表明主基因在F2中对控制蔗糖含量的遗传作用较大。
从表7还可以看出,控制总糖含量的2对主基因的加性效应值均为-4.150,2对主基因的显性效
应值均大于加性效应值,第2对主基因显性效应值(-5.691)稍大于第1对主基因显性效应值(-5.009),说明主基因以第2对主基因的负向显性效应为主。而多基因加性效应值(-19.614)大于显性效应值(-16.523),说明多基因以负向加性效应为主。此外,4个主要互作效应均为正向作用,其中显性×显性互作(19.130)作用最大,加性×加性互作(10.343)作用也较大。由表8可知,在B1、B2、F23个世代中控制总糖含量的主基因遗传率分别为0.630、0.647和0.850,说明主基因在F2中对控制总糖含量的遗传作用较大。

表7 甜瓜果实糖含量的一阶遗传参数估值Table 7 Estimates of first order genetic parameters for fruit sugar content in melon

表8 甜瓜果实糖含量的二阶遗传参数估值Table 8 Estimates of second order genetic parameters for fruit sugar content in melon
3 讨论
植物多数经济性状属于由多基因控制的数量性状。利用数量性状遗传研究的传统方法[18-20]可以获得加性方差、显性方差、表型方差及环境方差等参数,进而估算性状的遗传力。由于控制数量性状的基因有主效基因和微效基因,因此,将控制数量性状的多基因看作整体进行分析的传统方法,获得的信息量有限,分析结果对指导育种实践存在一定的局限性。盖钧镒等在借鉴前人研究的基础上,利用混合模型建立了数量性状主基因+多基因多世代联合分析法[21],并开发了Windows版本软件包SEA[17],以方便研究者使用。这种主基因+多基因多世代联合分析法已成为人们对数量性状进行遗传研究的主要方法,并在甜瓜[22-24]、西瓜[25]、花椰菜[26]、甘蓝型油菜[27]、大麦[28]、花生[29]等作物中得到普遍应用。
甜瓜果实糖含量是一个重要的品质性状,葡萄糖、果糖、蔗糖是甜瓜果实中主要可溶性糖组分。迄今为止,有关甜瓜果实糖含量的研究报道不多。林碧英等采用双列杂交方法研究发现,甜瓜可溶性固形物含量的基因加性效应和显性效应均达到显著水平,且加性效应占相对优势[30];但该试验估测的是基因的综合效应,且可溶性固形物含量包含了可溶于水的糖、酸、维生素、矿物质等,是一个综合性状,并不能完全代表甜瓜果实的糖含量,其研究结果对甜瓜糖含量育种的指导存在局限性。张红等对以甜味自交系与酸味自交系为材料构建的P1、P2、F1、F2等4世代群体研究发现,甜瓜果实糖(葡萄糖+果糖+蔗糖)含量受2对相等加性主基因+加性-显性多基因控制,并以主基因为主,其遗传力达到88.8%[16];由于该试验所用群体只有1个分离世代(F2),且仅对总糖进行遗传分析,研究结果存在一定的局限性。张宁等以低糖的野生薄皮甜瓜和高糖的厚皮甜瓜为亲本,对构建的6个世代群体利用比色法测定了果糖、葡萄糖、蔗糖、总糖含量,发现果糖、葡萄糖、总糖含量均受2对加性-显性-上位性主基因+加性-显性-上位性多基因控制,主基因在F2中的遗传率分别达到90.32%、82.42%和94.66%,蔗糖含量受1对加性主基因+加性-显性多基因控制,主基因在F2中的遗传率为83.76%[31]。本试验以属于薄皮甜瓜类型的低糖型(特别是低蔗糖含量)越瓜自交系与属于厚皮甜瓜类型的高糖型(特别是高蔗糖含量)自交系为材料,对通过杂交、自交、回交构建的6世代材料采用高效液相色谱法测定各种糖组分含量,利用主基因+多基因混合模型进行果实葡萄糖、果糖、蔗糖、总糖含量的遗传分析,发现果糖含量受2对加性-显性-上位性主基因+加性-显性-上位性多基因控制,这与张宁等的报道[31]基本一致;葡萄糖、蔗糖和总糖含量受2对加性-显性-上位性主基因+加性-显性多基因控制,这与前人研究结果[16,31]不同,其原因可能与试验所涉及的甜瓜自交系遗传背景、联合分析的世代群体和糖分测定方法等不同有关。在F2中,果糖、葡萄糖、蔗糖和总糖的主基因遗传率分别达到85.7%、86.2%、92.7%和85.0%,表明在F2中主基因遗传力较高,对果实糖分的遗传起主导作用,而多基因的贡献较小,这与张宁等的研究结果[31]也基本一致。
4 结论
研究甜瓜不同糖组分含量的遗传规律是甜瓜品质育种的必要前提。本研究结果表明:果糖含量受2对加性-显性-上位性主基因+加性-显性-上位性多基因控制;葡萄糖、蔗糖和总糖含量则受2对加性-显性-上位性主基因+加性-显性多基因控制,与前人报道[16,31]有所不同;控制甜瓜果实糖组分含量的遗传效应可以区分为主基因效应与多基因效应,在F2中主基因起主导作用,多基因的贡献较小,其中果糖、葡萄糖、蔗糖和总糖的主基因遗传率分别达到85.7%、86.2%、92.7%和85.0%,而环境对甜瓜果实糖组分的影响相对较小。因此,在甜瓜育种中,对果实糖组分含量的选择宜在早世代进行。

