MAPK 信号级联通路参与Alternaria alternata对梨果表皮信号分子的识别与应答
王调兰,张苗,李永才,毕阳,张婷婷,郑晓渊
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
Alternariaalternata是半知菌亚门丝孢纲丝孢目链格孢属(Alternariasp.)的病原物真菌[1],可引起苹果、梨、柑橘等多种水果的采后腐烂,造成巨大的经济损失[2].前期研究发现由A.alternata引起的梨果黑斑病为典型的潜伏侵染性病害[3],该菌孢子可在果实发育期粘附于果实表面,孢子萌发形成芽管,芽管伸长后其顶端膨大形成附着胞,部分附着胞进一步分化形成侵染菌丝,通过皮孔或表皮伤口侵入果实,且果皮蜡质及其疏水性对其侵染结构分化具有诱导作用[4].表皮蜡质的化学组分及物理疏水性作为识别的信号分子在病原物与宿主互作中具有重要作用[5-7].小麦叶片的总蜡提取物[5]可诱导Pucciniagraminis形成附着胞和侵染钉等侵染结构,大麦表皮蜡层的单体 C26醛[8]及鳄梨果实表皮蜡质组分中 C24烷烃和长链醇[9]均分别强烈诱导了Blumeriagraminis和Colletotrichumgloeosporioide的附着胞形成,水稻叶片上表皮蜡质中的重要组分初级醇是Magnaportheoryzae形成附着胞的识别信号,且M.oryzae的芽管能够识别水稻叶片表面的高疏水性,从而分化形成附着胞,而在人工亲水表面,分生孢子几乎不产生附着胞[10].同时研究发现果实表皮蜡质化学组分[11-12]及其物理特性(疏水性)[13]对A.alternata侵染结构的形成以及侵入过程也具有一定促进作用[4].果实发育后期产生的乙烯不仅对果实成熟和衰老过程起着重要的调控作用[14],同时也发现其能诱导C.gloeosporioides侵染结构的形成[15].但病原物如何响应果皮信号进而启动侵染,其调控机理仍不清楚.
促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号传导途径是真核生物(酵母、植物、哺乳动物)中普遍存在的细胞信号传导途径,参与调控细胞的生长分化、新陈代谢、发育凋亡、神经递质的合成与释放、光合作用、不良环境的适应、炎症肿瘤的发生及病原物的侵染等多种生理过程[16].且对病原真菌生长、发育、致病性及其细胞响应外界胁迫等方面具有重要的调控作用[17].目前研究认为植物致病真菌能够感知和响应宿主表型特征、疏水性、硬度、表皮蜡质、植物脂质和植物激素等表面物化特征,随后,激活病原物 G 蛋白, cAMP / 蛋白激酶 A 和 MAP 激酶等多种信号组分,以调节其侵染结构分化和致病过程[18],其中MAPK途径起着重要的作用.MAPK是一类普遍存在于真核生物中的丝/苏氨酸蛋白激酶,由三级酶联反应系统(MAPKKK、MAPKK、MAPK)所构成,它通过胞外刺激整合、放大和传递信号[17,19-21].真菌中普遍存在 Fus3 / Kss1 型, Hog1 型和 Slt2 型这3种MAPK途径,其中 Hog1-MAPK 与哺乳动物中 P38-MAPK 具有同源性[22].张海峰[16]研究发现,MAPK信号途径参与介导M.oryzae对水稻表面信号的识别及应答,且对后期阶段附着胞的形成和侵入过程具有重要的调控作用.同时还发现MAPK信号途径中的相关激酶如M.oryzae的MAP激酶 (Pmk1)、Aspergillusoryzae的 MAP 激酶 (Mps1)[23]、Fusariumoxysporum的 MAP 激酶 (Fmk1 MAPK)[24]、Colletotrichumorbiculare的MAP激酶(CoMekk1)[25]参与了其响应植物表皮信号进而启动孢子萌发、附着胞形成以及随后的侵入过程.同时Kim等[26]研究发现C.gloeosporioidesMAPKK 缺失突变株 (ΔCgMEK1) 失去了形成附着胞的能力.迄今为止,许多研究已经揭示了植物病原真菌中侵染结构分化所涉及的发育过程和细胞信号传导,但果蔬主要采后病原物A.alternata中MAPK信号级联通路是否参与其对果实表皮信号分子的诱导和响应过程未见报道.
通过研究MAPK信号级联途径在A.alternata响应梨表皮物理化学信号进而启动侵染中的调控作用,进一步全面揭示果实表皮诱导病原物侵染的细胞信号传导途径及调控机理,同时为果蔬采后病害的安全控制提供理论依据.因此,本研究通过药理学方法,用MAPK信号级联通路抑制剂SB203580处理A.alternata孢子悬浮液,研究其对梨果黑斑病侵染的调控,结合体外试验,分析A.alternata响应不同疏水表面、蜡质提取物和乙烯等信号分子的刺激后对其生长、侵染结构及致病性的影响,以期更好地认识和了解A.alternata的MAPK激酶通路在侵染植物过程中的相互关联和作用.
1 材料与方法
1.1 材料与试剂
1.1.1 供试果实 早酥梨(Pyrusbretchneidericv.‘Zaosu’)于2018年7月购于甘肃省景泰县条山农场采摘无任何机械伤口及病虫害的果实.采收后当即进行单果包装,然后装箱,并运至冷库贮藏(4 ℃,RH85%)以待试验所用.
1.1.2 菌株与培养基 互隔交链孢(Alternariaalternata)分离于自然发病的腐烂病果,纯化后在PDA(potato dextrose agar) 上保存待用.
PDA培养基[27]:马铃薯200 g、蔗糖15~20 g、琼脂15~20 g、蒸馏水1 000 mL.
1.2 方法
1.2.1A.alternata的分离、纯化 参照李永才[29]的方法进行试验.采集具有黑斑病的‘早酥梨’果实,并用75% 乙醇对其表面进行消毒,无菌水冲洗后,切取病健交界处的组织,在无菌操作环境下移至PDA培养基上,然后置于28 ℃保温箱中培养,待其长出分生孢子后再进行分离、纯化,并通过回接试验确定其致病性.分离纯化后的A.alternata在 PDA 培养基上保存备用.
1.2.2 孢子悬浮液的配制 参照高春丽等[30]的方法并略作修改,无菌操作环境下,将少量无菌水倒入培养周期为5 d的A.alternata培养皿中,并加入少量0.01% Tween-80,用涂布器轻刮,将所得溶液通过4层纱布过滤到锥形瓶中(所需仪器已提前进行高温高压灭菌),无菌水稀释之后,在混合器上振荡15~20 s,用血球计数板计数,光学显微镜镜检,配制成1×105个/mL的孢子悬浮液.
1.2.3 蜡质的提取 参照李永才[29]的方法,挑选大小一致、无机械伤口以及病虫害的‘早酥梨’果实,表面清洗后自然晾干,在磁力搅拌器上放置1 000 mL烧杯,倒入600 mL 氯仿后将果实浸入,室温下洗刷浸泡提取60 s.提取液经8层纱布过滤,转入事先称好质量的蒸馏瓶,用减压蒸馏法除去溶剂(水温 40 ℃).将所得蜡质粗提物贮藏在4 ℃的冰箱中,用于后续试验.
1.2.4 MAPK抑制剂的溶解 将SB203580按照一定浓度加入一定比例的无菌水,并放置于超声仪中15 min,使其充分溶解(可稍加热).
1.2.5 生长的观察 抑制剂SB203580溶液按一定浓度加入装有一定体积PDA的培养皿中,冷却凝固后滴加5 μL孢子悬浮液封存,置于28 ℃恒温培养箱中培养,每天测定培养皿中的菌落直径,并观察其菌落形态,直至长满培养皿为止.
1.2.6 疏水性测定 Gelbond膜剪切成大小5 cm×2 cm 的长方形,分别将亲水面和疏水一侧朝上置于清洗干净的载玻片上待测定.
用10 mL氯仿溶解提取的苹果梨蜡质0.1 g,配制成约0.1% 的蜡质溶液,同时配制相同浓度的蜂蜡、石蜡溶液作为对照,分别吸取 20 、40 、60 、80和100 μL的果蜡、蜂蜡、石蜡滴于Gelbond 膜疏水面一侧,用涂布器均匀涂开后放置于已清洗干净的载玻片上12 h,待氯仿挥发干净后进行测定.
使用接触角测定仪(DSA 100,KRUSS Company,Germany)对上述处理好的样品进行测定,在样品表面滴加5 μL的水滴用来测定接触角的大小,每个样品重复5次,一个处理重复3次.
1.2.7 体外试验 将抑制剂SB203580溶液按10、20和30 μmol/L的浓度比例加入A.alternata孢子悬浮液(1×105个 /mL)中,吸取20 μL滴加于已清洗干净的载玻片(将已剪切Gelbond膜的疏水面一侧朝上放置于载玻片上提供疏水条件)形成处理组,对照组为A.alternata孢子悬浮液(1×105个 /mL),再将载玻片放置在铺有湿润滤纸的培养皿中,置于28 ℃的恒温培养箱中黑暗培养 2、4、6和8 h 后,用乳酸酚棉兰进行染色2 min,然后在光学显微镜下进行观察,计算孢子萌发率(%),芽管长度(μm)以及附着胞形成率(%).每个处理重复 3 次.
1.2.7.1 疏水性对A.alternata侵染结构的诱导 将已剪切Gelbond膜的亲水面、疏水面和在疏水面一侧涂有20、100 μL 的果蜡溶液的 Gelbond 膜朝上置于已清洗干净的载玻片上放置 12 h.对照组加入20 μLA.alternata孢子悬浮液,处理组将抑制剂SB203580(30 μmol/L)溶液加入A.alternata孢子悬浮液后,取20 μL滴加在样品表面进行培养,后续试验方法同1.2.7.
1.2.7.2 蜡质提取物对A.alternata侵染结构的诱导 用10 mL氯仿溶解提取的苹果梨蜡质、蜂蜡、石蜡各0.1 g,分别配制成约0.1%的蜡质溶液,吸取40 μL的果蜡、 60 μL蜂蜡、20 μL石蜡滴于Gelbond膜疏水面一侧,用涂布器均匀涂开后放置于已清洗干净的载玻片上静置12 h.对照组用20 μL的A.alternata孢子悬浮液,处理组吸取20 μL抑制剂SB203580 (30 μmol/L)处理过的A.alternata孢子悬浮液滴加在样品表面,后续试验方法同1.2.7.
1.2.7.3 乙烯利 将乙烯利用无菌水溶解成浓度为 1 、10 和100 μmol/L 的溶液,按一定比例加入A.alternata孢子悬浮液中,观察其侵染结构的形成(乙烯利溶液现配现用).
用无菌水将乙烯利溶解后按一定浓度比例加入抑制剂SB203580(30 μmol/L)处理过的孢子悬浮液中,对照组不加抑制剂,然后吸取20 μL滴加于Gelbond膜疏水面一侧,后续试验方法同1.2.7.
1.2.8 体内试验 样品的处理挑选大小、形状基本一致、无伤病的早酥梨果实浸泡于 2% 次氯酸钠溶液中,3 min后取出用清水冲洗,在室温下自然晾干.抑制剂SB203580处理对‘早酥梨’损伤接种后病斑直径的测定参照Montesinos-Herrero等[31]的损伤接种方法并略作修改.自然晾干后,用75%乙醇擦拭果实的赤道部位,接着用已灭菌的接种钉(直径 3 mm)均匀打孔(每个果实3个孔,深3 mm), 2 h后吸取20 μL经抑制剂处理过的A.alternata孢子悬浮液,接入孔内,室温下晾干后,装入市售PE保鲜袋( 25 cm×40 cm,厚度 0.02 mm)中,在室温((25±2)℃,RH 45%~55%)下贮藏,接种后每隔 1 d观察并测定果实表面的病斑直径.每个处理用果实 9 个,3 次重复.
1.3 数据处理
全部试验数据均采用Microsoft Excel 2010计算平均值和标准误,用SPSS 20.0软件对得到的数据进行Duncan’s多重比较差异显著性分析.
2 结果与分析
2.1 MAPK抑制剂对A.alternata生长及侵染结构的影响
2.1.1 MAPK抑制剂对A.alternata侵染结构分化的影响 MAPK抑制剂SB203580处理对A.alternata孢子萌发、附着胞形成和芽管伸长均具有一定的抑制作用(图1),除了芽管长度外(图1-C),其抑制作用均存在浓度依赖性(图1-A~B),处理后8 h,10、20、30 μmol/L抑制剂处理对其孢子萌发的抑制率仅为1.35%、3.04%和4.05%(P<0.05).SB203580显著地抑制了A.alternata附着胞的形成,培养8 h后,30 μmol/L SB203580处理A.alternata后附着胞形成率比对照组显著降低了64.24%(P<0.05)(图1-B).同时发现抑制剂对A.alternata芽管的伸长也具有抑制作用(图1-C).
2.1.2 MAPK抑制剂对A.alternata生长的影响 随着培养时间的延长,A.alternata菌落直径逐渐增大,但MAPK抑制剂SB203580处理与对照组相比其菌落形态和菌落直径均不存在显著性差异(P<0.05)(图2-A~B).

竖线表示标准误(±SE).小写字母代表显著性差异(P<0.05).Bars indicate standard error (±SE).Lower case letters represent significant differences (P<0.05).图1 不同浓度MAPK抑制剂SB203580对A.alternata孢子萌发率(A)、附着胞形成率(B) 和芽管长度(C)的影响Figure 1 Effects of different concentration MAPK in hibitor SB203580 on spore germination (A),apperssorium formation (B) and germ tube length (C) of A.alternata.

竖线表示标准误(±SE).小写字母代表显著性差异(P<0.05).Bars indicate standard error (±SE).Lower case letters represent significant differences (P<0.05).图2 MAPK抑制剂处理对A.alternata菌落生长(A)和菌落形态(B)的影响Figure 2 The effect of MAPK inhibitor treatment on mycelium growth (A) and morphology (B) of A.alternata
2.2 MAPK信号通路在果实表皮物理化学信号诱导A.alternata侵染结构形成中的作用
2.2.1 在疏水性诱导侵染结构形成中的作用 随着果蜡提取物涂膜量的增加,表面疏水性即接触角增大(表1).由图 3 可知,与亲水表面相比,高接触角的疏水表面显著地诱导A.alternata孢子萌发和附着胞的形成,培养2 h时,果蜡涂膜高疏水面(100.23°、108.33°)已有附着胞形成.培养4 h时,高疏水性表面(108.33°±0.55°)A.alternata附着胞形成率较Gelbond 亲水膜(31°±0.07°)和Gelbond疏水膜(74.63°±1.24°)分别提高14.4和2.5倍(图3-A).MAPK抑制剂SB203580处理期间,均能抑制A.alternata孢子萌发和附着胞形成,尤其显著地抑制了A.alternata附着胞形成,延迟了果蜡涂膜表面附着胞的形成时间,SB203580处理后2 h均不形成附着胞,8 h时,对疏水性表面附着胞形成的抑制率分别为41.01%、24.99%和22.85%(P<0.05) (图3-B).

表1 疏水性的测定
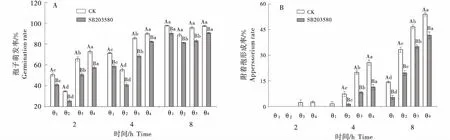
竖线表示标准误(±SE).大写字母代表对照与处理间显著性差异,小写字母代表不同处理间显著性差异(P<0.05).Bars indicate standard error (±SE).Capital letters represent significant differences between controls and treatments,and lowercase letters represent significant differences between treatments.图3 MAPK抑制剂对梨果蜡质疏水性诱导A.alternata 孢子萌发率(A)和附着胞形成率(B)的影响Figure 3 Effect of MAPK inhibitor on spore germination (A) and apperssorium formation (B) of A.alternata induced by hydrophobicity of pear fruit wax
2.2.2 在果皮蜡质诱导A.alternata侵染结构形成中的作用 同一疏水条件下(101.05°),以蜂蜡和石蜡为对照,果蜡能够显著诱导A.alternata孢子萌发(图 4-A)和附着胞的形成(图 4-B),且能提前附着胞的形成时间,培养2 h时果蜡涂膜表面诱导形成了附着胞,4 h后,果蜡涂膜表面的附着胞形成率分别是蜂蜡和石蜡涂膜表面的1.2和2.5倍.MAPK抑制剂SB203580处理后对不同蜡质膜表面的A.alternata孢子萌发和附着胞形成均具有一定的抑制作用,尤其抑制了附着胞的形成,2 h时果蜡涂膜表面不形成附着胞,培养4 h时,抑制剂对果蜡诱导表面A.alternata孢子萌发(图 4-A)和附着胞形成(图 4-B)的抑制率分别达到13.79% 和56.76% (P<0.05).
2.2.3 在乙烯利诱导A.alternata侵染结构形成中的作用 低浓度的外源乙烯(1 μmol/L)对A.alternata孢子萌发和附着胞形成具有促进作用,而高浓度具有抑制作用(表2).外源乙烯(1 μmol/L)处理后2 h时A.alternata孢子萌发率比对照提高了 19.24%(P<0.05),培育至6 h时附着胞形成率比对照提高了31.71%(P<0.05).由图5可知,MAPK抑制剂SB203580处理后显著抑制了外源乙烯诱导的A.alternata孢子萌发(图 5-A)和附着胞形成(图 5-B),培育2 h时,与对照组(1 μmol/L 外源乙烯)相比,其抑制率分别为17.01%和57.14%(P<0.05),其对附着胞的抑制作用更强,培养6h时,其对孢子萌发的抑制率仅为2.77%,而对附着胞的抑制率为20.47%(P<0.05).
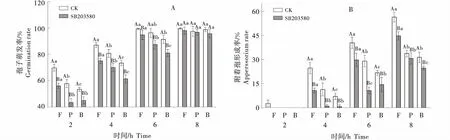
竖线表示标准误(±SE).大写字母代表对照与处理间显著性差异,小写字母代表不同处理间显著性差异(P<0.05).Bars indicate standard error (±SE).Capital letters represent significant differences between controls and treatments,and lowercase letters represent significant differences between treatments.图4 MAPK抑制剂对梨果蜡质(F)、石蜡(P)和蜂蜡(B)诱导A.alternata孢子萌发率(A)和附着胞形成率(B)的影响Figure 4 Effects of MAPK inhibitors on spore germination (A) and apperssorium formation (B) of A.alternata induced by pear fruit wax(F),paraffin (P) and beeswax (B)

表2 乙烯利对A.alternata侵染结构的影响
小写字母代表不同蜡质间显著性差异(P<0.05).
Lower case letters represent significant differences between different waxes (P<0.05).
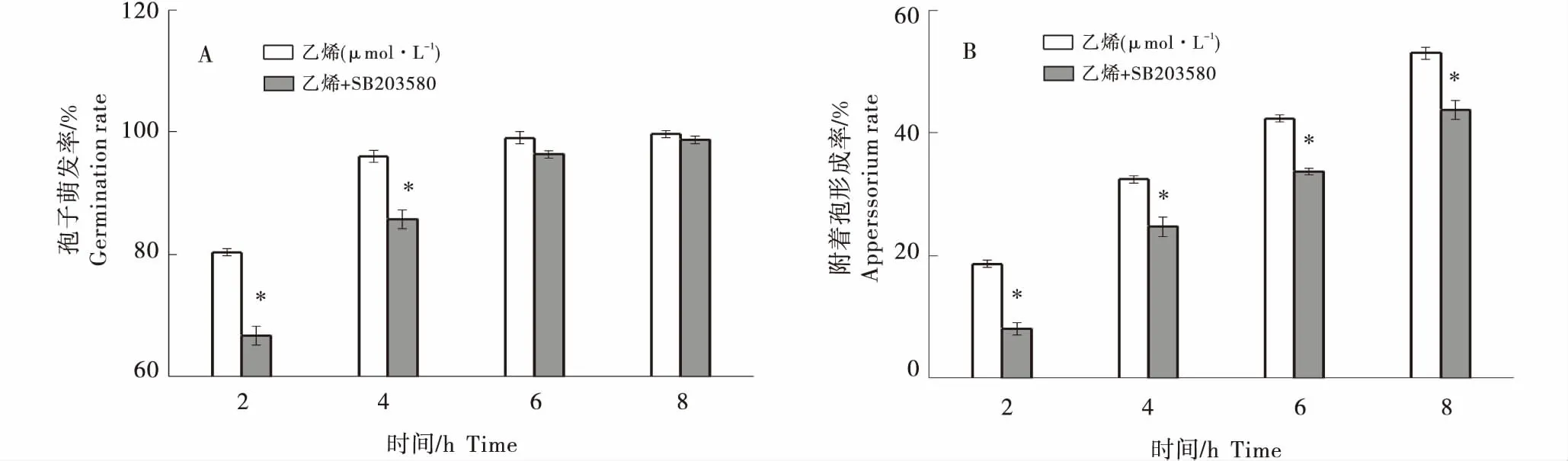
竖线表示标准误(±SE).* 代表不同蜡质间显著性差异(P<0.05).Bars indicate standard error (±SE).* represents a significant difference between different waxes (P<0.05).图5 MAPK抑制剂处理对乙烯利诱导A.alternata孢子萌发(A)和附着胞形成(B)的影响 Figure 5 The effect of MAPK inhibitor treatment on ethephon-induced A.alternata spore germination (A) and apperssorium formation rate (B)
2.3 MAPK参与A.alternata致病性的调控
由图6可以看出,接种A.alternata后随着贮藏时间的延长,对照和处理组果实病斑直径逐渐增大.经抑制剂处理后的第3天和第6天时,对其病斑直径的抑制率分别为35.74%和63.78%(P<0.05).
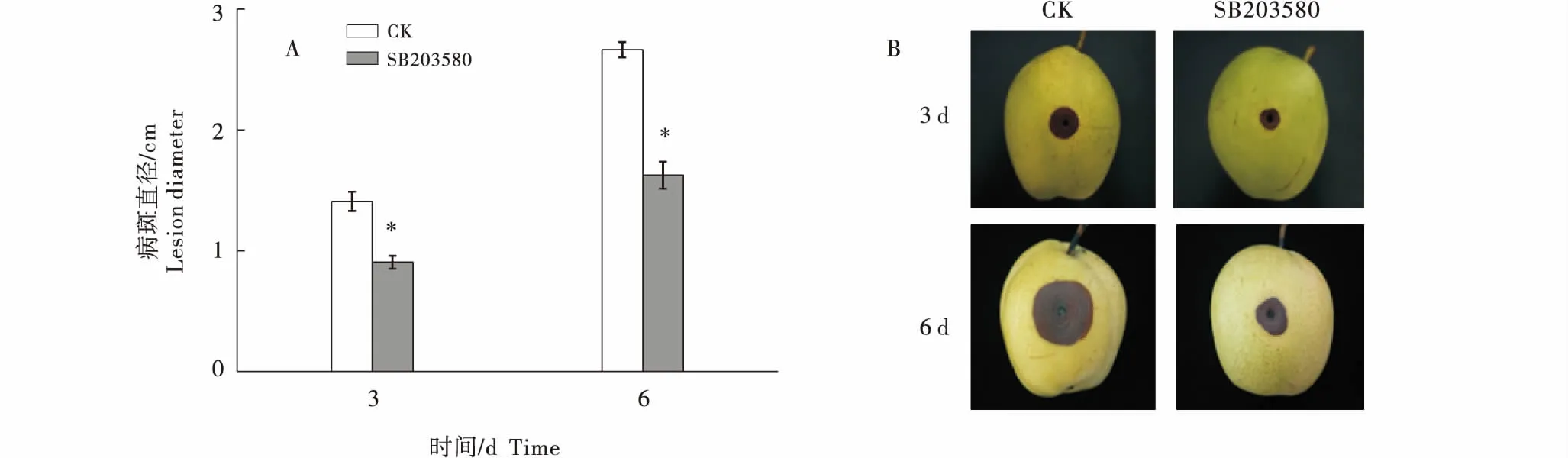
竖线表示标准误(±SE).*代表不同蜡质间显著性差异(P<0.05).Bars indicate standard error (±SE).*represents a significant difference between different waxes (P<0.05).图6 MAPK抑制剂A.alternata处理后对果实的病斑直径(A)和病斑形态(B)的影响Figure 6 The effect of MAPK inhibitor A.alternata on the lesion diameter (A) and lesion morphology (B) of the fruit
3 讨论
宿主表面物化信号如表皮蜡质、疏水性、植物激素等[18]对A.alternata侵入过程以及侵染结构的形成均具有一定的调控作用[4].本研究结果表明,不同蜡质对A.alternata侵染结构的诱导作用不同,较蜂蜡和石蜡涂膜而言,果蜡膜能够显著地诱导A.alternata孢子萌发和附着胞形成,且能提前附着胞的形成时间,培养4 h后,其表面附着胞形成率分别是蜂蜡和石蜡的1.2倍和2.5倍(图4-A),这与Liu等[10]的研究结果一致,与石蜡和蜂蜡相比,果蜡更易诱导A.alternata孢子萌发和附着胞形成,与此同时,近期研究发现植物表皮蜡质对病原物侵染结构分化的诱导还存在组分特异性,如大麦表皮蜡层的化学成分C26醛和水稻表皮蜡的伯醇强烈诱导了B.graminis和Magnaporthegrisea附着胞的形成[8,10].不仅蜡质组分能诱导病原物侵染结构的分化,其疏水性也具有诱导作用[10],高疏水性的表面能够诱导真菌附着胞的产生[10,32],试验中发现梨果蜡质提取物涂膜增加了Gelbond膜的接触角(表面疏水性)(表1),高接触角的疏水表面显著地诱导A.alternata孢子萌发和附着胞的形成,且培育2 h时,果蜡涂膜的高疏水面 (100.23°和108.33°) 已有附着胞形成(图3-B),唐瑛[4]在研究早酥梨蜡质对A.alternata侵染调控中也得到了相同结果.有研究表明 10~100 μL/L 外源乙烯利处理可促进B.cinere、P.expansum孢子萌发[33],而在我们的研究中发现,低浓度的外源乙烯(1 μmol/L)对A.alternata孢子萌发和附着胞形成具有促进作用,高浓度(10、50、100 μmol/L)反而起抑制作用(表2),表明果实成熟中产生的乙烯对采后病原物侵染具有一定的刺激作用,且不同病原物对外源乙烯的敏感性存在差异.
病原真菌通过感知和响应来自宿主表面的物理化学信号进而启动其侵染的过程.研究表明MAPK级联信号传导途径对病原真菌响应外界刺激后的生长、孢子形态、细胞壁完整性和致病毒力因子的表达具有不同程度的调节作用[17,34-35].在酿酒酵母S.cerevisiae[36]和C.lagenarium[37-38]中Fus3 /Kss1-MAPK 级联信号途径和相关激酶参(Cmk1、Maf1)与其附着胞分化和致病性密切相关.Alternariaspp.中Hog1-MAPK型途径涉及渗透和氧化应激,并且参与附着胞形成和致病性的调控过程[39].本研究发现用MAPK抑制剂SB203580作用于A.alternata孢子悬浮液后,对蜡质疏水性、化学组分及外源乙烯诱导条件下的孢子萌发、附着胞形成和芽管伸长均具有一定的抑制作用,除了芽管长度外(图1-C),其抑制作用均存在浓度依赖性(图1-A~B).Wu 等[40]发现将 Vasla mali 突变株ΔVmPmk1在PDA上培养2 d后,发现与野生型相比ΔVmPmk1菌株径向生长速率降低了约33%,而本研究用MAPK抑制剂SB203580溶液处理A.alternata后培养7 d,发现对其菌落生长和形态并无显著地影响,这表明不同菌株对抑制剂的敏感性存在差异.Lin 等[39]在对柑橘褐斑病菌(A.alternata)研究中发现,ΔAaHOG1菌株的致病力降低,S.cerevisiae的ΔMPSl菌株附着胞形成率显著减少且致病性减弱[41],我们研究发现将MAPK抑制剂SB203580处理过的A.alternata孢子悬浮液损伤接种于梨果体内,发现第6天时,其病斑直径比同期对照组显著降低了63.78%(图6),说明MAPK参与并调控A.alternata致病性.同时发现M.oryzae的ΔPMKI突变株仍能识别疏水信号且参与调控该病菌附着胞的形成[16];C.lagenarium的ΔCmk1突变株的分生孢子不能萌发[37],ΔMaf1突变株不形成附着胞且产生较长的胚芽管结构[38],这些结论表明MAPK级联途径对不同致病菌生长、侵染结构分化及致病性的调控存在差异,但其具体调控机理尚待阐明.
4 结论
MAPK信号级联通路的抑制剂SB203580处理显著地抑制了梨果蜡质疏水性、化学组分和外源乙烯等信号诱导A.alternata孢子萌发、芽管伸长及附着胞形成,同时也减弱了A.alternata在梨果上的致病力.说明MAPK信号级联通路可通过调控A.alternata侵染结构的形成从而影响其对梨果皮物理化学信号的识别和应答,因此推测MAPK信号通路对A.alternata感知或响应梨果皮物化信号进而启动侵染具有重要的调控作用.

