河西走廊‘贵人香’7个葡萄砧穗组合抗寒性的综合评价
任静,郝燕,白耀栋,朱燕芳,张思成
(1.甘肃省农业科学院林果花卉研究所,甘肃 兰州 730070;2.白龙江林业管理局河西综合开发局,甘肃 高台 734300;3.兰州市红古区经济作物技术推广站,甘肃 兰州 730080)
葡萄(Vitisvinifera)种植面积和产量仅次于柑橘,是世界第2大水果,也是我国主栽果树之一[1].其中,酿酒葡萄产业迅速发展,是葡萄发展不可或缺的一部分[2].中国河西走廊酿酒葡萄产区以得天独厚的地理资源优势成为葡萄酒原料的最适宜产区[3-4].‘贵人香’(Italian Riesling,IR)是该区酿造干白和冰白葡萄酒的主要品种,其产量高、品质好和营养价值高[5].但是,该产区冬季较为寒冷,出现持续低温或剧烈降温,春寒和冻害频繁发生等情况严重制约了‘贵人香’酿酒葡萄的生产,为了葡萄顺利越冬,必须‘埋土防寒’,但该方式成本高且费时费力[6].将优良的酿酒葡萄品种嫁接在抗冻性强的葡萄砧木上,可以不用埋土或少埋土使得葡萄越冬,减少埋土造成对枝条和根系的破坏,同时还可节省时间和成本.因此,利用抗寒性强的葡萄做砧木进行‘贵人香’酿酒葡萄营养系嫁接,筛选抗寒性较强的嫁接苗,是目前缓解和防止河西酿酒葡萄越冬冻害的有效措施之一.
鉴定葡萄砧穗组合的抗冻性,可以为抗冻酿酒葡萄的推广和生产提供科学的理论依据,因此果树抗寒性的综合评价是抗性育种的重要内容之一[7].前人研究表明,相对电导率、丙二醛含量、游离脯氨酸含量、可溶性糖含量、可溶性蛋白含量等指标与抗寒性有密切的关系[8].由于果树的抗寒性是多个数量性状和质量性状综合作用的结果,单一指标评价葡萄抗寒性是片面的[9],用多个指标进行综合性评价才是科学、准确的[10].曹建东等[11]通过模拟低温处理,对7个葡萄砧木的电导率、可溶性糖、可溶性蛋白、游离脯氨酸和丙二醛含量与抗寒性的关系进行研究,并通过主成分分析对不同葡萄品种的抗寒性进行了综合评价.施明等[12]利用主成分分析法,确定了8个酿酒葡萄品种的抗寒性强弱.王依[13]利用主成分分析法对4种酿酒葡萄的抗寒性进行评价.袁军伟等[14]测定11个葡萄品种根系的自由水、褐变指数等,结合主成分分析法对其进行聚类.目前,利用主成分分析评价葡萄抗寒性仅仅是集中于单个葡萄砧木或葡萄品种上,通过主成分分析结合聚类分析,并利用相关性分析对对葡萄砧穗组合的抗寒性进行综合评价少见报道.
因此,本研究在前人的研究基础上,模拟低温胁迫环境,通过测定‘贵人香’7个葡萄砧穗组合的抗寒性相关指标,利用主成分分析法、聚类分析法和相关性分析综合评价不同葡萄砧穗组合的抗寒性强弱,以期筛选出河西走廊‘贵人香’酿酒葡萄生产抗寒性强的砧穗组合.
1 材料与方法
1.1 试验园概况
试验园位于甘肃省高台县祁连酿酒葡萄基地,N 39°03′50″,E 98°57′27″,处于河西走廊中部,黑河中游下段.境内光照充足,温差大,干旱少雨;年均气温7.4 ℃,年日照时数3 118.3 h,全年无霜期150 d,年均降水量103 mm,蒸发量2 000 mm.土壤为沙质土,土层深厚,质地疏松,通透性好,导热性较高,利于排水,pH为8.15[15].
1.2 材料
2012年将‘贵人香(Italian Riesling,IR)’与‘5BB’‘5C’‘420’‘3309C’‘101-14MG’‘110R’‘1103P’(即为IR/5BB、IR/5C、IR/420、IR/3309C、IR/101-14MG、IR/110R、IR/1103P)7个砧木品种的砧穗组合进行嫁接处理,进行常规露地栽培管理.2016年采集长势良好且均匀一致的一年生休眠枝条,于0~10 ℃沙藏贮存.
1.3 方法
1.3.1 材料低温处理 2016年12月15日,第1步:将采回的一年生枝条用蒸馏水冲洗干净,再用剪刀将粗度一致的枝条每4~6节剪成一段,每个砧木品种3份,每份12~16段;第2步:先将蜡置于电热板上融化,再用蜡把枝条两端剪口密封,最后用保鲜膜和纱布将枝条包裹置于多波段低温培养箱(北京雅士林试验设备有限公司(GDJW-225型))中进行低温处理.试验处理温度分别为-15、-20、-25、-30、-35 ℃,从4 ℃(CK)开始,以4 ℃/h速率(每降低1 ℃保持15 min)降至处理温度,在处理温度下保持12 h,然后以4 ℃/h速率(每升高1 ℃保持15 min)升至4 ℃,保持8 h.以4 ℃贮藏的枝条为对照,每个处理重复3次.
1.3.2 测定指标 相对电导率参照王文举[16]:相对电导率(REC)=R1/R2×100%;丙二醛(MDA):硫代巴比妥酸(TBA)法;可溶性蛋白(SP):考马斯亮蓝G-250染色法[17];游离脯氨酸(Pro):茚三酮比色法[18];可溶性糖(SS):蒽酮比色法[19].
1.4 数据处理
用Excel对试验数据进行处理并作图;利用SPSS 22.0软件采用Duncan多重比较进行显著性方差分析,P<0.05为差异显著;采用SPSS 22.0进行描述性分析,再进行主成分分析和聚类分析.利用R语言软件采用Pearson作相关性分析,并作图.
2 结果与分析
2.1 不同低温对各葡萄砧穗组合枝条抗寒性指标的影响
由图1-A可知,随处理温度降低,各砧穗组合的相对电导率总体呈‘降低-升高-降低’的变化趋势.其中IR/110R、IR/1103P和IR/420的相对电导率在4~-15 ℃处理期间急剧下降,当温度为-15 ℃时,IR/420的相对电导率降至最低,为55.61%;温度在-15~-20 ℃处理期间,IR/101-14MG、IR/5C、IR/110R、IR/5BB和IR/1103P的相对电导率缓慢升高,IR/420的相对电导率在-20 ℃时急剧增加,是-15 ℃处理下的1.49倍;在-20~-30 ℃处理期间,IR/3309C和IR/101-14MG的相对电导率急剧增加,且IR/101-14MG在-30 ℃时出现峰值,为101.65%,比4 ℃下增加了0.30倍,而IR/5C的相对电导率缓慢升高;各砧穗组合的相对电导率在-30~-35 ℃处理期间急剧下降,IR/110R比其它组合下降较快.
由图1-B可知,各砧穗组合的丙二醛含量随处理温度降低呈‘降低-升高-降低’的变化.IR/3309C、IR/101-14MG、IR/5C、IR/110R、IR/5BB、IR/1103P和IR/420的丙二醛含量在4~-15 ℃处理期间呈缓慢下降趋势,IR/1103P的降幅最大,比4 ℃下的降低了47.69%;在-15~-35 ℃处理期间,IR/3309C、IR/5C、IR/101-14MG的丙二醛含量变化平稳,先上升后下降.在-15~-25 ℃处理期间,IR/420、IR/1103P、IR/110R、IR/5BB的丙二醛含量急剧升高,其中IR/420在-25 ℃处理下最高,为9.05 nmol/g;在-25~-35 ℃处理期间,4个砧穗组合的丙二醛含量急剧下降,其中IR/110R的丙二醛含量均低于其他砧穗组合,在-35 ℃时降至最低,为1.85 nmol/g,相比于4 ℃下降低了56.84%.
由图1-C可知,各砧穗组合的游离脯氨酸含量随处理温度降低表现为‘降低-升高-降低’.在4~-25 ℃处理期间,IR/3309C的游离脯氨酸缓慢降低,在-25~-35 ℃处理期间,其急剧升高,且在此期间均高于其他砧穗组合,在-35 ℃时最高,为39.95 μg/g,是4 ℃下的1.89倍.在4~-20 ℃处理期间,除了IR/3309C,其他砧穗组合均急剧下降,且IR/1103P降低幅度最大,比4 ℃下降低了87.66%.在-15~-35 ℃处理期间,IR/5BB、IR/110R、IR/1103P的游离脯氨酸含量变化幅度较小,且缓慢上升,其中IR/110R的游离脯氨酸含量在-15 ℃时为最低,为4.81 μg/g,比4 ℃下降低了86.86%.在-20~-25 ℃处理期间,IR/420、IR/101-14MG、IR/5C的游离脯氨酸含量急剧升高,分别比-20 ℃提高了3.28倍、2.11倍和2.31倍.
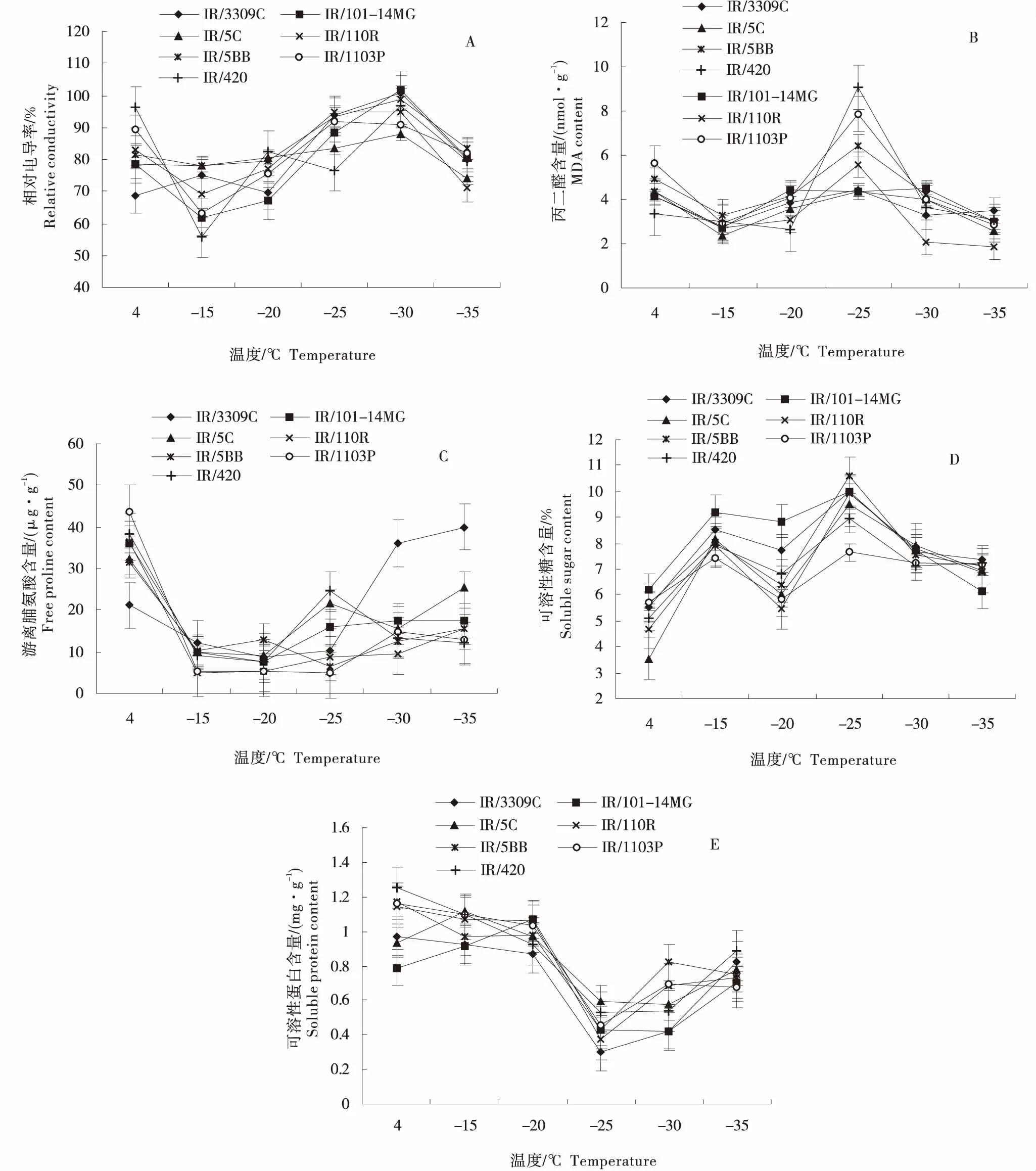
图1 不同低温对各葡萄砧穗组合抗寒性指标的影响Figure 1 The influence of low temperature on cold resistance indexes of different grape stock-scion combinations
由图1-D可知,各砧穗组合的可溶性糖含量随处理温度降低表现为‘升高-降低-升高’.各砧穗组合的可溶性糖含量在4~-15 ℃时均急剧升高,其中IR/5C砧木可溶性糖含量在4 ℃时最低,为3.55%,而IR/101-14MG在-15 ℃时最高,为9.22%,比4 ℃下增加了0.49倍;各砧穗组合的可溶性糖含量在-15~-20 ℃缓慢降低,在-20~-25 ℃均急剧升高,IR/5BB在-25 ℃时出现峰值,为10.61%;IR/3309C、IR/101-14MG、IR/5C、IR/110R和IR/5BB的可溶性糖含量在-25~-35 ℃处理间均急剧降低,相比于-25 ℃,在-35 ℃分别降低了26.60%、38.55%、26.90%、30.81%和33.08%,而IR/1103P和IR/420的可溶性糖含量则缓慢降低.
由图1-E可知,各砧穗组合的可溶性蛋白含量随处理温度降低总体呈先降后升的变化趋势.在4~-15 ℃时,IR/3309C、IR/110R、IR/5BB、IR/1103P和IR/420可溶性蛋白含量缓慢降低,而IR/101-14MG和IR/5C缓慢升高;在-15~-25 ℃时,各砧穗组合的可溶性蛋白含量急剧下降,IR/3309C可溶性蛋白含量在-25 ℃时降至最低,为0.31 mg/g,相比于4 ℃,降低了68.63%;在-25~-35 ℃时,各砧穗组合的可溶性蛋白含量均升高,IR/3309C的急剧升高,相比于-25 ℃,在-35 ℃下增加了1.70倍.
2.2 抗寒性综合评价
主成分的特征值和贡献率是选择主成分的依据,主成分碎石图可以用来确定最优的主成分数目,横坐标表示主成分数目,纵坐标表示特征值,主成分特征值的连线陡峭部分即为应取的主成分数目.本试验中,经过主成分分析将7个葡萄砧穗组合的5个与抗寒性有关的叶片指标进行了转化,根据特征值大于1和方差贡献率最优的主成分数,由图2可知,前2个主成分的特征值较大,连线较为陡峭,由提取2个主成分最合适,提取其累积方差贡献率为76.93%,综合了大部分信息.第1主成分特征值为2.733,贡献率为54.659%(表1),电导率和可溶性蛋白的载荷值和得分系数均高于其他指标(表2).第2主成分特征值为1.114,贡献率为22.277%(表1),丙二醛和可溶性糖含量的载荷值和得分系数均高于其他指标(表2).
每个主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重,计算7个葡萄砧穗组合的综合主成分值作为综合得分.7个葡萄砧穗组合的抗寒性有强到弱的顺序为:IR/1103P>IR/5BB>IR/420>IR/110R>IR/5C>IR/101-14MGMG>IR/3309C(表3).
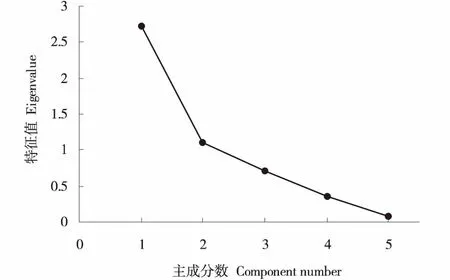
图2 主成分分析碎石图Figure 2 Screen plot of PCA (principal component analysis)

因子Component初始特征根 Initial eigenvalues特征值Eigenvalues贡献率/%Contribution rate累积贡献率/%Cumulative contribution rate12.73354.65957.65921.11422.27776.935
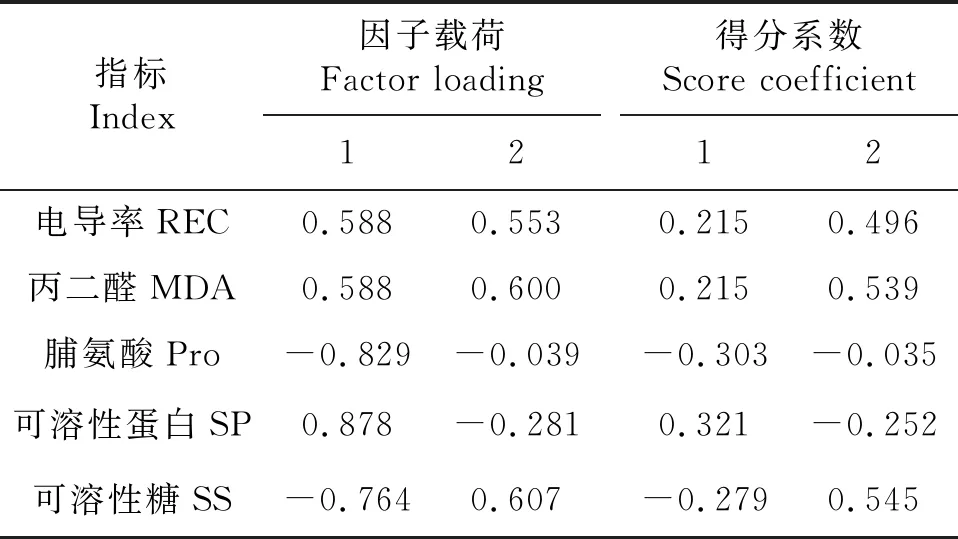
表2 7个葡萄砧穗组合抗寒性的主成分载荷矩阵

表3 7个葡萄砧穗组合抗寒性2个主成分综合得分及其排名
2.3 聚类分析
将7个葡萄砧穗组合的相关指标做聚类分析,聚类方法采用Ward法.由图4可以看出,7个组合可分为3类.第Ⅰ类为IR/3309C、IR/101-14MG,抗寒性最弱;第Ⅱ类为IR/5C、IR/420、IR/110R,抗寒性次之;第Ⅲ类为IR/5BB、IR/1103P,抗寒性最强.用主成分分析法得出的结论与聚类分析所得结果相一致.

图3 聚类分析谱系图Figure 3 Dendrogram of HCA (hierarchical cluster analysis)
2.4 相关性分析
为了进一步研究5个抗寒性指标间的协同变异程度,对7个不同砧穗组合的相对电导率、丙二醛、脯氨酸、可溶性蛋白、可溶性糖及主成分综合得分进行了相关性分析.由图4可以看出,综合得分F与REC(0.75)、MDA(0.77)、Pro(-0.78)和SP(0.71)4个指标之间的相关系数(r)均达到了极显著水平,说明可以用主成分综合得分来代表其他4个指标,综合评价葡萄砧穗组合抗寒性的大小.

F:综合得分;REC:相对电导率;MDA:丙二醛;Pro:脯氨酸;SP:可溶性蛋白;SS:可溶性糖.黑色圆圈代表显著正相关,白色圆圈代表显著负相关,圆圈大小代表显著性大小,分别于左下角的数字对应.Black dircels repesent a significant positive correlation,white circles repressent a significant nagutive correlation,circles size represent significant size and corresponds to the number in the lower left corner.图4 7个葡萄砧穗组合抗寒指标间的相关性分析Figure 4 Correlative analysis of indices for 7 grape scion-stock combinations cold resistance
3 讨论
本试验在测定‘贵人香’7个葡萄砧穗组合的相对电导率、丙二醛、游离脯氨酸、可溶性糖和可溶性蛋白等抗寒指标的基础上,利用主成分分析法综合评价得出河西走廊葡萄砧穗组合IR/1103P抗寒性较强.本研究的开展,为进一步筛选出河西走廊‘贵人香’抗寒性强的葡萄砧穗组合奠定基础.
相对电导率是鉴定果树抗寒性的重要指标之一[20-21].本研究表明,随处理温度降低,7个砧穗组合的电导率呈先降后升再降的趋势,电导率下降可能是由于砧穗组合受冻害较轻,膜透性增加程度较小,易于恢复;电导率均上升,可能是由于受冻害严重,细胞膜透性大大增加,导致不能恢复.在4~-15 ℃处理期间,IR/110R、IR/1103P、IR/420的电导率急剧下降,可能是由于植株通过冻融循环,保持原有性质.IR/101-14MG、IR/5C、IR/110R、IR/5BB、IR/1103P的电导率缓慢上升,表明在此温度胁迫下,砧穗组合有保持细胞膜完整性的能力,与张连杰等[22]的4个葡萄砧木相对电导率变化结果相符合.在-20~-30℃处理期间,IR/3309C、IR/101-14MG的电导率急剧升高,IR/101-14MG达峰值,表明低温胁迫使得体内膜流动性明显降低,通透性增加,造成细胞内溶质外渗[23].在-30~-35 ℃处理期间,各砧穗组合的电导率含量降低,可能是由于强低温胁迫,植株体内细胞的质膜受到不可逆的损伤,电解质外渗已达极限,植株为了进一步抵御低温胁迫,可能触发了质膜Ca2+-ATPase,以维持细胞内Ca2+水平的动态平衡,使得电导率下降[24].
在低温条件下,丙二醛与细胞膜损坏程度有关[25].本研究发现,随处理温度降低,各葡萄砧穗组合丙二醛含量呈降-升-降的趋势,说明不同砧穗组合受到低温胁迫时,体内活性氧代谢平衡发生变动,其氧化过程增强,对细胞膜造成了损伤.在-15~-25 ℃处理期间,IR/3309C、IR/5C、IR/101-14MG的丙二醛含量缓慢上升,IR/420、IR/1103P、IR/5BB、IR/110R的则急剧升高,由此可知不同砧穗组合在低温胁迫时膜脂过氧化程度不同,且对于低温的响应程度不用,与谢丽芬等[26]在6个引种葡萄的MDA含量明显增加研究结果一致.在-25~-35 ℃处理期间,IR/420、IR/1103P、IR/5BB、IR/110R的丙二醛含量急剧下降,可能是砧穗组合对于强低温胁迫的一个响应敏感区域,忍受低温的临界点.IR/420在-25℃处理下的丙二醛含量最高,可见该砧穗组合的细胞内自由基代谢平衡被破坏的较为严重[27].
游离脯氨酸、可溶性糖和可溶性蛋白的积累,有助于抗寒性的提高[28].本研究中,随着胁迫温度的降低,‘贵人香’7个葡萄砧穗组合的游离脯氨酸呈降-升-降的趋势.在4~-15 ℃处理期间,各砧穗组合可能为了响应胁迫,产生抗性蛋白,抵御胁迫,脯氨酸作为蛋白质的组成成分而降低.在-25~-35 ℃处理期间,IR/3309C的脯氨酸含量急剧升高,显著高于其他砧穗组合;在-15~-35 ℃处理期间,IR/5BB、IR/110R、IR/1103P的脯氨酸含量缓慢上升;在-20~-25 ℃处理期间,IR/420、IR/101-14MG、IR/5C的脯氨酸含量急剧升高,表明脯氨酸的积累可能是为了促进植株体内蛋白质的水合作用,增大亲水面积,缓解低温伤害[29],这与王淑杰[30]和艾琳[31]的研究结果相似.与此同时,不同砧穗组合对于低温胁迫的响应温度不同,这可能是由于组合的亲和性与砧木的品种有关,IR/5BB、IR/110R、IR/1103P的脯氨酸变化缓慢,可见对低温胁迫的适应能力较强,而IR/3309C对于低温胁迫的反应最为强烈,可知该组合对于低温的适应能力较差.同时在4~-20 ℃处理期间,除了IR/3309C,其他砧穗组合均急剧下降,且IR/1103P降低幅度最大,表明IR/1103P在低温胁迫初期,已经启动了防御体系,协调细胞氧化还原势的生理生化作用,激发对低温的适应性反应[32].
在植物体内,可溶性糖提高,可以降低水势,增加保水能力,从而使冰点下降,提高植物抗寒能力[33].本研究中,在4~-15 ℃时,各砧穗组合的可溶性糖含量均急剧升高,表明在低温胁迫初期,植物体内通过积累可溶性糖,可能是通过糖代谢相关的代谢途径形成保护性位置,以便提高抗性[34].其中IR/101-14MG在-15 ℃时最高,表明该砧穗组合的响应程度较大,且受胁迫程度较其他组合深.在-15~-20 ℃时,各砧穗组合的可溶性糖含量缓慢降低,表明各组合通过调节体内的代谢途径,慢慢适应胁迫.在-20~-25 ℃时,各砧穗组合的可溶性糖含量急剧升高,可见该低温胁迫,再次打破代谢平衡,产生更多的糖缓冲细胞质的过度脱水,保护体内原生质胶体不至遇冷凝固[35].
可溶性蛋白的含量与植物的抗冷性之间存在密切关系,且在低温胁迫下,其含量增加[36].本研究中,随着胁迫温度的降低,各砧穗组合的可溶性蛋白呈先降后升的变化趋势.在4~-15 ℃时,IR/3309C、IR/110R、IR/5BB、IR/1103P和IR/420可溶性蛋白含量缓慢降低,表明砧穗组合为了适应低温胁迫,体内的可溶性蛋白束缚水分,减少原生质,防止细胞结冰;而IR/101-14MG和IR/5C缓慢升高,可能体内可溶性蛋白不够用,通过可溶性蛋白质的增加提高抗性.在-15~-25 ℃时,各砧穗组合的可溶性蛋白含量急剧下降,在此低温胁迫期间,可能是由于植株体内蛋白质降解速率加强或合成变缓.在-25~-35 ℃时,各砧穗组合的可溶性蛋白上升,其中IR/3309C急剧升高,表明由于强低温的诱导,各砧穗组合体内可能产生了胚胎发育晚期丰富蛋白、抗冻蛋白、保护其他酶类的蛋白质等与提高植物抗寒性、保护细胞免受冻害的功能性蛋白质,建立平衡,进而使得可溶性蛋白含量的上升[37].
但是,抗寒性仅用单一指标很难评价[38].因此,结合主成分分析、聚类分析和相关性分析综合评价抗寒性强弱,既全面,又准确.主成分分析中第1主成分电导率和可溶性蛋白的载荷值和得分系数最高,第2主成分丙二醛和可溶性糖含量的载荷值和得分系数最高,说明这四个指标是葡萄砧穗组合抗寒性的首要响应指标,也可作为河西走廊葡萄砧穗组合抗寒性强弱鉴定的生化指标.本试验中葡萄砧穗组合的抗寒性由强到弱为IR/1103P>IR/5BB>IR/420>IR/110R>IR/5C>IR/101-14MG>IR/3309C.高登涛[39]在引入石河子地区的5个葡萄砧木抗寒性比较一文中研究表明其葡萄砧木抗寒性5BB>5C>420A>110R.高振[40]在对葡萄砧木和栽培品种抗寒性的评价结果表明在山东抗寒性5BB>110R>3309C>1103P.本试验与前人研究结果有所不同,可能是由于接穗与砧木之间相互作用、生长环境以及嫁接亲和性均对葡萄砧穗组合的抗寒性产生影响[41-43].聚类分析结果与主成分分析结果相一致,根据二者之间的共性,第Ⅰ类为IR/3309C、IR/101-14MG,抗寒性最弱;第Ⅱ类为IR/5C、IR/420、IR/110R,抗寒性次之;第Ⅲ类为IR/5BB、IR/1103P,抗寒性最强.综上可知,在河西走廊葡萄产区,IR/5BB和IR/1103P砧穗组合适宜推广栽植.

