全氟辛烷磺酸对哮喘小鼠炎症反应的影响
曹文锐,任静,贺妮楠,陈静,秦小迪,董光辉,曾晓雯
广州市环境污染与健康风险评价重点实验室,中山大学公共卫生学院预防医学系, 广州 510080
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)是近年来引起科学家们关注的一种持久性有机污染物,广泛应用于工业生产和生活用品中,如润滑剂、织物整理剂、涂料和食品包装材料等[1]。已有的研究表明PFOS对免疫系统、肝脏系统和肾脏系统等多器官均有毒性。哮喘是一种以慢性气道炎症为特征的特异性疾病,其免疫学机制主要表现在Th1/Th2细胞免疫平衡失调并以Th2型细胞免疫占优势的免疫反应[2-3]。人群流行病学研究结果显示,PFOS暴露与哮喘的发生、发展之间存在一定的相关性[4-5],如哮喘儿童体内的PFOS浓度与哮喘的严重程度、血清IgE水平呈正相关[4]。但是,PFOS对哮喘发生发展的免疫毒性机制仍未明确。有实验研究发现,PFOS暴露可引起小鼠Th1和Th2型细胞因子及多种炎性细胞因子分泌失衡,使机体免疫功能偏向于Th2型免疫应答[6-7],此外,PFOS暴露可加重卵清蛋白(ovalbumin, OVA)致敏小鼠气道高反应性,升高血清IgE水平,表明PFOS有促进机体发生哮喘的倾向,但不同实验结果并不完全一致[8-9]。因此,建立哮喘小鼠模型能更有利于探讨PFOS在诱导机体哮喘发展进程中的作用机理。
基于以上研究结果,本研究拟通过建立PFOS暴露的哮喘小鼠模型,从Th1/Th2炎症反应的角度探讨PFOS暴露对哮喘发展的影响。
1 实验方法(Experimental methods)
1.1 实验对象与分组
清洁级(SPF级)6~8周成年雄性C57BL/6J小鼠36只,购自中山大学动物实验中心(许可证号:SCXK(粤)2011-0029),适应性饲养7 d后,将小鼠称重编号,按随机数字表法均分为6组,每组6只。
1.2 动物染毒及模型建立
整个实验过程分为2个阶段:
(1)第一阶段为PFOS染毒:将白色粉末状PFOS钾盐(纯度≥98%,Sigma-Aldrich,St. Louis,MO,USA)溶于体积分数为2%的Tween-80溶液(Sigma-Aldrich, St. Louis, MO, USA)中配制成PFOS溶液。根据文献报道,在职业人群中PFOS的血清浓度中值为10 400 ng·mL-1(82.6~31 400 ng·mL-1),普通人群中PFOS血清浓度中值为26.25 ng·mL-1(8.53~99.37 ng·mL-1)[10-11],因此参考职业人群和普通人群血清中PFOS暴露情况,我们将染毒剂量设置为0.1、1、5和10 mg·kg-1·d-1,并设置对照组及OVA单独组。给予2% Tween-80,小鼠每天经口灌胃染毒,连续7 d,前述研究结果显示OVA致敏模型的炎症反应已远高于单纯PFOS染毒组的效应(数据待发表),因此,在此次7 d的短期染毒实验中没有再设置单纯的PFOS染毒组。模型制作期间每日记录小鼠体重及基本情况。
(2)第二阶段为哮喘模型建立:从第8天开始使用OVA诱导哮喘小鼠模型(图1),第二阶段无PFOS染毒处理。对照组仅注射含5 mg Al(OH)3的100 μL PBS悬液,Al(OH)3购自Sigma-Aldrich(St. Louis, MO, USA),其余各组均在第8和14天腹腔注射OVA致敏液(50 μg OVA+5 mg Al(OH)3+100 μL PBS悬液),第22天起进行1% OVA雾化(30 min·d-1),每日一次,诱发哮喘。
染毒及模型制作期间每日观察并记录小鼠饲养情况如体重、饮食饮水量、体征、精神状态及活动等。实验过程如图1所示。
1.3 样本收集和脏器系数计算
胸腺、肾脏、肝脏、脾脏和肺脏采集:对小鼠进行体重称量并记录后,对小鼠进行颈椎脱臼处死,分离出完整的肝脏、脾脏、肾脏、肺脏及胸腺处理后,计算各脏器的脏器系数。
1.4 肺泡灌洗液(BALF)收集及有核细胞和嗜酸性粒细胞计数
(1)有核细胞总数计数:收集小鼠BALF,离心后分离细胞及上清液,上清液置于-80 ℃冰箱保存待用。细胞沉淀重悬于红细胞裂解液中去除红细胞,离心后重悬于200 μL PBS,细胞计数板镜下计细胞总数。

图1 实验流程图注:PFOS表示全氟辛烷磺酸,OVA表示卵清蛋白,I.P.表示腹腔注射。Fig. 1 Experimental flow chart Note: PFOS stands for perfluorooctane sulfonate; OVA stands for ovalbumin; I.P. stands for intraperitoneal injection.
(2)嗜酸性粒细胞计数:将上述重悬于PBS中的细胞进行涂片,多聚甲醛固定,吉姆萨染液染色后,镜下计数嗜酸性粒细胞,每张涂片上计数200个细胞以上,并计数嗜酸性粒细胞所占百分比。
1.5 肺组织切片及HE和PAS染色
1.6 BALF中细胞因子IL-5、IL-4和IFN-γ测定
用Luminex技术测定BALF中Th1细胞分泌的主要细胞因子IFN-γ和Th2细胞分泌的主要细胞因子IL-4、IL-5的水平。试剂盒来源于美国eBioscience公司,按照试剂盒说明书进行操作。
1.7 统计学分析
采用SAS 9.2统计软件进行数据分析。结果用均数和标准差表示。多组间均数比较经方差齐性检验后采用单因素方差分析,各实验组与对照组用Dunnett's法比较,并做整体的趋势检验。
2 结果(Results)
2.1 各组小鼠体重变化和脏器系数
各组小鼠体重变化和脏器系数如表1所示,各组间体重变化、脾脏系数、肺脏系数及胸腺系数均无明显差异。肝脏系数在10 mg·kg-1·d-1PFOS+OVA组显著高于OVA单独组(P<0.05),并且肝脏系数随PFOS暴露浓度增加而上升,肾脏系数随PFOS浓度增加而降低,上升及下降趋势均具有统计学意义(P<0.05)。
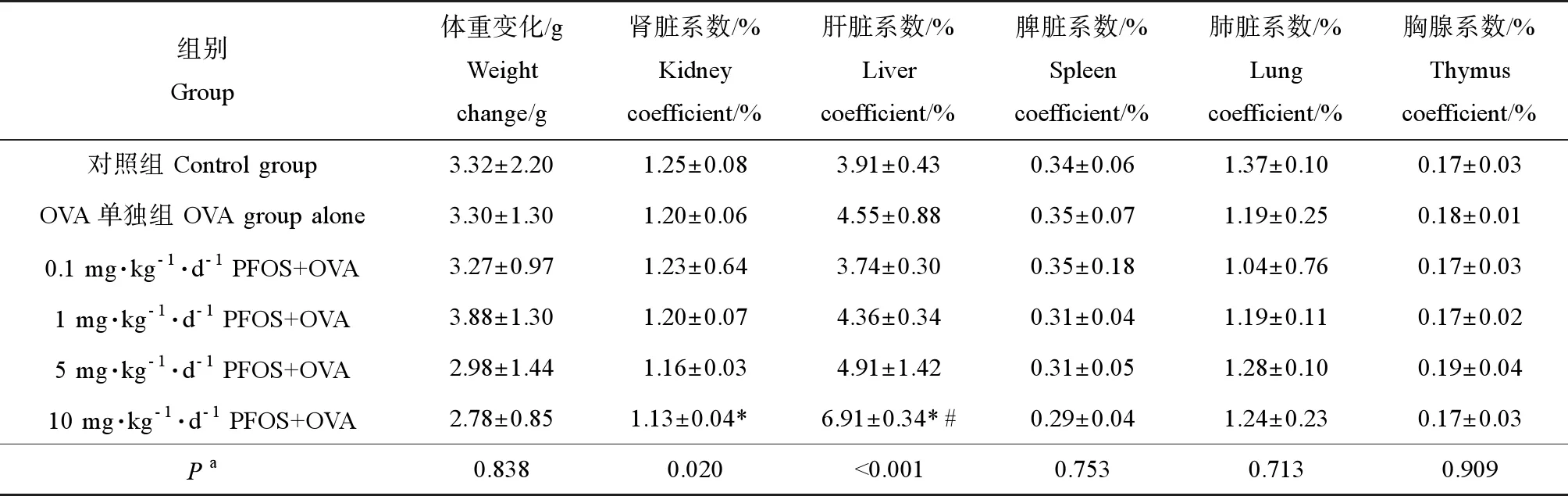
表1 各组小鼠体重变化和脏器系数Table 1 Weight change and organ coefficient of mice in each group
注:*与对照组比较(P<0.05),# 与OVA单独组比较(P<0.05);a不同处理组间的趋势检验。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.
2.2 各组小鼠BALF中的白细胞总数和嗜酸性粒细胞计数
如表2所示,10 mg·kg-1·d-1PFOS+OVA组BALF中的白细胞总数显著高于OVA单独组(P<0.05),其余组与OVA单独组相比无明显差异。随PFOS暴露浓度的增加,嗜酸粒细胞总数呈上升趋势,且该趋势具有统计学意义(P<0.05)。
2.3 各组小鼠的细胞因子水平
如表3所示,10 mg·kg-1·d-1PFOS+OVA组的IL-4水平显著高于OVA单独组(P<0.05);10 mg·kg-1·d-1PFOS+OVA组的IL-4/IFN-γ比值显著高于OVA单独组;IL-4、IL-5水平和IL-4/IFN-γ、IL-5/IFN-γ比值均随PFOS浓度的增加而增加(P<0.05),且趋势具有统计学意义;IFN-γ水平随PFOS浓度变化的趋势并无统计学意义。
2.4 各组小鼠肺组织病理形态学改变
如图2所示,与对照组相比(图2-A),各哮喘组小鼠均可见支气管管壁增厚,气道粘膜、粘膜下和小血管周围可见大量炎症细胞浸润,肺泡结构紊乱(图2-B~F)。随着PFOS染毒剂量的增加,小鼠支气管壁明显增厚。与单独OVA组相比,10 mg·kg-1·d-1PFOS+OVA组小鼠气道粘膜及粘膜下层厚度更厚,且炎症细胞浸润更明显(见图F);在图2-G~L中可以看到,对照组小鼠气道未见杯状细胞增生、无明显的黏液分泌(图2-G),而在各模型组中小鼠气道黏液层增厚明显、杯状细胞显著增生,并且与OVA单独组相比,气道黏液层厚度、杯状细胞增生情况随染毒剂量的增加而加重(图2-H~L)。
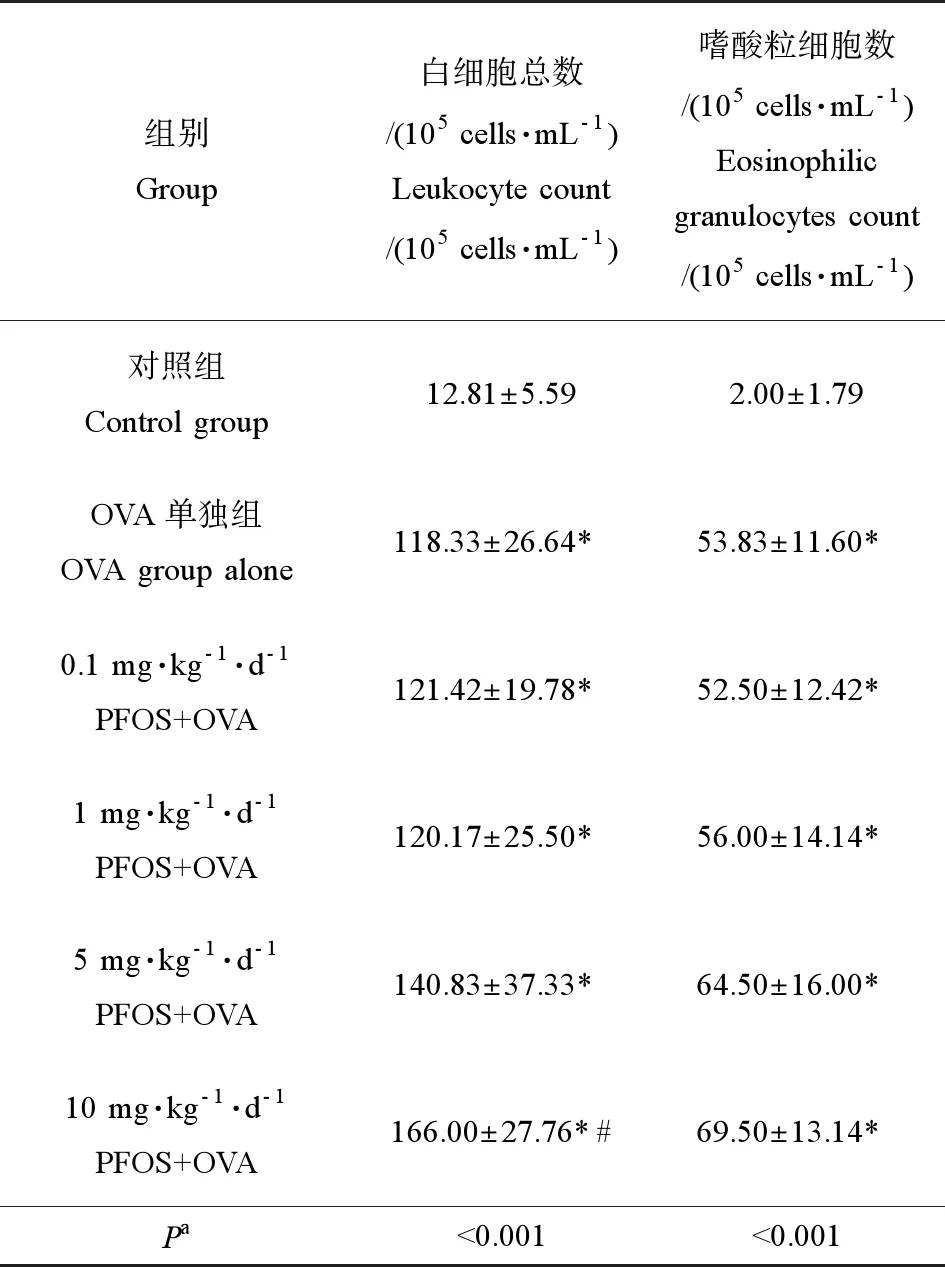
表2 各组小鼠肺泡灌洗液(BALF)中的有核细胞 总数和嗜酸性粒细胞数Table 2 The total number of nucleated cells and eosinophilic granulocytes in bronchoalveolar lavage fluid (BALF) of mice from each group
注:* 与对照组比较(P<0.05),# 与OVA单独组比较(P<0.05);a不同处理组间的趋势检验。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.
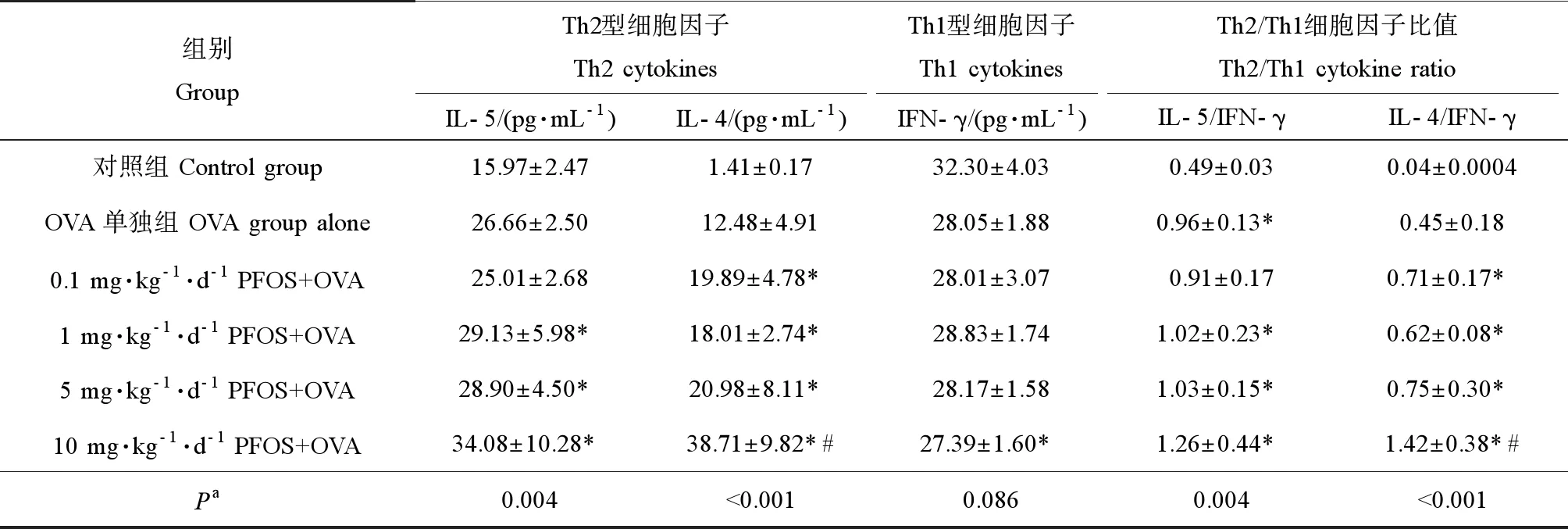
表3 各组小鼠BALF中细胞因子水平Table 3 The level of cytokines in BALF of mice from each group
注:* 与对照组比较(P<0.05),# 与OVA单独组比较(P<0.05);a不同处理组间的趋势检验。
Note: * compared with control group (P<0.05); # compared with OVA alone (P<0.05);atrend testing between different treatment groups.

图2 小鼠肺组织病理切片HE染色(A~F) (100×)和PAS染色(G~L)(100×)注:A、G为对照组,B、H为单独OVA组,C、I为OVA+0.1 mg·kg-1·d-1 PFOS组,D、J为OVA+1 mg·kg-1·d-1 PFOS组,E、K为OVA+ 5 mg·kg-1·d-1 PFOS组,F、L为OVA+10 mg·kg-1·d-1 PFOS组。* 炎症细胞,→ 杯状上皮细胞。Fig. 2 HE staining (A-F) (100×) and PAS staining (G-L) (100×) in lung tissue pathology sections of mice Note: A, G are control group; B, H are OVA group alone; C, I are OVA +0.1 mg·kg-1·d-1 PFOS; D, J are OVA+1 mg·kg-1·d-1 PFOS; E, K are OVA+5 mg·kg-1·d-1 PFOS; F, L are OVA+10 mg·kg-1·d-1 PFOS. * inflammatory cells; → goblet epithelial cells.
3 讨论(Discussion)
虽然国际上许多国家和组织如美国、加拿大和欧盟等已限制了PFOS的生产和使用,但在中国目前仍未有关于限制PFOS生产和使用的法律条文,仍在大量生产和使用PFOS,是全球主要的PFOS生产国之一[12-13]。PFOS在人体内半衰期长达5.4年,容易在人体内蓄积引起健康有害效应[14],而根据文献报道,PFOS在我国人体内的含量仍处于较高水平[15]。已有流行病学研究报道全氟化合物暴露与哮喘患病风险具有关联,但结论和机制并不完全一致[4-5]。Dong等[4]对台湾哮喘儿童进行病例对照研究(哮喘组n=231,对照组n=225),结果显示,儿童血清PFOS浓度与哮喘发生显著正相关,血清PFOS浓度最高四分位数组的哮喘比例比最低四分位数组高163%(95%Confidence Interval (CI): 48%~369%)。哮喘儿童的哮喘相关血清生物标志物免疫球蛋白E(IgE)和嗜酸性粒细胞阳离子蛋白水平与PFOS浓度呈正相关,且随血清PFOS浓度的增加而增高。Humblet等[5]对美国12~19岁的儿童开展了全氟化学物暴露和哮喘相关性的横断面研究(n=1 877),结果显示,血清PFOS浓度与哮喘有负关联性(odds ratios (ORs): 0.88, 95%CI: 0.74~1.04),而血清PFOA浓度与哮喘发生呈正相关(ORs: 1.18, 95%CI: 1.01~1.39)。
哮喘发生的重要免疫学机制之一是Th1/Th2细胞免疫平衡失调,以Th2细胞免疫占优势的免疫反应在哮喘发病的整个炎症过程以及气道重构过程中都起着重要的作用[16]。本研究成功建立了小鼠哮喘模型,实验结果表明,PFOS可加重哮喘小鼠肺部支气管重塑和炎症细胞浸润。
细胞因子分泌水平是反映免疫细胞活化程度的重要指标之一。本实验发现,小鼠肺泡灌洗液的IL4、IL5水平和IL5/IFN-γ、IL4/IFN-γ比值随PFOS浓度的增加而增加,提示PFOS的暴露与机体偏向Th2型免疫应答的程度存在剂量-反应关系。在高剂量10 mg·kg-1·d-1PFOS+OVA组,小鼠肺泡灌洗液的IL4、IL4/IFN-γ显著高于单独OVA组,提示短期、较高剂量的PFOS暴露加剧了Th2型细胞因子的分泌,机体免疫应答可能更偏向以Th2型为主,即体液免疫,这与部分已有动物体内实验研究结果相似[17-18]。臧珍等[17]关于全氟辛烷磺酸对4T1荷瘤小鼠免疫状态影响的研究显示,IFN-γ和IL4 mRNA表达水平随PFOS浓度升高而升高,PFOS染毒可使小鼠免疫状态向Th2型倾斜。Zhong等[18]开展了PFOS暴露影响小鼠子代内分泌功能和Th1/Th2型细胞因子平衡的研究,结果显示,PFOS产前暴露显著增加了雄性子代小鼠IL-4的水平,而这种Th1/Th2型细胞因子的变化可能与睾酮介导的内分泌功能有关。但本实验结果与一些体外实验结果不一致[19-20]。董光辉等[19]开展PFOS暴露对小鼠淋巴细胞增殖功能和细胞因子分泌水平影响的体外研究,结果表明,PFOS对体外培养小鼠脾细胞的IFN-γ、IL4细胞因子分泌水平并没有显著影响,可能是因为该研究为体外实验且检测的靶部位不同,不能反映出PFOS在体内诱导细胞因子分泌的整个过程。Soloff等[20]开展PFOS暴露对宽吻海豚T细胞活化的体外实验研究发现,PFOS能够诱导T细胞产生更多IFN-γ,明显多于IL4,这可能与物种特异性以及研究对象种群的封闭性有关。因此,PFOS对机体Th1/Th2型细胞因子平衡失调的影响机制,以及在哮喘发展进程的作用通路还需更深入的研究。
此外,本研究还观察到PFOS暴露对小鼠肝脏的影响,发现肝脏系数与PFOS染毒浓度呈正相关,提示PFOS暴露可能引起肝组织结构的异常。肝脏组织作为机体重要的免疫器官之一,有研究显示PFOS具有肝毒性,主要通过细胞的氧化应激、线粒体依赖的细胞凋亡通路造成肝功能损伤,引起肝肿大、肝细胞空泡变性以及炎症细胞的浸润[21]。同时,肾脏指数与PFOS浓度呈负相关,提示PFOS也存在肾脏毒性,可引起肾损伤[22-23]。
综上所述,本研究表明PFOS能加重哮喘小鼠肺部的炎症反应,诱导Th2型细胞因子的表达,研究结果为进一步探讨PFOS的机体免疫毒性提供初步理论依据。

