三(1,3-二氯-2-丙基)磷酸酯对大鼠的神经毒性效应
王思敏,李学彦,周启星,*,胡献刚,邵晓东,张永国
1. 南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室/天津市城市生态环境修复与污染防治重点实验室,天津 300350 2. 沈阳军区总医院消化科,沈阳 110016
近年来,随着溴化阻燃剂(BFR)的逐步淘汰,有机磷系阻燃剂(OPFRs)的生产和应用越来越多[1]。其中,三(1,3-二氯-2-丙基)磷酸酯(TDCPP)已被用作溴化阻燃剂的主要替代品添加到各种产品中,如电子设备、家具、纺织品、泡沫、车内饰件和儿童玩具等[2-3]。由于TDCPP主要以掺杂混合而非化学键合方式加入到材料中,所以很容易释放到环境中[3],已经在室内空气[4]、房屋灰尘[5]、饮用水[6]、沉积物[7]和生物组织中检测到了有机磷阻燃剂TDCPP[8-9]。有研究表明,TDCPP具有潜在的致癌性[10-11];能够显著性改变斑马鱼肝脏组织中的炎症反应相关基因的表达[12-13];当禽类胚胎暴露于TDCPP后,肝脏的多种与物质代谢和免疫应答相关基因的表达改变[14]。还有一些研究认为,有机磷阻燃剂可以通过类固醇生成或雌激素代谢而改变性激素的平衡[15]。TDCPP与有机磷农药结构相似,已经有研究证明,TDCPP等有机磷阻燃剂会对生物的神经系统发育产生不良影响[16-18];具有潜在的神经毒性和发育毒性[19-21]。有研究发现,PC12细胞在暴露于不同浓度的TDCPP和磷酸三(2-氯乙基)酯(TCEP)后,显微镜下观察到细胞形态发生改变,同时PC12细胞存活率降低,并存在剂量-效应关系[22];有机磷阻燃剂对神经细胞也具有毒性作用,能够引起神经细胞的氧化损伤和细胞周期阻滞[23]。也有研究表明,TDCPP能够引起成年雌鱼大脑中多巴胺及血清素水平的降低,在雄鱼和雌鱼大脑中均发现神经系统发育基因的下调[24]。
但是,在TDCPP神经毒性研究方面,现有研究大多集中在体外实验和鱼类,
对哺乳动物研究资料相对缺乏。因此,本研究主要观察TDCPP对大鼠神经系统的毒性效应及其程度,并探讨TDCPP暴露后导致神经毒性的机制。
1 材料与方法(Materials and methods)
1.1 实验材料与仪器
SPF级SD大鼠购买自北京维通利华实验动物技术有限公司;TDCPP(>95%,Tokyo Chemical Industry,日本),乙酰胆碱酯酶(AChE)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、多巴胺(DA)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)试剂盒购自南京建成生物工程研究所,特级初榨橄榄油购自西班牙阿布利尔。
瑞士Tecan多功能酶标仪平台Spark 10M,透射电镜(H-7650,日立,日本),Morris水迷宫(SLY-WMS,北京硕林苑科技公司,中国),离心机(5804 R, Eppendorf, 德国),切片机(EM UC7, Leica, 德国),包埋机(EG1150H, Leica, 德国)。
1.2 实验方法
1.2.1 染毒溶液配制
TDCPP以橄榄油为溶剂,染毒组的暴露剂量分别为TDCPP半致死剂量的1/16、1/8和1/4,即125、250、和500 mg·kg-1·d-1,通过灌胃的方式给药,每日给药一次。
1.2.2 实验动物及分组
6~8周SPF级雄性SD大鼠60只,实验动物饲养于中国医学科学院放射医学研究所,每天12 h/12 h白昼/黑夜灯光交替照射,控制室内温度为22~24 ℃,湿度40%~60%。实验动物自由饮水及进食。
60只雄性大鼠随机分为5组,每组12只:空白组(Control),不做任何处理;溶剂对照组(Solvent),每天以相同体积的橄榄油灌胃;低剂量组,灌胃剂量为125 mg·kg-1·d-1;中剂量组,灌胃剂量为250 mg·kg-1·d-1;高剂量组,灌胃剂量为500 mg·kg-1·d-1。于第12周末进行Morris水迷宫实验,包括定位航行实验和空间探索实验。行为学实验结束后,禁食12 h,以0.3 mL·(100 g)-1剂量注射10%水合氯醛麻醉,取出脑组织,用生理盐水冲洗干净,并分离出纹状体固定在戊二醛中,一部分冻存在-80 ℃冰箱待检。
1.2.3 Morris水迷宫实验
Morris水迷宫分析系统主要由摄像头、电脑、水池和站台组成。水池直径为160 cm,高度为60 cm,内壁被漆为黑色,池壁内贴有形状不同的标记物。水池分为4个象限,第1象限内距离池壁20 cm处放置一个直径为12 cm的黑色圆形站台。大鼠在进行游泳实验时水温保持在(24±2) ℃,平台位于水面下1 cm。
定位航行实验:行为学实验的前4天为定位航行实验,将大鼠分别从4个不同象限面壁放入水池中,记录大鼠在60 s内找到站台的时间,即为逃避潜伏期。若超过60 s未能找到平台,则引导其找到站台适应15 s逃逸时间记录为60 s。
空间探索实验:行为学实验第5天撤去站台,将大鼠从第3象限面壁置入池内,记录大鼠在60 s内在目标象限停留时间和运动距离百分比。
1.2.4 生化指标检测
纹状体DA、TNF-α和IL-1β的水平使用酶联免疫吸附试验(ELISA)法检测,纹状体中的AChE、脑组织中SOD和GSH使用试剂盒测定。
取纹状体,用2.5%的戊二醛溶液在4 ℃的条件下固定超过24 h。用磷酸缓冲液漂洗样品,用1%的锇酸溶液固定样品1~2 h,再次漂洗,脱水处理,包埋剂包埋,切片机切片,获得70~90 nm的切片。切片先经柠檬酸铅溶液染色,再用醋酸双氧铀50%乙醇饱和溶液染色5~10 min,在透射电镜中观察纹状体超微结构。
1.3 统计学分析
采用SPSS21.0和ORIGIN进行数据分析,大鼠的体重和水迷宫数据采用重复测量数据的方差分析,其余各项指标采用单因素方差分析,当P<0.05时,认为差异在统计学上具有显著性。除行为学实验每组样本为9例,其余各项实验每组样本均为5例。
2 结果(Results)
2.1 大鼠一般体征
实验结果显示,12周给药期间,TDCPP染毒组的大鼠均表现为皮毛缺少光泽等不良状态,其中高剂量染毒组大鼠死亡1只。大鼠每周体重变化见表1。实验期间,空白对照组、溶剂对照组、低剂量染毒组和中剂量染毒组的体重随着时间变化均呈现上升趋势,其中,空白对照组和溶剂对照组的体重上升幅度最大,高剂量染毒组的体重在0到8周期间呈现出缓慢上升的趋势,8周后体重开始下降。12周体重数据显示,空白对照组的体重与溶剂对照组相比无明显差异,对照组与TDCPP染毒组的差别具有统计学意义,对照组的体重高于TDCPP染毒组的体重且具有剂量依赖性,即随着染毒剂量的升高,大鼠体重下降更加明显。在第12周周末,中剂量和高剂量组大鼠体重与对照组相比显著降低(*P<0.05,**P<0.01)。染毒组间体重比较结果显示,与低剂量组(##P<0.01)和中剂量组(△△P<0.01)相比,高剂量组体重显著性降低。
2.2 Morris水迷宫
2.2.1 定位航行实验
定位航行实验结果显示(表2),行为学实验期间,每组大鼠的逃避潜伏期均呈现逐渐下降的趋势,表明各组大鼠均具有一定的空间学习记忆能力,其中,空白对照组和溶剂对照组逃避潜伏期下降得最快,且两者行为学实验结果相比,无显著差异(P>0.05)。从水迷宫实验第2天的数据可以看出,染毒组的逃避潜伏期较空白对照组和溶剂对照组有延长的趋势。实验第3天,高剂量染毒组的逃避潜伏期显著高于对照组,差异显著(*P<0.05);染毒组组间比较结果显示,高剂量染毒组的逃避潜伏期显著高于低剂量染毒组,差异显著(#P<0.05)。实验第4天结果表明,染毒组的逃避潜伏期均高于空白对照组和溶剂对照组,且随着染毒剂量的增加而升高,其中,高剂量染毒组的逃避潜伏期显著高于对照组(**P<0.01),且显著大于低剂量(##P<0.01)和中剂量染毒组(△△P<0.01)。

表1 三(1,3-二氯-2-丙基)磷酸酯(TDCPP)暴露12周后不同处理组中大鼠的体重Table 1 The body weight of rats in different groups after tris(1,3-dichloro-2-propyl) phosphate (TDCPP) exposure for 12 weeks
注:*、** TDCPP处理组与空白对照组和溶剂对照组相比,P<0.05、P<0.01;#、##高剂量染毒组与低剂量染毒组相比,P<0.05、P<0.01;△△高剂量染毒组与中剂量染毒组相比,P<0.01。
Note: * statistically significant (P<0.05), ** statistically significant (P<0.01), when TDCPP treatment groups compared with blank control and solvent control group;#statistically significant (P<0.05),##statistically significant (P<0.01), when high dose group compared with low dose group;△△statistically significant (P<0.01), when high dose group compared with medium dose group.

表2 TDCPP暴露对大鼠逃避潜伏期的影响(n=9,)Table 2 Effects of TDCPP on the escape latency of rats (n=9,)
注:*、**TDCPP处理组与空白对照组和溶剂对照组相比,P<0.05、P<0.01;#、##高剂量染毒组与低剂量染毒组相比,P<0.05、P<0.01;△△高剂量染毒组与中剂量染毒组相比,P<0.01。
Note: * statistically significant (P<0.05), **statistically significant (P<0.01), when TDCPP treatment groups compared with blank control and solvent control group;#statistically significant (P<0.05),##statistically significant (P<0.01), when high dose group compared with low dose group;△△statistically significant (P<0.01), when high dose group compared with medium dose group.
2.2.2 空间探索实验
空间探索实验结果如图1所示,各染毒组大鼠在目标象限停留的时间随着染毒剂量的增加而减少,其中,中剂量染毒组和高剂量染毒组在目标象限停留时间显著低于对照组(*P<0.05);染毒组之间无显著性差异(P>0.05)。大鼠在目标象限游泳距离百分比结果各组间无显著性差异(P>0.05)。这表明,TDCPP能对大鼠的空间学习记忆能力产生一定影响。
2.3 神经递质多巴胺及乙酰胆碱酯酶的变化
多巴胺是哺乳动物中枢神经系统中的一种重要的神经递质,占所有脑内儿茶酚胺类神经递质总含量的80%,可调节大脑的多种功能[25-27],在脑内纹状体的含量极高,约占全脑总含量的70%[28]。本实验在第12周取大鼠纹状体,制作组织匀浆并检测了纹状体中多巴胺的含量和乙酰胆碱酯酶水平,实验结果如图2(a)所示,高剂量染毒组和中剂量染毒组大鼠纹状体DA含量均低于空白对照组和溶剂对照组,但差异不具有显著性,而低剂量TDCPP并未引起大鼠纹状体内DA含量的明显改变。大鼠纹状体AChE含量检测结果如图2(b)所示,TDCPP各染毒组纹状体AChE水平低于空白对照组和溶剂对照组,差异显著(**P<0.01),且随着染毒剂量的升高,AChE水平下降得越为明显;染毒组组间比较结果显示,与低剂量染毒组相比较,高剂量染毒组AChE含量显著性降低,差异显著(#P<0.05)。
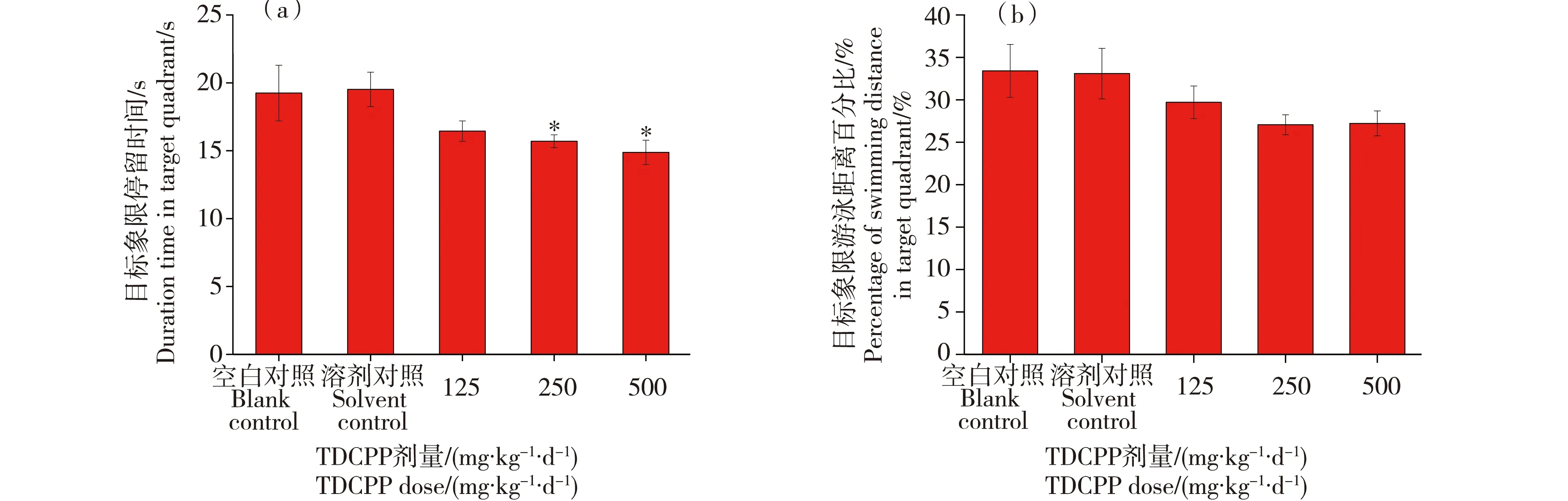
图1 TDCPP暴露对大鼠在目标象限停留时间和游泳距离百分比的影响注:*TDCPP处理组与空白对照组和溶剂对照组比较,P<0.05。Fig. 1 The duration and percentage of the swimming distance in target quadrant of rats after TDCPP exposure Note: *statistically significant (P<0.05), when TDCPP treatment groups compared with blank control and solvent control group.

图2 TDCPP暴露对大鼠纹状体内多巴胺和乙酰胆碱酯酶水平的影响注:**TDCPP处理组与空白对照组和溶剂对照组比较,P<0.01;# 高剂量染毒组与低剂量染毒组比较,P<0.05。Fig. 2 The levels of dopamine and acetylcholinesterase (AchE) in rat striatum after TDCPP exposure Note: **statistically significant (P<0.01), when TDCPP treatment groups compared with blank control and solvent control group; # statistically significant (P<0.05), when high dose group compared with low dose group.

图3 TDCPP暴露对大鼠脑组织中超氧化物歧化酶、谷胱甘肽、肿瘤坏死因子-α和白细胞介素-1β的影响注:*、** TDCPP处理组与空白对照组和溶剂对照组比较,P<0.05、P<0.01;# 中剂量和高剂量染毒组与低剂量染毒组比较,P<0.05。Fig. 3 Changes in the levels of superoxide dismutase (SOD), glutathione (GSH), tumor necrosis factor α (TNF-α) and interleukin-1 β (IL-1β) in brain tissues of the rats after TDCPP exposure Note: * statistically significant (P<0.05), ** statistically significant (P<0.01), when TDCPP treatment groups compared with blank control and solvent control group; # statistically significant (P<0.05), when medium dose and high dose group compared with low dose group.
2.4 神经炎症因子与氧化应激指标的变化
本研究检测了脑组织匀浆中氧化应激指标SOD活性和GSH含量,以及神经炎症因子TNF-α和IL-1β的水平。
如图3(a)所示,SOD活性在空白对照组和溶剂对照组之间比较,差异不显著(P>0.05);染毒组大鼠脑组织中SOD活性均低于空白对照组和溶剂对照组,且具有剂量依赖性,即大鼠脑组织中SOD活性随着染毒剂量的升高而降低,其中,高剂量染毒组脑组织中SOD活性与对照组相比显著降低(*P<0.05);SOD活性在染毒组之间并无显著性差异。图3(b)结果显示,大鼠脑组织谷胱甘肽(GSH)水平在空白对照组和溶剂对照组之间,无显著性差异(P>0.05),中剂量染毒组和高剂量染毒组GSH活性与对照组相比显著降低(*P<0.05);染毒组组间比较结果显示,与低剂量染毒组相比,高剂量染毒组脑组织中GSH水平显著降低(#P<0.05)。
实验结果显示(图3(c)和(d)),2种神经炎症因子在空白对照组和溶剂对照组之间比较,差异不显著(P>0.05)。与对照组相比,中剂量染毒组和高剂量染毒组脑组织中TNF-α水平显著升高(**P<0.01);染毒组组间比较结果显示,中剂量染毒组和高剂量染毒组脑组织中TNF-α水平均显著性高于低剂量染毒组(#P<0.05)。高剂量染毒组脑组织中IL-1β水平显著高于空白对照组和溶剂对照组(*P<0.05);IL-1β水平在染毒组组间比较,无显著性差异(P>0.05)。
2.5 纹状体超微结构观察
透射电镜下观察对照组(图4A~C)和高剂量染毒组(图4D~F)大鼠纹状体切片超微结构,结果如图所示,对照组细胞结构组织正常,细胞器和细胞核均未出现损伤现象。高剂量染毒组神经元细胞的细胞质组分、细胞器及突触超微结构均遭到破坏,出现细胞核固缩变形的现象;线粒体嵴缩短,空泡化现象严重;突触前后膜增厚变模糊,突触间隙减小甚至消失。

图4 TDCPP暴露引起大鼠纹状体超微结构损伤注:A, B, C为对照组;D, E, F为500 mg·kg-1·d-1 TDCPP暴露组。图中细胞核固缩变形用→标注,线粒体空泡化用▲标注,突触间隙用□标注。Fig. 4 The evidence of TDCPP-induced damages in rat striatum ultrastructures Note: A, B, C show the results of Control; D, E, F show the results of 500 mg·kg-1·d-1 group. The phenomenon of nuclear deformation was donated by →; mitochondria damage was donated by ▲; synaptic cleft was denoted by □.
3 讨论(Discussion)
神经系统是机体内对生理功能活动的调节起主导作用的系统,神经行为的评价检测及机制研究已成为重要的公共健康问题。行为变化是一种重要的神经毒性指标,当机体暴露于环境毒物时,常表现出行为功能上的障碍[29]。研究表明,多种有机磷酯阻燃剂对生物具有神经毒性,如TDCPP能够引起禽类行为学异常[30],磷酸三苯酯(TPP)暴露可影响斑马鱼神经发育相关基因的转录水平,并导致斑马鱼行为学改变[31]。本研究也表明,较高剂量的TDCPP能够对大鼠的学习记忆能力和空间探索能力产生影响,使大鼠逃避潜伏期呈现上升趋势,在目标象限停留的时间减低,但是低剂量的TDCPP暴露对大鼠的学习记忆能力无明显的毒性作用。
多巴胺是哺乳动物中枢神经系统中的一种重要的神经递质,可调节大脑的多种功能。作为脑内重要神经递质之一,多巴胺在控制行为和认知功能中具有重要作用,同时,作为大脑发育过程中最早释放的神经递质之一,对神经元细胞的结构发育起着重要的作用[25-27]。当多巴胺在脑内调节紊乱时,可导致机体行为学的异常[32]。本实验检测了各组大鼠纹状体内多巴胺的含量,结果表明,中剂量染毒组和高剂量染毒组纹状体中DA含量均低于对照组,但低剂量TDCPP并未引起大鼠纹状体内DA含量的明显改变。
AChE在机体神经发育中有重要作用[33],多种有机磷可在神经系统发育时期抑制AChE的活性,影响神经细胞的正常增值和分化,并对脑的正常功能产生影响[34-36]。本研究结果表明,TDCPP能够引起大鼠脑组织中乙酰胆碱酯酶活性显著性降低,且具有剂量依赖性,这提示TDCPP对大鼠神经系统的发育造成了损伤。
为了进一步检测TDCPP对大鼠脑组织的损伤,本研究同时检测了大鼠脑组织中氧化应激指标SOD和GSH,以及炎症因子TNF-α和IL-1β。外源性化合物可以通过产生大量活性氧而造成对机体的损害,而机体内的抗氧化酶组成了防御过氧化系统,可清除活性氧,控制脂质过氧化水平,保护机体免受氧化损伤[37]。SOD活性和GSH含量的高低可以反映机体抗氧化能力[38],本研究结果显示,高剂量染毒组SOD活性显著性低于对照组,中剂量染毒组和高剂量染毒组GSH含量显著性低于对照组,表明中剂量和高剂量的TDCPP能够对大鼠脑组织造成氧化损伤,但低剂量的TDCPP并未对大鼠脑组织的氧化系统造成明显损伤。氧化应激和炎症反应在组织损伤的发生和发展过程中均起着重要作用,机体内氧化应激产生的自由基可以增加炎症反应,而炎症反应中产生的自由基又可以加重氧化应激[39]。
炎症因子TNF-α和IL-1β在组织中的含量可以反映机体炎症水平和组织的损伤程度[40]。本研究发现,中剂量染毒组和高剂量染毒组大鼠脑组织中TNF-α水平与对照相比显著性升高,高剂量染毒组脑组织中IL-1β水平与对照组相比显著性升高;但低剂量TDCPP并未引起大鼠脑组织内炎症因子含量的明显改变。实验结果提示,TDCPP能够诱导大鼠脑组织内产生大量的活性氧,进而引起组织中的氧化应激和炎症反应,且具有剂量依赖效应。
纹状体切片电镜超微结构观察结果表明,TDCPP可引起大鼠纹状体细胞损伤,主要表现为核固缩、线粒体损伤和突触间隙变小等。这表明,TDCPP可导致纹状体细胞受到损伤。
目前环境中检测到的TDCPP主要有4个来源,室内空气(0.11~150 ng·m-3)[4-5]、地表水(0.7~50 ng·L-1)[41-43]、沉积物(250~8 800g·kg-1)和室内灰尘(0.20~67 mg·kg-1)[1]。人群接触到的TDCPP的剂量会因地区和环境等因素不同而不同,上述数据表明,人群能够接触到的TDCPP剂量介于本实验的染毒范围内。本实验依据TDCPP对大鼠的口服毒性(LD50≈2 000 mg·kg-1),染毒剂量由低到高依次为LD50的1/16、1/8和1/4。然而,本研究是一项亚慢性毒性实验,对大鼠的暴露剂量较高,不同剂量组间跨度较大,暴露周期较短,由于TDCPP的产量和使用量呈递增趋势,且在环境中被高频率检出,进一步研究评价TDCPP对哺乳动物的慢性潜在毒性作用需要更低的暴露浓度和更长的暴露时间。
综上所述,TDCPP可引起大鼠体重明显下降,导致大鼠神经细胞损伤,行为改变;抑制AChE、SOD活性及GSH含量,使炎症介质增高,引起大鼠脑组织的氧化损伤和炎症反应。TDCPP对神经系统的毒性作用可能与其抑制胆碱酯酶活性,引起脑组织抗氧化系统损伤,导致炎症反应的发生等一系列因素有关。

