四溴联苯醚对小鼠的神经毒性
庄娟,李梦秋,洪法水,胡卫成,张萌萌,周颖君,罗艳,张建梅,郑元林,*
1. 淮阴师范学院生命科学学院江苏省环洪泽湖生态农业生物技术重点实验室;淮阴师范学院江苏省高校区域现代农业与环境保护协同创新中心,淮安 223300 2. 江苏师范大学江苏省药用植物生物技术重点实验室,江苏师范大学生命科学学院,徐州 221116
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一种新型阻燃剂,在工业生产中被广泛添加到建筑材料、电子产品、家用电器、塑料以及纺织材料等产品中[1]。PBDEs与材料之间是非化学键相连,因此很容易以挥发或渗出的方式迁移到环境中,可经食物链进入人体,且其具有降解周期长、脂溶性和生物蓄积性强的特点[2]。PBDEs有209种同系物,其中BDE-47是在环境和生物样本中检出率最高、毒性最强的PBDEs之一。文献证实,经口腔灌胃摄入的BDE-47可以通过血脑屏障分布至脑[3],并具有蓄积效应[4]。在人类脑样本中,研究者也检测到BDE-47的存在[5]。海马是BDE-47毒作用的重要靶器官,BDE-47可引海马CA1区的长时程增强(LTP)下降,神经递质相关蛋白表达下调,最终导致自发行为永久性改变或学习记忆缺陷[6-7]。人群调查结果显示,BDE-47与儿童智力发育迟缓[8]、认知能力下降等[9]直接相关。因此,BDE-47对神经系统的毒作用及其机制引起人们的广泛关注。
PKC为丝氨酸/苏氨酸蛋白激酶家族,与多种疾病的发生、发展有关,在大脑神经元突触可塑性和记忆维持中发挥至关重要的作用[10-12]。PKC家族分为3种类型:典型的PKC、新型的PKC以及非典型的PKC。典型的PKC有α、β和γ 3种亚型,新型的PKC包括δ、ε、η和θ亚型,而非典型的PKC包括PKCλ/ι、PKCζ和PKMζ[13]。体外实验研究结果表明,BDE-47可诱导小脑颗粒神经细胞PKC升高[14]。但BDE-47对在体海马组织神经细胞PKC的影响尚不清楚。研究表明,传统的PKC(PKCα、β和γ)、PKCδ、PKCλ和PKCζ亚型的表达与记忆形成或神经细胞病理性变化关系密切[10,15-19]。本研究主要探讨这些PKC亚型在BDE-47小鼠海马神经细胞中的表达变化,为明确BDE-47致神经毒作用机制提供实验依据。
1 材料与方法(Materials and methods)
1.1 主要试剂与仪器
BDE-47,购于美国Chem. Service, West Chester, PA公司,纯度大于99%;蛋白酶抑制剂购于美国罗氏(Roche)制药有限公司;组织蛋白提取液和BCA蛋白定量分析试剂盒购于Thermo Fisher Scientific公司;Nissl染色液购自碧云天生物技术有限公司;预染蛋白Marker购于SMOBIO公司;PKCα、PKCβ、PKCγ、PKCδ和PKCζ一抗购于剑桥abcam公司;PKCλ一抗购于美国BD公司;β-actin一抗、辣根过氧化物酶偶联抗鼠和抗兔二抗、辣根过氧化物酶显色液购于美国Cell Signaling Technology公司;caspase-3活性试剂盒购于碧云天生物技术公司。
德国莱卡冰冻切片机(CM3050S);德国莱卡显微镜(DM4000B);德国莱驰混合球磨仪(RETSH MM400);赛多利斯电子天平(SQP);美国ProteinSimple成像系统(FluorChem M);日本岛津紫外-可见分光光度计(UV-2501 PC)。
1.2 实验动物
7周龄C57BL/6J小鼠45只,购于北京维通利华实验动物技术有限公司。小鼠饲养条件:温度(22±1) ℃、湿度50%±10%、12 h有光/12 h黑暗,自由进水和食物。
1.3 动物暴露实验
根据我们之前的实验,20 mg·kg-1及以上剂量BDE-47能造成成年小鼠海马损伤(暴露8周)[20]。因此本实验我们选取了25和50 mg·kg-1的BDE-47暴露剂量。BDE-47溶解于玉米油。小鼠适应1周后分为3组,每组15只:玉米油对照组,BDE-47(25 mg·kg-1)和BDE-47(50 mg·kg-1)剂量组。小鼠每日按相应剂量口腔灌胃一次,连续处理6周。在处理2、4、6周后小鼠禁食过夜,于次日9:00—10:00间称体重。实验结束后麻醉并颈椎脱臼处死,迅速取出脑,冰上分离出海马组织。
1.4 被动回避实验
小鼠染毒6周后进行被动回避实验。实验在每日10:00—15:00间进行。实验装置包括明暗两箱,两箱之间有一拱形门。暗箱底部中间位置的铜栅可通交流电进行足部电击。实验前一日,小鼠放入明箱,拱形门打开,让其自由在明暗两箱内活动,适应环境5 min。次日实验,小鼠被放入明箱。小鼠有喜暗习性,很快穿过拱形门进入暗箱。小鼠从明箱进入暗箱的时间记录为潜伏期。待其进入暗箱后立即将拱形门关闭,同时给予足部电击(50 Hz, 5 s),然后迅速将小鼠拿出放回鼠笼。24 h后,小鼠被再次放入明箱,拱形门打开,但不电击,记录潜伏期。记录时长为300 s,如果小鼠在300 s内未进入暗箱,潜伏期记录为300 s。同时记录小鼠从明箱进入暗箱的次数为错误次数,并记录小鼠在明暗两箱内运动的轨迹图。
1.5 海马组织病理学检测
海马组织冰冻切片,切片厚度12 μm。用尼氏染料室温染色10 min。随后用50%、70%、80%、95%和100%乙醇脱水,再用二甲苯透明,中性树胶封片后观察。
1.6 组织匀浆与蛋白定量
冰浴条件下加入5倍体积的含有蛋白酶和磷酸酶抑制剂的组织蛋白提取液,用混合球磨仪匀浆(28 frequency·s-1, 30 s)。然后14 000 g、4 ℃离心20 min,收集上清,用于蛋白质含量测定、caspase-3活性测定及免疫印迹分析。用BCA protein assay kit进行蛋白质定量,根据蛋白质浓度标准曲线计算出样品的蛋白质含量。
1.7 caspase-3活性测定
取适量海马组织匀浆上清液与Ac-DEVD-pNA(2 mmol·L-1)37 ℃孵育2 h。caspase-3催化Ac-DEVD-pNA后生成黄色pNA。在405 nm处检测吸光度,根据pNA标准浓度吸光度曲线计算pNA量。caspase-3活性单位为nmol pNA·mg-1蛋白。
1.8 蛋白免疫印迹
取50 μg蛋白样品用10%的SDS-PAGE进行电泳。将胶上蛋白电转移到PVDF膜上。5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜。经TBST洗涤后室温孵育偶联辣根过氧化物酶(HRP)的二抗溶液1 h。显色后用成像系统进行拍照。后用Scion Image software program软件对蛋白条带进行半定量分析。
1.9 统计方法
数据处理采用SPSS 11.5统计软件,实验数据采用One-Way ANOVA进行单因素方差分析,采用Tukey法进行显著性分析,P<0.05为显著性差异。
2 结果(Results)
2.1 小鼠一般体征和体重的变化
对照组小鼠皮毛乌黑亮泽,精神状态好。染毒后小鼠饮水、摄食和精神状态正常。染毒开始后每2周测一次空腹体重,各组小鼠体重增长无显著差异(图1)。但与对照组小鼠相比,BDE-47暴露4周后导致小鼠被毛色泽和顺滑度下降。

图1 2,2’,4,4’-四溴联苯醚(BDE-47)暴露对 小鼠平均体重的影响Fig. 1 The effect of 2,2',4,4'-tetrabromodiphenyl ether (BDE-47) on the mean body weight of mice
2.2 被动回避实验结果
被动回避实验一直被用来检测海马依赖性记忆[21-22],也被用来检测PBDEs造成的记忆损伤[23]。被动回避实验结果见图2。在第1天训练期,各组小鼠进入暗箱的潜伏期相似。在电击24 h后测试阶段,对照组小鼠潜伏期为(196.16±65.12) s,而BDE-47 (25 mg·kg-1)剂量组为(23.18±15.14) s,BDE-47 (50 mg·kg-1)剂量组为(17.43±10.45) s。与对照组相比,BDE-47显著缩短了小鼠电击24 h后的潜伏期(P<0.001) (图2A)。同时,实验结果显示,在电击24 h测试阶段,对照组小鼠错误次数为0.8±0.6,而BDE-47 (25 mg·kg-1)剂量组错误次数为2.7±0.9,BDE-47 (50 mg·kg-1)剂量组为5.5±1.63。与对照组相比,BDE-47使小鼠错误次数显著增多(BDE-47 (25 mg·kg-1):P<0.01; BDE-47 (50 mg·kg-1):P<0.001) (图2B)。小鼠在明暗箱活动轨迹见图2C,BDE-47使小鼠在明箱的活动减少。这些结果表明,BDE-47暴露导致小鼠24 h记忆能力受损。
2.3 海马组织病理学变化
光学显微镜观察小鼠海马组织焦油紫染色的情况,结果如图3所示,对照组小鼠海马CA1区锥体细胞排列整齐且紧凑,神经元胞体大而饱满。BDE-47暴露小鼠海马CA1区锥体细胞排列散乱不规则,细胞间空隙增大,神经元胞体皱缩体积小。
2.4 BDE-47对海马组织PKC表达水平的影响
小鼠海马PKC表达情况见图4。与对照组相比,BDE-47对PKCα、β、γ和ζ亚型的表达无显著影响(P>0.05),但显著促进了PKCδ和PKCλ的表达量(BDE-47 (25 mg·kg-1):P<0.05; BDE-47 (50 mg·kg-1):P<0.01)。
2.5 BDE-47对海马caspase-3活性的影响
BDE-47对小鼠海马caspase-3活性的影响如图5所示。与对照组相比,BDE-47显著提高了海马caspase-3的活性(BDE-47 (25 mg·kg-1):P<0.05; BDE-47 (50 mg·kg-1):P<0.01)。
3 讨论(Discussion)
脑组织是PBDEs重要的靶器官,流行病学调查结果表明,PBDEs对人的神经系统具有毒性,尤其对婴幼儿的脑神经发育可造成不可逆的损伤,导致其运动协调能力和持续注意力下降[24],智力发育迟缓[8]、阅读综合能力降低[25]、认知能力下降等[9]。海马(hippocampus)是参与学习和记忆的关键脑区,位于大脑内侧颞叶,属大脑边缘系统,主要负责记忆的储存转换。动物实验证明,PBDEs可通过血脑屏障进入并蓄积在脑组织[4,26],影响海马组织神经递质受体和相应蛋白的表达,从而影响海马的功能,导致学习记忆能力下降[6,27]。本实验的检测结果表明,BDE-47可造成小鼠被动回避实验24 h记忆保持能力受损。进一步病理检测结果显示,BDE-47导致海马CA1区锥体细胞排列紊乱,神经元皱缩变小。这些结果表明,BDE-47损伤了海马CA1区锥体神经元细胞,导致小鼠学习记忆能力下降。
PKCα、β和γ属于典型PKC,广泛表达于海马CA1锥体神经元,在突触可塑性和记忆形成中的功能研究由来已久[28-29,15]。二酰甘油在钙离子协同下激活典型PKC,进而调节突触蛋白合成、突触小泡回收以及神经递质释放等[11]。PKCζ属于非典型PKC,最早于1993年被报道在生成和维持海马CA1区长时程增强中发挥重要作用[30]。我们之前的研究发现,PKCζ与软骨藻酸的神经毒机制有关。PKCζ升高后可引起海马神经元凋亡和学习记忆能力损伤[18]。但在暴露于BDE-47的小鼠海马组织中,这些PKC亚型的表达未发生显著性变化,但PKCδ和λ的表达显著升高。PKCδ属于新型PKC,对氧化压力敏感,是活性氧调控的关键下游因子,与细胞死亡关系密切[31]。众多的研究表明,PKCδ表达升高与多种神经毒物的毒作用机制有关[32]。神经兴奋药甲基安非他命可显著促进纹状体PKCδ的表达,进而诱导神经细胞凋亡[33]。当胶质细胞面对细菌脂多糖或肿瘤坏死因子等炎症压力时,PKCδ表达增加,活性增强,并激活PKCδ依赖性核转录因子NFκB炎症信号通路,促进神经细胞死亡;PKCδ敲除降低了小鼠对1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的多巴胺能神经毒性的敏感性[34]。在甲基苯丙胺引发的多巴胺能神经毒性中,PKCδ升高后可通过损伤泛素-蛋白酶体系统[35],促进自噬[36],激活还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶及抑制核因子2(Nrf2)抗氧化通路[37]导致神经细胞凋亡。因此我们推测,BDE-47诱导的PKCδ增加最终会通过促进细胞凋亡,影响海马神经细胞的功能,导致小鼠记忆损伤。我们随后检测了小鼠海马组织caspase-3活性,结果发现,BDE-47的确促进了caspase-3活性。PKCλ为非典型PKC,在记忆存储中的作用研究较少。现有的研究显示,PKCλ在LTP早期表达阶段[38]、后期维持阶段和记忆中都发挥重要作用[39]。Wang等[10]的研究进一步表明,PKCλ不仅在LTP中起作用,对海马依赖性长时程记忆(LTM)维持也十分重要。此外,Rossner等[40]认为,PKCλ具有促进神经元活性的作用。在非神经细胞中,PKCλ可促进细胞增殖和存活[41-42]。因此,在BDE-47诱导的小鼠海马组织中,PKCλ表达增强可能是机体对抗损伤的一种保护机制,这需要开展进一步的实验去证实。

图2 BDE-47影响小鼠被动回避实验行为(n=10)注:A. 潜伏期;B. 电击24 h后小鼠进入暗箱的错误次数;C. 小鼠在明箱和暗箱中活动轨迹图。与对照组相比** P<0.01,*** P<0.001。Fig. 2 BDE-47 impairs behavioral performance of mice in the passive avoidance task (n=10) Note: A. the step-through latency in the passive avoidance task; B. the number of error numbers during the 24 h-retention task; C. representative tracks of mice in the light-room and the dark-room. ** P<0.01, *** P<0.001 versus the control group.

图3 小鼠海马安蒙角(CA1)区显微结构图(焦油紫染色)(标尺:25 μm)Fig. 3 The representative images of the cornu ammonis 1 (CA1) region of mouse hippocampus (stained with crystal violet) (the bar: 25 μm)

图4 小鼠海马组织蛋白激酶C(PKC)的蛋白免疫印迹结果注:A. 代表性小鼠海马PKCα、β、γ、δ、λ、ζ和β-actin蛋白免疫印迹条带;B. 蛋白条带灰度值分析。与对照组相比,* P<0.05,** P<0.01。Fig. 4 Immunoblotting and densitometry analysis of hippocampal protein kinase C (PKC) in mice Note: A. representative immunoblotting for PKCα, β, γ, δ, λ, ζ and β-actin in mouse hippocampus; B. relative density analysis of the PKCα, β, γ, δ, λ and ζ protein bands. * P<0.05, ** P<0.01 versus the control group.
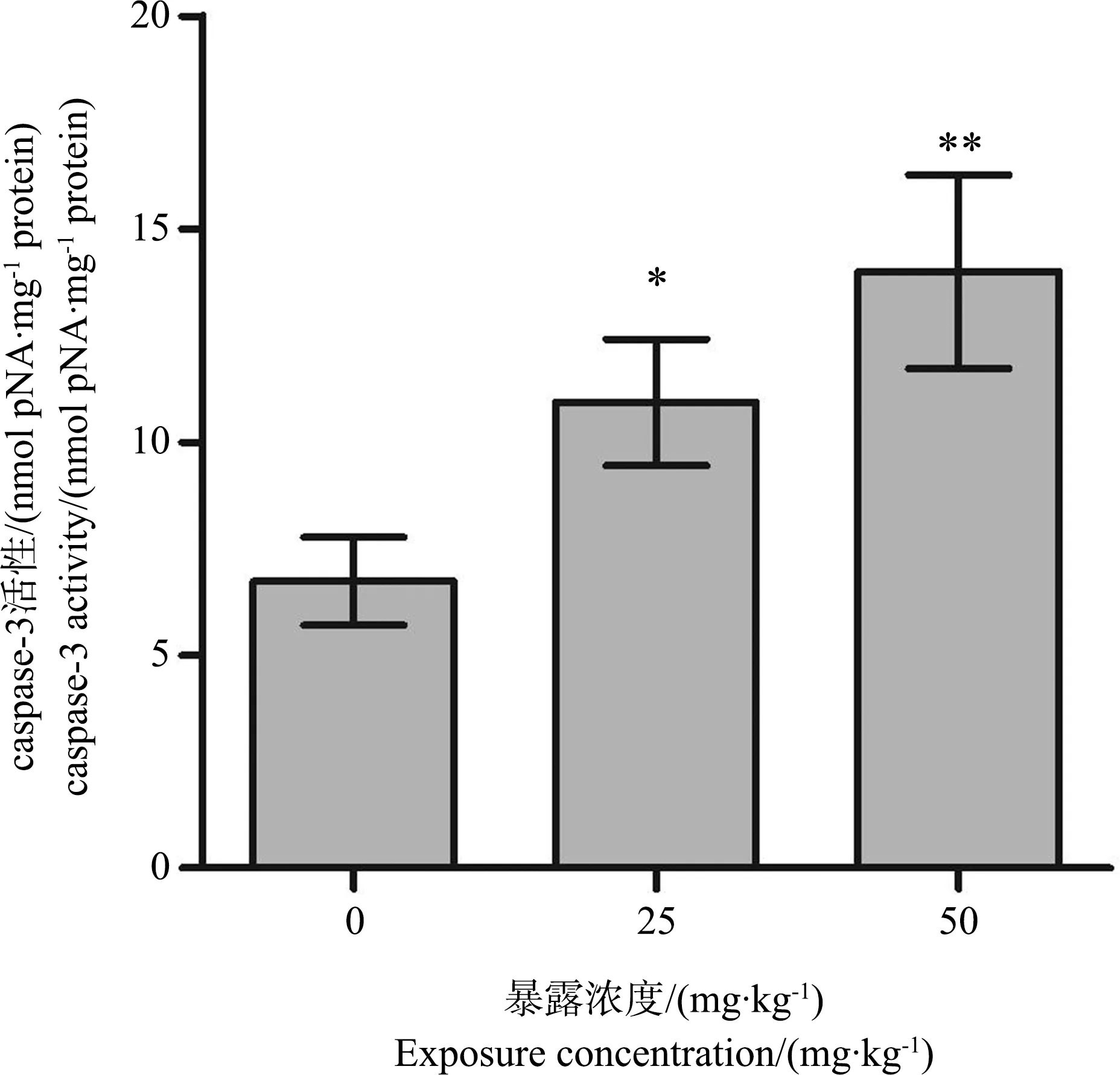
图5 小鼠海马半胱氨酸天冬氨酸蛋白酶-3(caspase-3) 活性测定结果注:与对照组相比,* P<0.05,** P<0.01。Fig. 5 The activity of cysteinyl aspartate specific proteinase-3 (caspase-3) in mouse hippocampus Note: *P<0.05, ** P<0.01 versus the control group.

