固化pH梯度毛细管等电聚焦整体柱的制备及在蛋白质等电点分析中的应用
刘让东, 许歆瑶, 王薇薇, 王 彦, 闫 超
(上海交通大学药学院, 上海 200240)
美国Likky公司在1982年首次将重组胰岛素投放市场,标志着第一个重组蛋白质药物的诞生[1]。自其诞生以后,相对于传统化学药物而言,蛋白质药物研发成本相对较低、风险较小且更安全可靠;因此,蛋白质药物的研究成为现今药物研发领域的热点[2-7]。但是,蛋白质药物的结构异常复杂,微小的结构改变常会对其生物活性和特异性表达有着明显的影响。在蛋白质药物的生产过程中,会因生产条件的变化而导致其异构体、突变物、多聚体等的形成。然而,用普通的检测仪器(如HPLC、MS等)难以辨别这些细微差别所引起的等电点(pI)的变化,不能很好地对蛋白质药物进行质量控制。
毛细管等电聚焦(capillary isoelectric focusing, cIEF)兼具传统凝胶IEF(isoelectric focusing)的高分辨率和毛细管电泳的自动化、高效的优势,可用于蛋白质纯化的检测、蛋白质等电点和电荷差异性测定等,在蛋白质分析和蛋白质组学等生命科学领域都有很好的应用。近年来,一些公司及科研机构陆续发表了cIEF方法用于单抗等生物两性物质的研究工作。2018年,百时美施贵宝公司的Dai等[8]报道了采用cIEF-MS技术对单抗药物的电荷异质性进行分离和表征。同年,Wang等[9]实现了利用cIEF-MS技术对肽类、蛋白质类以及单抗药物的等电点和分子量的分析。Srivorakun等[10]基于cIEF系统来诊断东南亚人群中常见的血红蛋白病;Meng等[11]通过对标准多肽的等电点的测定,验证了cIEF-WCID(whole column imaging detection)的准确性和重复性。但是,这些自由溶液cIEF的方法需向样品溶液中添加一定浓度的载体两性电解质(carrier ampholytes, CAs),以保证形成pH梯度,这会导致其检测波长可选性有限(一般选择280 nm),且CAs还会带来检测稳定性差、灵敏度低、不易与MS联用等缺点。
然而,固化pH梯度毛细管等电聚焦不需在缓冲溶液和样品中添加其他的能产生pH梯度的物质,具有方法稳定、重复性好、检测干扰小、灵敏度高的特点。同时,在固化pH梯度柱的制备过程中,基质材料的引入有可能拓宽原有CAs的pH范围,从而达到对极端的酸性或碱性蛋白质检测的目的。目前,聚合物材料因其制备简单、操作方便而被广泛地用作固化pH梯度毛细管等电聚焦柱的制备基质[12-19]。本文根据课题组[20]先前制备固化pH梯度涂层毛细管开管柱的方法,制备了pH 3~10范围的基于聚乙二醇双丙烯酸酯-甲基丙烯酸缩水甘油酯材料(PEGDA-GMA)的固化pH梯度毛细管等电聚焦整体柱(M-IPG)。在柱上“单点”检测时,制备的M-IPG柱的pH范围能够实现对所用CAs范围的覆盖。同时,基于该M-IPG柱具有较大反压的特点,搭建了新型的等电聚焦平台。为了检验该M-IPG柱的效果,设计了平行对照实验:以曲托珠单抗和依那西谱为分析对象,同时用羟丙基纤维素(HPC)涂层柱与M-IPG柱对该蛋白质药物进行等电点测定。另外,本文也将从实验的各个角度对上述两种方法进行对比,如等电聚焦柱的制备难易、pI的测定结果、峰宽、分离度、分析时间等。
1 实验部分
1.1 仪器与试剂
CE1000毛细管电泳仪、qCE-3010/HVP高压电源、TriSep-2100微流控制器(美国通微); KQ5200DE超声仪(昆山市超声仪器有限公司); LC-20AD HPLC泵(日本岛津); Longerpump LSP01-2A微流注射泵(河北保定兰格恒流泵有限公司);漩涡VORTEX-GENIE2混合器(美国Scientific Industries); DZF-1B真空干燥箱(上海博泰实验设备有限公司); JD200-3电子天平(郑州南北仪器有限公司); Molcell 1805V摩尔细胞型纯水仪(重庆摩尔水处理设备有限公司)。
PEGDA(质量分数97%,平均相对分子质量为258)、GMA(质量分数98%)、3-(三甲氧基甲硅基)甲基丙烯酸丙酯(γ-MAPS,质量分数97%)(美国ALDRICH),偶氮二异丁腈(AIBN, AR(analytical reagent))(上海第四试剂厂),甲醇(AR)、正癸醇(AR)、二氯甲烷(AR)、H3PO4(AR)、NaOH(AR)(中国医药基团), Pharmalyte 3-10(reagent grade)(瑞典GE), HPC(质量分数98%)(美国Sigma),细胞色素c(cytochrome c, reagent grade)、胰蛋白酶原(trypsinogen, reagent grade)、肌红蛋白(myoglubin, reagent grade)(中国Sangon),碳酸酐酶(carbonic anhydrase, 1.5 U/mg)、牛血清白蛋白(BSA, biotech grade)(中国J&K),依那西谱(etanercept,质量分数97%)(德国Boehringer Ingelheim Pharma GmbH & Co. KG),曲托珠单抗(trastuzumab,质量分数97%)(瑞士Roche),聚亚酰胺涂层毛细管(75 μm i. d., 375 μm o. d.)(河北永年锐沣色谱器件有限公司)。
1.2 实验方法
1.2.1样品溶液的配置
5%(质量体积分数)HPC溶液:取0.05 g HPC于1.5 mL的EP管中,加入600 μL 60 ℃纯净水,室温下搅拌至完全溶胀,形成胶体,然后再加入400 μL纯净水,混合均匀,即为5%(质量体积分数)的HPC溶液。
标准蛋白质样品:分别配置5 g/L的标准蛋白质储备液;待用时分别移取适量上述蛋白质储备液于一个0.5 mL离心管中,依次移取纯净水、已经制备好的5%(质量体积分数)HPC溶液和载体两性电解质(Pharmalyte 3-10)加入其中,振摇使其混合均匀,制得相应样品溶液。
称取少许不同蛋白质纯品,将其溶入去离子水中,标为贮备液,放入2~8 ℃的冰箱中。根据实际情况配置不同浓度的混合标准蛋白质溶液,具体各混合标准蛋白质溶液浓度见后文各色谱图。
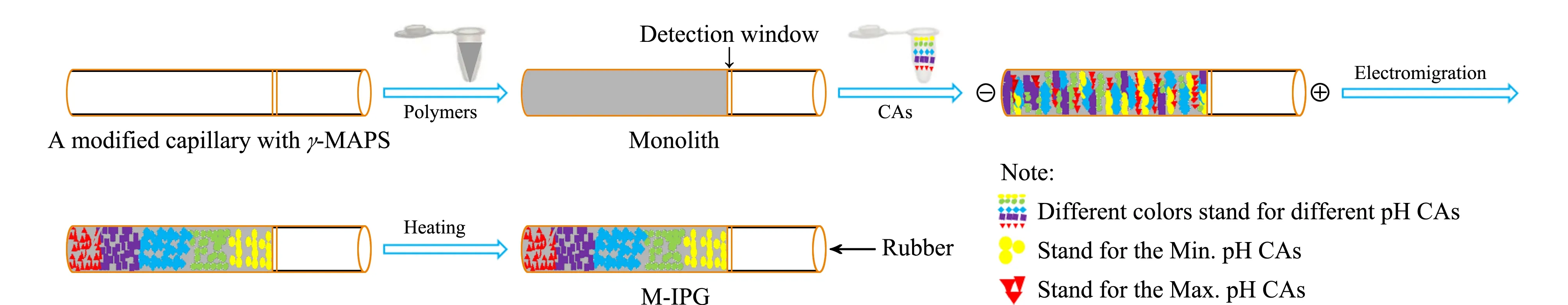
图 1 固化pH梯度毛细管等电聚焦整体柱(M-IPG)的制备Fig. 1 Preparation of capillary isoelectric focusing with monolithic immobilized pH gradient (M-IPG)γ-MAPS: 3-(trimethoxysilyl) propyl methacrylate; CAs: carrier ampholytes.
1.2.2M-IPG柱的制备
新买的毛细管分别经过1.0 mmol/L氢氧化钠处理30 min、去离子水处理10 min、0.1 mmol/L盐酸处理30 min、去离子水处理10 min、纯甲醇处理30 min, N2气吹干,待用。M-IPG柱的制备如图1所示,配置50%(体积分数)的γ-MAPS甲醇溶液,并将该溶液填入上步中预处理的干燥毛细管中,待填满后,于60 ℃烘箱中放置12 h。取出毛细管后,用甲醇冲1 h, N2气吹干,待用。接下来,称取GMA(15.0 mg)、PEGDA(30.0 mg)、甲醇(27.0 mg)和正癸醇(40.5 mg),混匀;然后加入AIBN(1.0 mg),混匀,N2气吹5 min。取修饰后的50 cm长毛细管,用记号笔在柱长的35 cm处标记,然后吸取该溶液至标记处,两端用橡皮塞密封,并于60 ℃下反应12 h。待反应完成后,取出毛细管柱,并依次用甲醇冲2 h、水冲1 h。
配置7%(体积分数)CAs溶液,并将该溶液通过HPLC泵注入上述毛细管整体柱中(入口端到检测窗口),待完成后进行电迁移。将有整体填料的毛细管一端放入盛有20 mmol/L NaOH的阴极溶液中,无整体材料的毛细管一端放入盛有20 mmol/L H3PO4的阳极溶液中,调整CE仪器中的参数(12 kV,T(电压从0 kV至12 kV所需时间)=360 s),待电流稳定后,继续加电5 min后断电。将该毛细管柱两端用橡皮密封,于70 ℃烘箱中放置20 h。然后,依次用去离子水冲1 h、甲醇冲1 h后,用N2气吹干,待用。因此,所得到的固化pH梯度毛细管柱的pH顺序为从毛细管入口端到检测窗口逐渐减小,即靠近窗口端的pH小。当在该等电聚焦柱上进行样品分离时,pI小的蛋白质样品将先被检测。
1.2.3HPC涂层毛细管柱的制备
根据文献[21]方法,取内径为75 μm的毛细管,分别经纯水、1.0 mmol/L NaOH溶液、甲醇各处理30 min,然后用N2吹干;将50 cm长的该毛细管充满5%(质量体积分数)HPC,于室温下放置2 h;用N2将HPC吹出后,将毛细管置于60 ℃烘箱中,然后调整温度到140 ℃,待温度稳定到140 ℃时,保持25 min。之后将该毛细管取出,用氮气吹10 min,并于室温下保存待用。
1.2.4M-IPG柱法采用1.2.2节中自制的M-IPG柱(有效长度/总长:35 cm/50 cm,内径75 μm)进行试验,该柱在使用前用H2O冲洗10 min,实验在图2所示的平台中完成。在全柱进样过程(从入口端到检测窗口)中,通过八通进样阀将供试品溶液注入定量环中,打开HPLC泵,将供试品溶液缓缓推入M-IPG柱中,待基线发生明显跳动时,切换八通进样阀和三通阀。之后,将该毛细管柱的出口端放入阳极缓冲溶液(20 mmol/L H3PO4)中;选择正模式(入口端与零极接触,出口端与正极接触),设置电压为12 kV,聚焦时间分别为20 min(曲托珠单抗)和25 min(依那西谱),并打开微流注射泵,使其提供阴极缓冲溶液(20 mmol/L NaOH)。聚焦完成后,关闭高压电源,再次切换八通进样阀和三通阀,将聚焦的蛋白质区带移向检测窗口。

图 2 在线毛细管等电聚焦平台Fig. 2 Online capillary isoelectric focusing (cIEF) platform
1.2.5HPC涂层毛细管等电聚焦柱法
使用涂层熔融石英毛细管(有效长度/总长:35 cm/50 cm,内径:75 μm);新制备的50 cm长的HPC涂层毛细管使用前在距离出口端15 cm处烧制窗口,并用0.1%(质量体积分数,下同)HPC的水溶液冲洗5 min。将出口端用特氟龙管与1.0 mL注射器相连,入口端放入1.5 mL的供试品EP管中,抽拉注射器,使供试品溶液填满整根HPC涂层毛细管柱。然后,将该毛细管柱的出口端放入阴极缓冲溶液(20 mmol/L NaOH+0.1% HPC)中,将入口端放入阳极缓冲溶液(20 mmol/L H3PO4+0.1% HPC)中。聚焦时,聚焦电压为18 kV,聚焦时间为15 min。样品迁移时,使用微流泵缓缓将聚焦样品区推向检测窗口。每两次进样间和实验结束后,用0.1% HPC水溶液冲洗5 min。
2 结果与讨论
2.1 HPC涂层毛细管柱
2.1.1HPC涂层毛细管柱的系统适用性及其线性关系
为了考察新制备的HPC涂层毛细管柱的系统适用性及其线性,配制了pH 4.8~10.2范围的4种模型蛋白质(细胞色素c、胰蛋白酶原、肌红蛋白、牛血清白蛋白)的供试品溶液进行等电聚焦分离。结果如图3所示,HPC涂层毛细管柱能够对4种模型蛋白质进行聚焦分离,且各峰的峰形良好。同时对4种模型蛋白质的等电点与其迁移时间进行线性拟合,其线性相关系数为r=0.988 7(不理想)。在对该HPC涂层毛细管柱进行电泳实验时(实验条件:缓冲溶液为pH 9.76的10 mmol/L H3PO4;电压为18 kV;λ=236 nm;样品为0.2 mmol/L硫脲,Mt(迁移时间)=34.5 min(裸管时,Mt=7.7 min)),发现该柱存在微小的电渗流;因此,推测该HPC涂层柱上的微小电渗流导致了上述不理想的相关系数。

图 3 4种模型蛋白在羟丙基纤维素(HPC)涂层毛细管柱中的等电聚焦图Fig. 3 Electropherogram of the four protein standards in the capillary coated with HPC (hydroxypropyl cellulose) EL (effective length)/TL(total length)=35/50; i. d.=75 μm; focusing voltage: 18 kV; focusing time: 15 min; u (flow rate) of mobilizing: 200 nL/min; detection wavelength: λ=280 nm. Samples: 0.2 mmol/L cytochrome c+0.2 mmol/L trypsin inhibitor+0.2 mmol/L myoglobin+0.2 mmol/L BSA (bovine serum albumin)+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10. pI: isoelectric point.
2.1.2HPC涂层毛细管柱的重复性
在相同的条件下,HPC涂层毛细管柱连续进样6针的等电聚焦结果中,各模型蛋白质的迁移时间的RSDs在0.8%~1.8%之间,表明该HPC涂层毛细管柱的重复性良好。
2.1.3HPC涂层毛细管柱对曲托珠单抗和依那西谱的等电聚焦分离
图4是曲托珠单抗和依那西谱在HPC涂层毛细管柱上的等电聚焦分离图。可以看出,曲托珠单抗聚焦成单一主峰,而依那西谱为多重峰的混合物,这种结果与文献[22,23]报道的一致。

图 4 曲托珠单抗和依那西谱在HPC涂层毛细管柱中的等电聚焦分离图Fig. 4 Electropherogram of trastuzumab in the capillary coated with HPC Experimental conditions are the same as those in Fig. 3. Samples: 0.1 mmol/L trastuzumab+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10, and 0.22 mmol/L etanercept+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10.
2.1.4HPC涂层毛细管柱对曲托珠单抗和依那西谱pI的测定

图 5 (a)曲托珠单抗和(b)依那西谱的pI测定的等电聚焦图Fig. 5 Electropherogram of pI determination of (a) trastuzumab and (b) etanercept in the capillary coated with HPC Experimental conditions are the same as those in Fig. 3. Samples: a. 0.1 mmol/L trastuzumab+0.2 mmol/L cytochrome c (labeled as inner mark 1)+0.2 mmol/L myoglobin (labeled as inner mark 2)+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10; b. 0.88 mmol/L etanercept+0.2 mmol/L myoglobin (labeled as inner mark 1)+0.2 mmol/L BSA (labeled as inner mark 2)+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10.
由2.1.1节中HPC涂层毛细管柱的线性相关结果可知,如采用外标法将会对实际结果影响较大,不适用对未知蛋白质进行pI测定。因此,根据2.1.3节的实验结果并结合相关文献报道[24],在2.1.1节供试品溶液的基础上分别加入已知pI的内标物(细胞色素c、肌红蛋白、牛血清白蛋白,具体见图5)。在相同的实验条件下,加内标蛋白质后的曲托珠单抗和依那西谱的等电聚焦结果如图5a和5b所示。通过对内标蛋白质的等电点与其迁移时间进行线性相关性考察,可得到相应的线性方程,并将曲托珠单抗的迁移时间代入该方程可得到其等电点为8.1,该结果与文献报道(pI=7.76~8.49)一致[25];同理,可得到依那西谱各峰的pI范围为5.3~6.7,其与文献报道(pI=4.5~6.8)一致[23]。

图 6 (a)处理的毛细管柱、(b)GMA-PEGDA整体柱和(c)M-IPG的扫描电镜图Fig. 6 Scanning electron micrographs of (a) a modified capillary, (b) GMA-PEGDA (glycidyl methacrylate-poly(ethyleneglycol) diacrylate) monolith, and (c) M-IPG
2.2 M-IPG柱
2.2.1M-IPG柱的表征
图6是预处理毛细管柱、GMA-PEGDA整体柱和M-IPG的电镜图。从图6a可知,修饰后的毛细管柱内表面有一层薄薄的化合物,该薄层证明γ-MAPS被成功地键合到了毛细管的内壁上。在GMA-PEGDA整体柱中(图6b),球形单元聚集成大簇并且能看到明显的整体柱的穿透孔隙。通过与图6b相比,图6c的球形单元有微小的变化,说明这些球形单元的表面键合上了CAs分子。
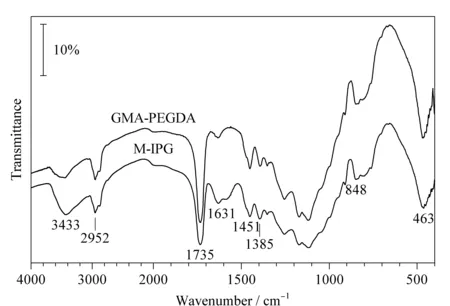
图 7 (a)GMA-PEGDA型整体柱及(b)M-IPG柱的红外光谱Fig. 7 Infrared spectrum of (a) the GMA-PEGDA monolith and (b) M-IPG column
此外,从GMA-PEGDA型整体柱及M-IPG柱的红外光谱(见图7)可以观察到3 433 cm-1处聚合物νO-H和νN-H的吸收峰,以及1 735 cm-1处νC=O的吸收峰。图7b与图7a相比,红外区域存在3个明显的差异区。由于图7b的M-IPG柱中有CAs的存在,νN-H(3 433 cm-1)和νC-N(1 631 cm-1)吸收谱带得到增强;此外,δC-H(1 385 cm-1)的吸收谱带也被发现有增强,这也进一步证明了CAs已经被固化在了该整体柱上。
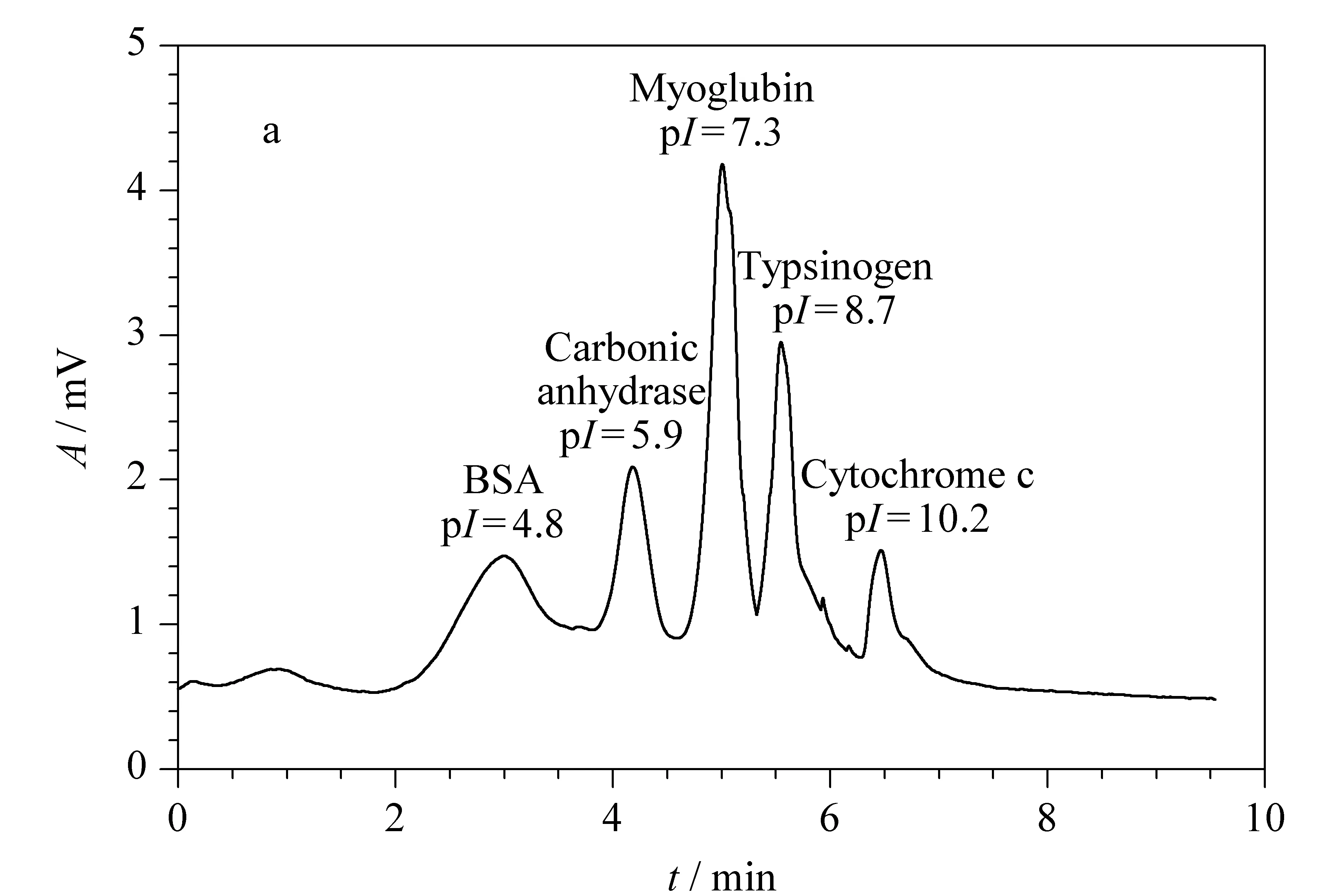
图 8 5种标准蛋白质在M-IPG柱中的分离图Fig. 8 Electropherogram of the five protein standards in the M-IPG column EL/TL=35/50; i. d.=75 μm; focusing voltage: 12 kV; focusing time: 25 min; u of mobilizing: 300 nL/min; detection wavelength: λ=280 nm. Samples: 0.2 mmol/L cytochrome c+0.2 mmol/L trypsinogen+0.2 mmol/L myoglobin+0.2 mmol/L carbonic anhydrase+0.2 mmol/L BSA+0.1% (w/v) HPC+3% (v/v) Pharmalyte 3-10.
2.2.2M-IPG柱的pH范围和线性关系
为了验证自制的M-IPG柱的pH范围,选择pH 4.8~10.2范围的5种模型蛋白质混合物(牛血清白蛋白、碳酸酐酶、肌红蛋白、胰蛋白酶原和细胞色素c)对其进行pH范围表征。该混合物的等电聚焦分离情况如图8所示,自制的M-IPG柱能够成功地对该蛋白质混合物进行聚焦分离。同时,根据这些蛋白质的pI值与其出峰时间进行线性拟合,其相关系数为0.985 1。
2.2.3M-IPG柱的重复性、耐受性及使用次数
用M-IPG柱连续对5种模型蛋白质混合物(牛血清白蛋白、碳酸酐酶、肌红蛋白、胰蛋白酶原和细胞色素c)进样6针,其等电聚焦的迁移时间的RSD少于7.6%。在12 kV的高压电场中,M-IPG柱可以运行不少于50次。当超过该次数后,随着聚焦次数的进一步增加,M-IPG柱的聚焦效果会逐渐变差。当更高电场被使用时,M-IPG柱的使用次数也会显著减少。
2.2.4M-IPG柱对曲托珠单抗和依那西谱的等电聚焦分离
如图9所示,自制的M-IPG柱能够对曲托珠单抗和依那西谱进行聚焦分离。在峰形上,曲托珠单抗仍为单一主峰,而依那西谱为多重峰,这表明该M-IPG柱能够对蛋白质药物进行聚焦分离。
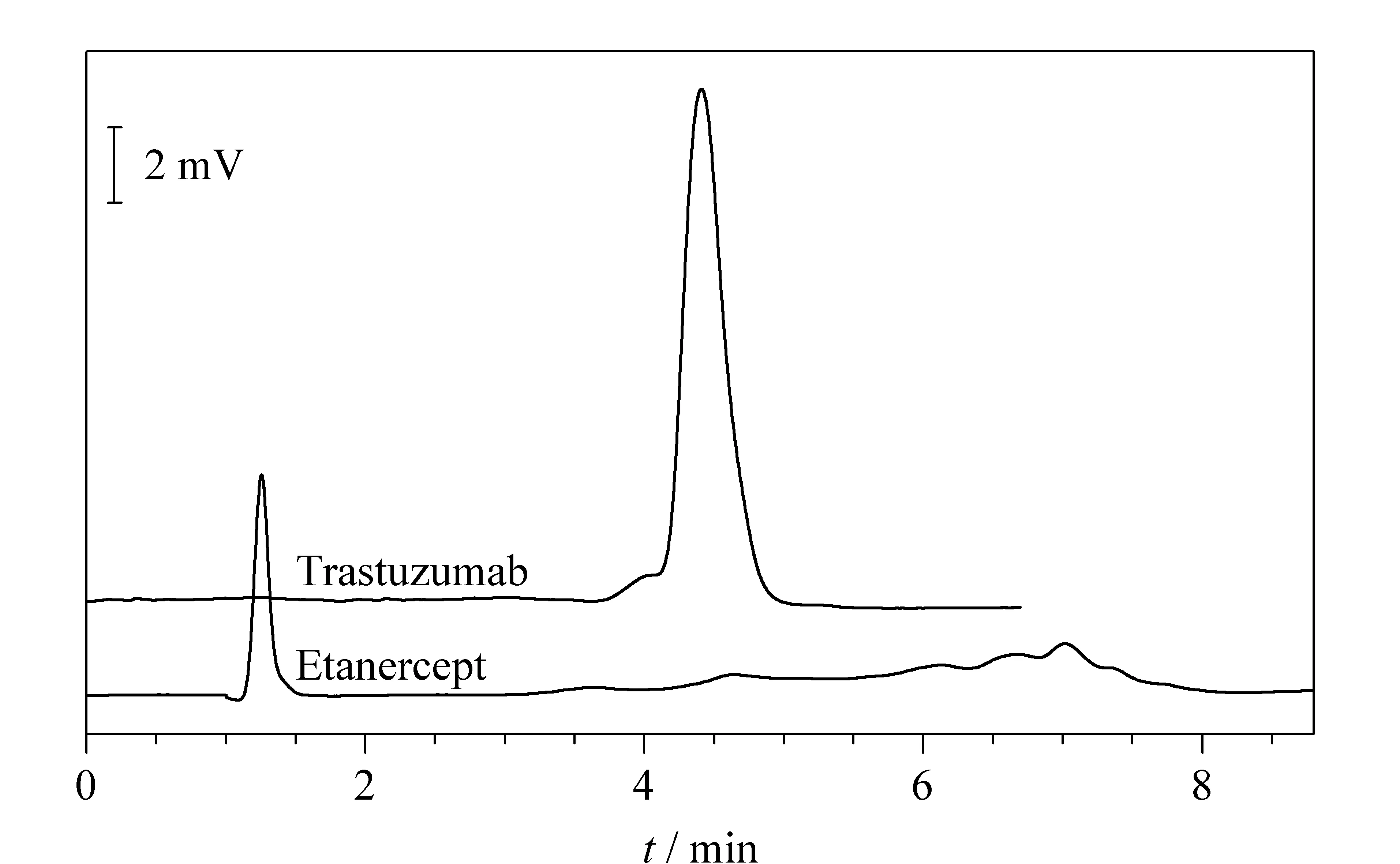
图 9 曲托珠单抗和依那西谱在M-IPG柱中的分离图Fig. 9 Electropherograms of trastuzumab and etanercept in the M-IPG column EL/TL=35/50; i. d.=75 μm; focusing voltage: 12 kV; focusing time: 20 min; u of mobilizing: 300 nL/min; detection wavelength: λ=280 nm. Samples: 0.3 mmol/L trastuzumab; 0.66 mmol/L etanercept.
2.2.5M-IPG柱对曲托珠单抗和依那西谱的pI的测定
图10是M-IPG柱对含内标的曲托珠单抗和依那西谱的等电聚焦分离图。根据两个内标的相应等电点,可以分别测得曲托珠单抗(pI=8.1)和依那西谱(pI=4.9~6.8)的等电点,该结果与HPC涂层柱的测定结果基本一致。
2.2.6M-IPG柱的分辨率
分辨率是色谱柱的重要性能参数,决定着分离的好坏。从图10b可知M-IPG柱的真实分辨度不超过0.1 pH。
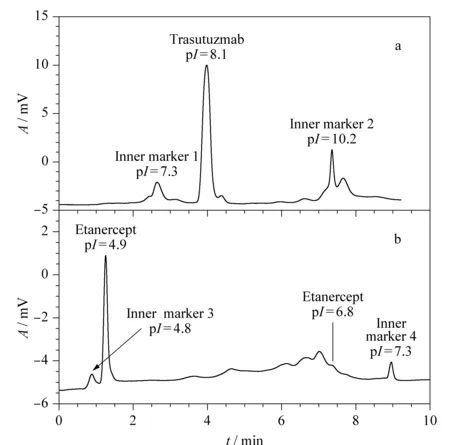
图 10 (a)曲托珠单抗和(b)依那西谱在M-IPG柱中pI测定的等电聚焦图Fig. 10 pI determination of (a) trastuzumab and (b) etanercept in the M-IPG column EL/TL=35/50, i. d.=75 μm; focusing voltage: 12 kV; focusing time: 20 min (trastuzumab) and 25 min (etanerecept); mobilizing: u of mobilizing: 200 nL/min; detection wavelength: λ=280 nm. Samples: a. 0.3 mmol/L trastuzumab+0.2 mmol/L myoglobin (labeled as inner marker 1)+0.2 mmol/L cytochrome c (labeled as inner marker 2); b. 0.66 mmol/L etanercept+0.2 mmol/L BSA (labeled as inner marker 3)+0.2 mmol/L myoglobin (labeled as inner marker 4).
2.3 HPC涂层毛细管等电聚焦和M-IPG方法的比较
对平行试验的HPC涂层毛细管等电聚焦法和M-IPG法两种聚焦方法进行了对比。从实验操作的过程来看,HPC涂层毛细管等电聚焦法更加简单,主要表现在等电聚集毛细管柱的制备和聚焦实验操作简单,但是该方法的样品制备过程复杂、消耗的样品和载体两性电解质溶液更多、基线易发生漂移。对等电点的测定结果、出峰宽度、分离度和分析总时间(聚焦时间+迁移时间)进行了对比,结果见表1。在pI的对比中,HPC涂层毛细管等电聚焦法测定的结果与M-IPG法测定的结果基本一致,符合相关文献的结果。在峰宽的对比中,HPC涂层柱的峰宽略小,表明其分离能力相差不多。同时,在分离的对比中,二者皆可满足对该两种蛋白质类药物等电点测定的要求。HPC涂层柱对依那西谱的分离更好,而M-IPG柱对曲托珠单抗的分离更好。另外,蛋白质药物聚焦后的峰形表明,该M-IPG柱的灵敏度较HPC涂层柱的高,基线更稳定;在分析时间上,M-IPG柱对依那西谱的分析时间明显较HPC涂层柱短。

表 1 HPC涂层毛细管法和M-IPG法的对比
* The separation degree is determined by the minimum separation degree between the sample and the internal standard; W1/2stands for peak width at half height. /: the item is not considered.
3 结论
本文尝试用新制的M-IPG柱对蛋白质药物的pI值进行测定。实验结果表明,在单克隆抗体药物和融合蛋白质药物的聚焦分离及pI测定中,新制的M-IPG柱与传统的HPC涂层柱表现一致。在单点检测平台中,聚焦后的样品迁移能够在无电场作用下完成。以上结果都表明了该柱在进一步构建多维分离平台进行蛋白质组学研究方面的潜力。特别是与质谱联用时,M-IPG柱与HPC涂层柱相比具有更多的优势:一是在电极缓冲液和样品溶液中不添加CAs,提高灵敏度,避免离子源的污染;二是纯水可以作为样品溶剂,不会使蛋白质变性,并允许分析物以其完整的形式被分离和检测。基于这种耦合技术,可以提供目标蛋白质的pI和相对分子质量信息,这将极大地促进蛋白质组学分析和生物标志物的发现。

