FRD特殊染色技术与液基细胞学检查在宫颈癌前病变筛查中的应用对比
刘露晖 李桂宝 王栾玲 黄凤友 陈新妹 赖珍苗 贺凌云 胡红云
[摘要]目的 比较FRD和TCT检查在宫颈癌筛查中的应用价值。方法 采取自身对照法,选取2015年4月~2018年1月我院妇科门诊的2500例患者,均行FRD和TCT检查,FRD或(和)TCT结果阳性,再行阴道镜检查并取宫颈组织活检,以活检结果为金标准,评价FRD和TCT筛查的阳性检出率及FRD和TCT的诊断价值。以灵敏度、特异性、误诊率、漏诊率、阳性预测率、阴性预测率为诊断价值指标。结果 2500例患者中,FRD和TCT的阳性检出率分别为10.32% 和9.96%,两者比较差异无统计学意义(P>0.05)。FRD和TCT的灵敏度、特异性、误诊率、漏诊率、阳性预测率及阴性预测比较,差异均无统计学意义(P>0.05)。结论 FRD和TCT对宫颈癌前病变筛查均具检出效能,診断价值相当。
[关键词]宫颈癌前病变;筛查;叶酸受体介导的宫颈特殊染色;液基薄层细胞学检测
[中图分类号] R737.33 [文献标识码] A [文章编号] 1674-4721(2019)6(c)-0031-04
[Abstract] Objective To compare the application value of folate receptor-mediated detection (FRD) and thin-prep cytology test (TCT) in cervical cancer screening. Methods By self-control method, from April 2015 to January 2018, 2500 patients in the gynaecological clinic of our hospital performed with FRD and TCT examinations were selected. When the FRD or/and TCT outcomes were positive, the cervical biopsy under colposcope was performed. The biopsy result was set as the golden standard. The positive detection rate of FRD and TCT screening and the diagnostic values of FRD and TCT were evaluated, the parameters were sensitivity, specificity, misdiagnosis rate, missed diagnosis rate, positive predictive rate, and negative predictive rate. Results Among 2500 patients, the positive detection rates of FRD and TCT were 10.32% and 9.96%, respectively, there was no significant difference between the two groups (P>0.05). With regard to the sensitivity, specificity, misdiagnosis rate, missed diagnosis rate, positive predictive rate and negative predictive rate of the FRD and TCT, there were no significant differences between the two detection methods (P>0.05). Conclusion FRD and TCT both obtain the effects of screening for cervical precancerous lesions, and the diagnostic value is equivalent.
[Key words] Cervical precancerous lesion; Screening; Folate receptor-mediated tumor detection; Liquid-based thin-prep cytology test
宫颈癌是妇产科常见的恶性肿瘤[1],每年新发病约13.2万,死亡5万[2],并有年轻化趋势[3-4]。宫颈癌有明显的癌前病变期,而且发展缓慢,但多数患者就诊时已经处于晚期,失去了最佳治疗时机,因此宫颈病变的早期筛查十分重要[5]。尽早发现癌前病变,及时干预是阻断宫颈癌发展的关键,能使发病率与死亡率大大下降[6-7]。液基薄层细胞学(thinprep cytologic test,TCT)是目前先进的筛查技术[8],虽然其灵敏度高,特异性强,但仍存在较多不足,如要求精密设备仪器及专业技术人员、取材送检程序烦琐、检测费用昂贵、等待结果时长等。为此,寻找经济实用、方便快捷的检测方法是值得探究的问题。本研究采用叶酸受体介导的宫颈特殊染色(folate receptor-mediated tumor detection,FRD)与TCT检查,对比两者在宫颈癌前病变筛查中的应用价值,旨在探讨适合山区基层医院开展宫颈癌筛查的理想方法。
1资料与方法
1.1一般资料
采用自身对照法,选取2015年4月~2018年1月我院妇科门诊的2500例患者,年龄22~79岁,平均(46.25±19.18)岁,所有患者均行TCT和FRD检查。纳入标准:①已婚或未婚有性生活史;②有性生活出血史或白带异常。排除标准:①接受过子宫全切手术;②接受过宫颈手术,包括锥切、环切、激光、红外线、微波等;③宫颈接触性出血量较大;④孕妇;⑤急性炎症;⑥宫颈CIN Ⅱ或以上者。所有入选病例均知情同意本研究,征得患者同意后进行FRD和TCT检查,其中FRD或(和)TCT阳性者行阴道镜检查,并取宫颈活组织检查,以活检结果为金标准对比FRD和TCT的应用价值。本研究通过我院医学伦理委员会审核批准。
1.2检查方法及判断标准
入选病例在常规妇科检查后即做FRD染色,再用无菌大头棉签轻轻抹净宫颈及宫颈口染色液,然后取TCT标本。如FRD结果阳性可接着做阴道镜及活检,也可待TCT结果出来后1~2个月内再做。只要FRD或TCT其中一项阳性均需做阴道镜及活检。FRD、TCT及阴道镜均避开月经期,24 h内无性生活,3 d内无阴道灌洗或阴道上药,3个月内未使用激素。FRD、TCT、阴道镜、活检取材等操作均由通过专业培训的妇科医生执行,TCT与病理组织活检由通过专业培训的病理医生完成。
1.2.1 FRD染色 染色液由陕西高源医疗器械服务有限公司生产,在常规妇科检查后即行FRD检查。①宫颈管染色:暴露宫颈,将无菌小頭棉签浸泡于FRD染色液中<2 s至近饱和,再插入宫颈管3~5 cm,沿颈管内壁旋转5圈,逐步拉出棉签,观察其颜色;②宫颈染色:将无菌大头棉签浸泡于FRD染色液中<5 s至近饱和,用力涂抹宫颈5圈,再按压宫颈口5 s后取出棉签,观察其颜色。棉签颜色与标准色卡对比在2 min内完成,判断标准[9]如下。①阴性:棉签为黄棕色、绿色或茶褐色,提示宫颈无异常病变;②阳性:棉签颜色为蓝色、蓝黑色、黑色,提示宫颈异常病变,建议阴道镜检查并取活检。
1.2.2 TCT检查 细胞保存液为长沙康柏恩医疗科技有限公司生产。在FRD染色后行TCT检查,用干燥大头棉签抹净FRD染色液。先用无菌采样刷伸入宫颈管内约1 cm,顺时针方向轻转5圈,将获取的宫颈及宫颈管细胞洗入盛有细胞保存液的小瓶中送病理科,判断标准采用TBS系统分级[3],具体如下。①无上皮内病变或恶性病变(NILM);②鳞状上皮细胞异常:未明意义的不典型鳞状上皮细胞(ASC-US)及不除外高度鳞状上皮病变的不典型鳞状细胞(ASC-H)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)、鳞癌(SCC);③腺上皮异常:非典型腺细胞(AGC)、原位腺癌(AIS)、腺癌(AC)。病变级别在ASC-US和AGC及以上者为阳性,LSIL及以上者为宫颈高度病变,均需阴道镜检查并于宫颈取活检病理证实。
1.2.3阴道镜检查及活检取材 电子阴道镜为深圳金科威SLC 2000电子阴道镜成像系统。FRD或/和TCT阳性者均行阴道镜检查,于月经干净后3~7 d进行。用一次性扩阴器暴露宫颈,在阴道镜下放大20倍观察,于宫颈可疑部位多点取活检组织,阴道镜图像正常者于鳞柱状细胞交界处3、6、9、12点取材,采集标本记好取材位置后送病理科。
1.2.4宫颈活组织病理学检查 诊断标准参照2003年WHO子宫颈肿瘤组织学分类标准,包括慢性炎症、宫颈上皮内瘤变(CIN)及浸润癌。其中CIN分为CIN Ⅰ级、CIN Ⅱ级、CIN Ⅲ级。CIN Ⅲ级包括原位癌,浸润癌分为SCC及AC。将≥CIN Ⅰ级定为病理学阳性病变。
1.3评价指标
①评价FRD和TCT筛查阳性检出率,FRD检出率=FRD阳性例数/2500×100%,TCT检出率=TCT阳性例数/2500×100%;②统计FRD与活检结果情况;③统计TCT与活检结果情况;④评价FRD和TCT诊断价值。以病理科的活检结果为金标准评价FRD和TCT的灵敏度、特异性、误诊率、漏诊率[3]、阳性预测率、阴性预测率[10],相关计算方法如下:灵敏度=a/(a+c)×100%,特异性=d/(b+d)×100%,误诊率=b/(b+d)×100%,漏诊率=c/(a+c)×100%,阳性预测率=a/(a+b)×100%,阴性预测率=d/(c+d)×100%。其中a表示真阳性,即FRD/TCT阳性,活检也阳性;b表示假阳性,即FRD/TCT阳性,而活检为阴性;c表示假阴性,即FRD/TCT阴性而活检为阳性;d表示真阴性,即FRD/TCT阴性、活检为阴性。
1.4统计学方法
采用SPSS 19.0统计学软件处理数据,计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
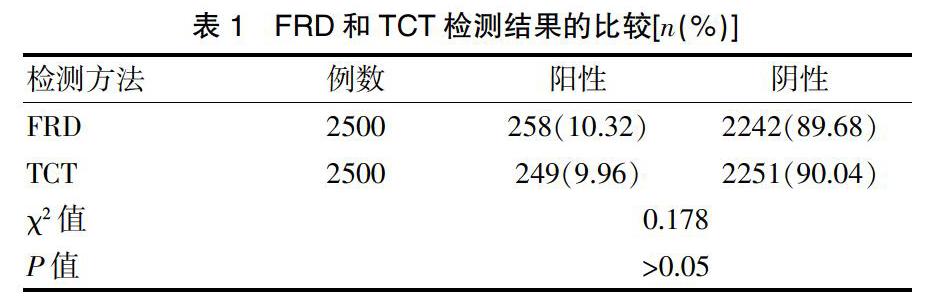
2.1 FRD和TCT筛查阳性检出率的比较
2500例患者中,FRD和TCT阳性检出率分别为10.32%(258/2500)和9.96%(249/2500),两者比较差异无统计学意义(P>0.05)(表1)。
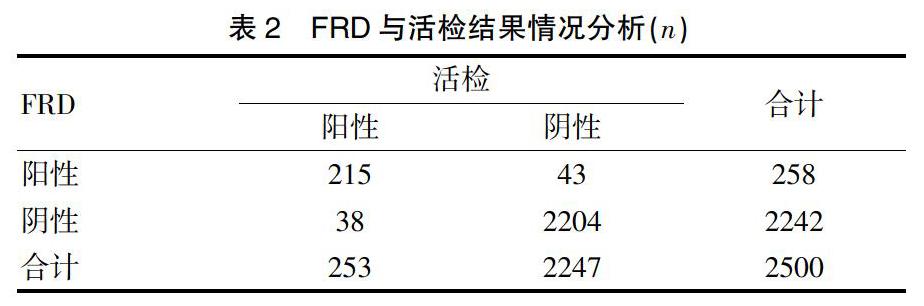
2.2 FRD与活检结果情况分析
2500例患者中,FRD阳性258例,其中215例活检阳性,43例活检阴性。FRD阴性的2242例患者中,38例活检阳性,即虽然FRD阴性,但TCT阳性而活检被检出阳性的患者,具体见表2。
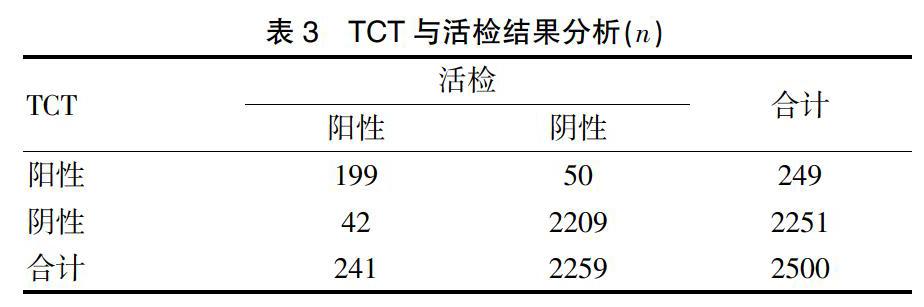
2.3 TCT与活检结果情况分析
2500例患者中,TCT阳性249例,其中199例活检阳性,50例活检阴性。TCT阴性的2209例患者中,42例活检阳性,即虽然TCT阴性,但FRD阳性而活检被检出阳性的患者,具体见表3。
2.4 FRD和TCT诊断价值相关指标的比较
按照设定公式代入相关数据得出FRD和TCT的灵敏度、特异性、误诊率、漏诊率、阳性预测率、阴性预测率等指标。两组分别比较,差异均无统计学意义(P>0.05)(表4)。
3讨论
FRD是利用宫颈病变细胞内发生异常变化表现出的不同颜色来判断病变性质,是用于人体上皮组织肿瘤活细胞的染色剂[11],由于叶酸受体在多数肿瘤细胞表面高表达,在正常细胞表面少表达,所以叶酸复合物作为肿瘤特殊靶向介导分子用于诊断技术。FRD活性染色剂由还原态亚甲蓝、叶酸衍生物、乙酸等组成[12],当活细胞染色剂涂抹于宫颈上皮后,若遇肿瘤细胞,叶酸衍生物就会与其表面的叶酸受体结合进入细胞质[13]。乙酸可使细胞内环境pH值下降至5.0~5.5,此时叶酸衍生物、还原态亚甲蓝与叶酸受体分离。还原态无色的亚甲蓝在肿瘤细胞内亚铁离子的催化下,迅速生成氧化还原态的亚甲蓝。大量生物大分子进入细胞内致渗透压升高,使氧化还原态亚甲蓝溢出细胞外,表现为变色反应[10],因此在涂抹的棉签上显示颜色,以棉签颜色的深浅判断宫颈病变的异常程度。颜色变为蓝色、蓝黑色、黑色,表示病变部位的叶酸受体数量异常增多,提示可能有癌前病变或癌变,需要进一步检查。
研究显示,宫颈癌是人类目前所有癌症中唯一病因明确且可防治的癌症[14]。宫颈癌前病变发展成癌的过程缓慢,需要相当长的时间[15-16],采取门诊筛查宫颈癌前病变,早诊、早治是预防和控制子宫颈癌的重要手段[17],也是阻断癌前病变发展的唯一途径[18],因此灵敏度高和特异性强的筛查方法尤为重要。TCT是目前最有效的检查方法之一,利用液基薄层细胞制片技术去除涂片杂质,获得高质量薄片后能够清晰显示细胞结构,故容易发现异常上皮细胞,其对于细胞学分类诊断具有重要价值[19],对宫颈癌细胞的检出率高达100%,对部分癌前病变也较易检出[8]。但是,TCT必须用刷子在宫颈口顺时针方向旋转5圈致细胞脱落才能获取足量的宫颈细胞送检,而专用的宫颈刷质地较硬,对宫颈组织有不同程度的损伤,取材后时常有出血现象,且报告周期长,患者容易流失;而FRD是宫颈脱落细胞染色,取材方便,不需要提取组织细胞标本,对机体无创伤,可实时出具检测结果,患者容易接受。
本研究结果显示,FRD的阳性检出率为10.32%,TCT的阳性检出率为9.96%,两种方法对宫颈癌前病变均具检出效能,差异无统计学意义(P>0.05);以活检标准判断FRD与TCT的灵敏度、特异性、漏诊率、误诊率、阳性预测率和阴性预测率等评价指标,其两者数值相近,同样具有诊断价值。两组指标分别比较,差异均无统计学意义(P>0.05);但FRD较TCT检测操作简单,判断结果直观,不需要特殊设备仪器和复杂专业技术培训,适用于检测设备落后的偏远地区[20-21]及基层医院普查宫颈癌。
综上所述,FRD和TCT用于宫颈癌前病变筛查均是目前较好的检验方法,但FRD为无创检查,方便快捷,经济实用,值得推广。
[参考文献]
[1]吴晓霞.阴道镜检查联合醋酸白试验在宫颈癌普查中的应用探讨[J].中国现代药物应用,2014,8(7):26-28.
[2]余小琴.液基薄层细胞学在宫颈癌筛查中的应用[J].临床输血与检验,201l,13(3):254-257.
[3]张朝红,黄玮,薛晓玲,等.宫颈特殊染色法上皮组织特殊染色液在宫颈病变检查中的临床意义[J].中国医学前沿杂志(电子版)2014,6(9): 45-48.
[4]甘海英,李莉莎,林琼.宫颈特殊染色法联合高危型HPVDNA检测在宫颈病变筛查中的应用[J].当代医学,2018,24(5):68-69.
[5]张萍,陶瑞环,曹惠桃.叶酸受体介导的宫颈特殊染色法与TCT联合HPV在宫颈病变初筛中的对比研究[J].中国医药科学,2017,7(11):239-241.
[6]林丹,罗新,蒋学风,等.DNA倍体分析联合高危型人乳头瘤病毒检测筛查宫颈病变[J].实用妇产科杂志,2014,30(7):531-534.
[7]张雪梅,覃福宁,孙奇,等.宫颈 DNA 倍体分析及 TCT在宫颈病变早期筛查中的临床意义[J].重庆医学,2016,45(14):1974-1976.
[8]邓翠,康佳丽,蒋文燕,等.叶酸受体新技术及细胞学检查对宫颈癌筛查应用价值的评估[J].中国医师杂志,2014, 16(8):1064-1067.
[9]黄彩平,李日红,邓惠宜,等.FRD上皮组织特殊染色液在宫颈病变筛查中的应用[J].海南医学,2016,27(14):2260-2262.
[10]陈凯英.叶酸受体介导的宫颈特殊染色法联合TCT/HPV在早期宫颈病变中的应用价值[J].中国妇幼健康研究,2014,25(5):828-831.
[11]张朝红,薛晓玲,党蓉芳,等.叶酸受体介导的FRD在宫颈上皮内瘤变和癌变诊断中的应用价值[J].中国实验诊断学,2014,18(8):1295-1297.
[12]费学宁,张勇,张宝莲.叶酸受体亚型高效介导的靶向肿瘤成像和治疗[J].中国科学基金,2014,28(1):26-31.
[13]Zhou JH,Ying J.Folate-chitosan-gemcitabine core shellnanoparticles targeted to pancreatic cancer[J].Chin J Cancer Res,2013,25(5):527-535.
[14]任红英,龙顺姬,邓少君,等.叶酸受体倡导的多功能醋酸白溶液在宫颈癌筛查中的应用研究[J].医学信息,2013, 26(13):316.
[15]杨惠新.宫颈癌前期病变筛查836例结果分析[J].中国医药导刊,2012,14(7):1116.
[16]覃西彪,王红静.年轻宫颈癌的诊疗发展[J].实用妇产科杂志,2013,29(3):181-183.
[17]何川,蔡昱,翟建军.叶酸受体介导宫颈特殊染色法在诊断宫颈病变中的应用价值[J].广西医学,2016,38(8):1115-1118.
[18]彭丹,李丽琴,龚翠梅,等.叶酸受体介导宫颈特殊染色法在宫颈病变筛查中的应用价值[J].国际医药卫生导报,2017,23(7):961-966.
[19]童瑶,陈满萍,徐丽萍.叶酸受体介导的宫颈特殊染色法、TCT以及HPV诊断早期宫颈病变价值的对比分析[J].中国妇幼保健,2015,30(19):3302-3304.
[20]黄彩平,李日红,邓惠宜,等.FRD上皮组织特殊染色液在宫颈病变筛查中的应用[J].海南医学,2016,27(14):2260-2262.
[21]朱彦玲,张杰,刘蓓蓓,等.叶酸受体介导的亚甲蓝活體组织染色剂用于宫颈癌筛查的评价[J].现代中西医结合杂志,2015,24(14):1483-1485,1491.
(收稿日期:2018-11-12 本文编辑:祁海文)

