枯草杆菌蛋白酶QK的活性与氨基酸突变位点的相关性
杨媛媛,周 立,唐艺萍,刘秋晨,梁 宁,王业富
(武汉大学生命科学学院病毒学国家重点实验室,湖北武汉 430072)
枯草芽孢杆菌分布范围广、抗逆性强,是人们最早发现的细菌之一[1]。它能产生芽孢,对高温、酸碱等环境有极强的抗性。它的生长环境多样化,因此具有丰富的产酶系统,可以将多种蛋白质直接分泌到周边环境中,已成为工业酶生产应用最广泛的菌种之一[2]。枯草杆菌蛋白酶是一种碱性的丝氨酸蛋白酶[3],人们对它的使用可以追溯到一千年前,日本人利用枯草芽孢杆菌并采用固态发酵的方法制作传统食品—纳豆[4]。而今,枯草芽孢杆菌在工业发酵产酶上的应用也越来越普遍[1-2]。
枯草芽孢杆菌能分泌枯草杆菌蛋白酶(subtilisin QK,QK蛋白),QK蛋白由381个氨基酸组成,具有溶栓活性,与纳豆激酶(nattokinase)高度同源,可以用于治疗血栓性疾病,具有抗菌、促消化和提升免疫力的功能[3-5]。对于QK蛋白的研究,一般以提高酶活力为标准,或优化发酵条件,或利用生物工程的方法对枯草芽孢杆菌的某些位点进行突变[6-7]。尚无有关天然QK蛋白的氨基酸序列位点突变与其酶活力相关性的研究。本研究从不同的市售纳豆产品种中分离筛选天然的枯草芽孢杆菌,对它们的QK基因进行测序,通过蛋白质比对,初步发现酶活大小与枯草杆菌蛋白酶氨基酸位点变化的关系。
1 材料与方法
1.1 材料与仪器
菌株信息:从广东双骏生物科技有限公司(2/5/6号菌株)、安徽正东生物科技有限公司(3/11/12号菌株)、上海葳环进出口有限公司(7/13/14号菌株)、上海顶舜颖生物科技有限公司(1/4/10/15号菌株)和日研食品杭州有限公司(8/9号菌株)等5个公司分别购入两个批次的QK蛋白粉,用生理盐水溶解后摇培,划线培养,挑单菌落而得。
DL2000 DNA Marker、细菌基因组DNA提取试剂盒(离心柱型) 天根生化科技有限公司;PCR MasterMix 康为世纪;高保真、高效率、高速PCR酶KOD-Plus-Neo TOYOBO公司;胶回收试剂盒 Axygen;尿激酶(Urokinase) 国家药品标准物质中心;纤维蛋白原(Fibrinogen)、凝血酶(Thrombin) Sigma公司;PMD19-T TaKaRa公司;BCA蛋白浓度测定试剂盒 Biosharp公司;其他试剂 武汉阿玛迪生物技术有限公司,试剂均为分析纯。
超净工作台 苏净安泰AIRTECH;多功能酶标仪 美谷分子仪器(上海)有限公司;恒温恒湿培养箱 上海精宏实验设备有限公司;恒温摇床 武汉瑞华仪器设备有限责任公司;PCR仪 TaKaRa生物公司;高压灭菌锅 上海博迅实业有限公司医疗设备厂;电泳槽 北京君意电泳设备有限公司。
1.2 实验方法
1.2.1 培养基的配制 LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,用去离子水定容至1 L。固体培养基在此基础上加入琼脂15 g。
种子培养基和基础发酵培养基:按文献[8]进行配制。
1.2.2 菌株的分离与初筛 参照马明等[8]的方法进行初筛,在无菌条件下分别称取15份蛋白粉样品1.00 g,加入到装有9 mL生理盐水的培养瓶中,200 r/min、37 ℃振荡摇培30 min,划线接种至固体LB培养基上,37 ℃恒温培养12 h后,共挑取到15个单菌落。将15个单菌落分别转移到另一LB平板上,继续培养3天,观察菌落形态。
1.2.3 基因组DNA的提取与引物设计 将1.2.1中挑选出的15个单菌落分别接种至LB液体培养基中,200 r/min、37 ℃恒温培养12 h后,采用细菌基因组DNA提取试剂盒进行基因组DNA的提取。根据NCBI已发表的枯草芽孢杆菌QK基因序列,利用Primer Premier 5软件对基因序列进行分析,设计引物如表1所示,引物由上海生工生物工程有限公司合成。
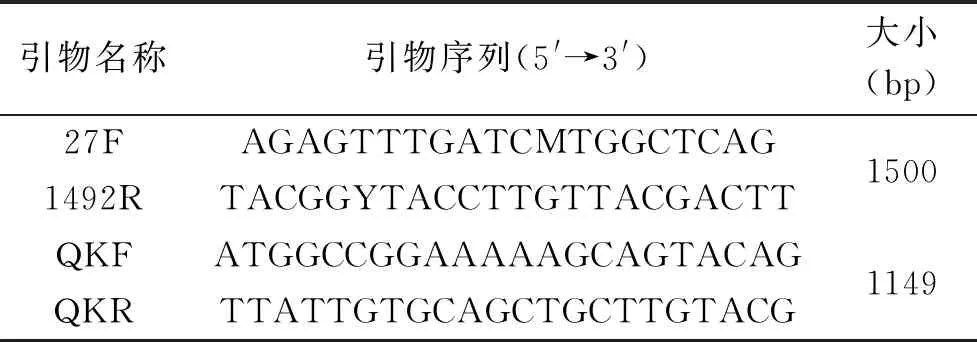
表1 PCR引物序列Table 1 PCR primer sequences
1.2.4 16S rRNA序列分析法验证15株菌株 参考雒焕贞等[9]的方法进行。以枯草芽孢杆菌的总DNA为模板,用引物27F/1492R进行PCR扩增。25 μL反应体系为:12.5 μL 2×Taq PCR MasterMix,1 μL(10 μmol/L)上下游引物,1 μL模板DNA,ddH2O补足至25 μL。
反应程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃复性30 s,30个循环;72 ℃延伸5 min,4 ℃保存。扩增产物以27F/1492R为引物,送至生工生物工程公司进行测序,测序结果输入NCBI中做同源序列搜索。
1.2.5 高保真PCR扩增QK基因序列 将1.2.3的PCR产物经胶回收柱纯化,然后与克隆载体PMD19-T Vector连接,转入大肠杆菌DH5α感受态细胞,之后于37 ℃摇床预孵育1 h,涂蓝白斑筛选培养基,37 ℃培养过夜,挑取白斑进行菌落PCR[10]。以QKF/QKR为引物,以KOD-Plus-Neo试剂盒进行高保真PCR 扩增。50 μL反应体系为:5 μL 10×Buffer,3 μL MgSO4,5 μL dNTPs,1 μL酶,1.5 μL(10 μmol/L)上下游引物,1 μL模板DNA,ddH2O补足至50 μL。
嵌入式学科服务研究是高校图书馆资源迅速增长与用户需求多样性之间的不匹配所形成的针对性服务,是对高校图书馆资源优势、人力优势和服务理念的有效体现,然而由于各个高校图书馆在自身服务能力、基础和理念上的差异,现有的嵌入式学科服务还存在一定的不足。通过分析图书馆网站和专业文献,结合对用户、学科馆员等嵌入式服务中的相关人员的调查研究,发现嵌入式学科服务中还面临不少的问题,具体如下。
反应程序为:94 ℃预变性2 min;98 ℃变性30 s,56 ℃退火30 s,68 ℃复性60 s,33个循环;68 ℃延伸10 min,4 ℃保存。PCR扩增产物经1%的琼脂糖电泳后,用Axygen胶回收试剂盒回收目的片段。
电泳检测后送到上海生工生物公司进行核酸序列测定。将菌株序列输入NCBI中进行比对,找出其与QK蛋白的氨基酸序列不同的位点。
1.2.6 枯草杆菌蛋白酶QK粗提液的制备 参考文献[9]的方法。挑选LB固体培养基上的单菌落接入液体种子培养基中(装液量为2 mL·20 mL-1),37 ℃、200 r/min恒温摇培18 h。以3%接种量接种至液体发酵培养基(装液量为20 mL·250 mL-1),37 ℃、200 r/min恒温培养38 h。发酵液混合均匀即为枯草杆菌蛋白酶QK粗提液。
1.2.7 枯草杆菌蛋白酶活性测定 本实验应用纤维蛋白平板法[11-12]测定酶活性,这也是目前国家卫生部测定尿激酶等溶栓酶活力的标准方法。以凝血酶和纤维蛋白原作用后制成人工血栓平板,以尿激酶为标准品,得出酶活力(IU/mL)与透明圈面积S(cm2)的关系。
尿激酶标曲的制作:尿激酶的Tris-HCl(pH=8.8)溶液浓度分别为:620、310、155、77.5、38.75、19.375 IU/mL。用垂直直径的乘积的常用对数(lgS)为横坐标,标准尿激酶浓度的常用对数(lgIU)为纵坐标,制作尿激酶酶活的标准曲线,根据尿激酶溶栓活性标准曲线求出样品的酶活力大小。
1.2.8 枯草杆菌蛋白酶QK粗提液蛋白含量测定 本实验利用Biosharp公司的BCA蛋白浓度测定试剂盒测定蛋白含量,配制梯度浓度的牛血清白蛋白(BSA)溶液:0、25、125、250、500、750、1000、1500、2000 μg/mL,利用多功能酶标仪测定各浓度的BSA溶液在562 nm处的吸光值,绘制关于蛋白浓度和吸光值的标准曲线,即可根据测定的吸光值求出蛋白的浓度。
1.2.9 单位酶活力的计算 得到蛋白浓度之后,结合所测得的酶活力大小,后者与前者的比值即为单位蛋白酶活力(IU/mg),以此来表示最终酶活力大小。计算公式表示为:

1.3 数据处理
实验中每个处理重复3次,采用SPSS 19.0软件进行数据的显著性分析,用GraphPad prism5软件作图。
2 结果与分析
2.1 枯草芽孢杆菌的菌种鉴定
2.1.1 菌株的菌落形态 在LB固体平板培养后观察15株芽孢杆菌的单菌落形态,从形状、颜色、含水状态等8个不同的方面进行描述,结果见表2。
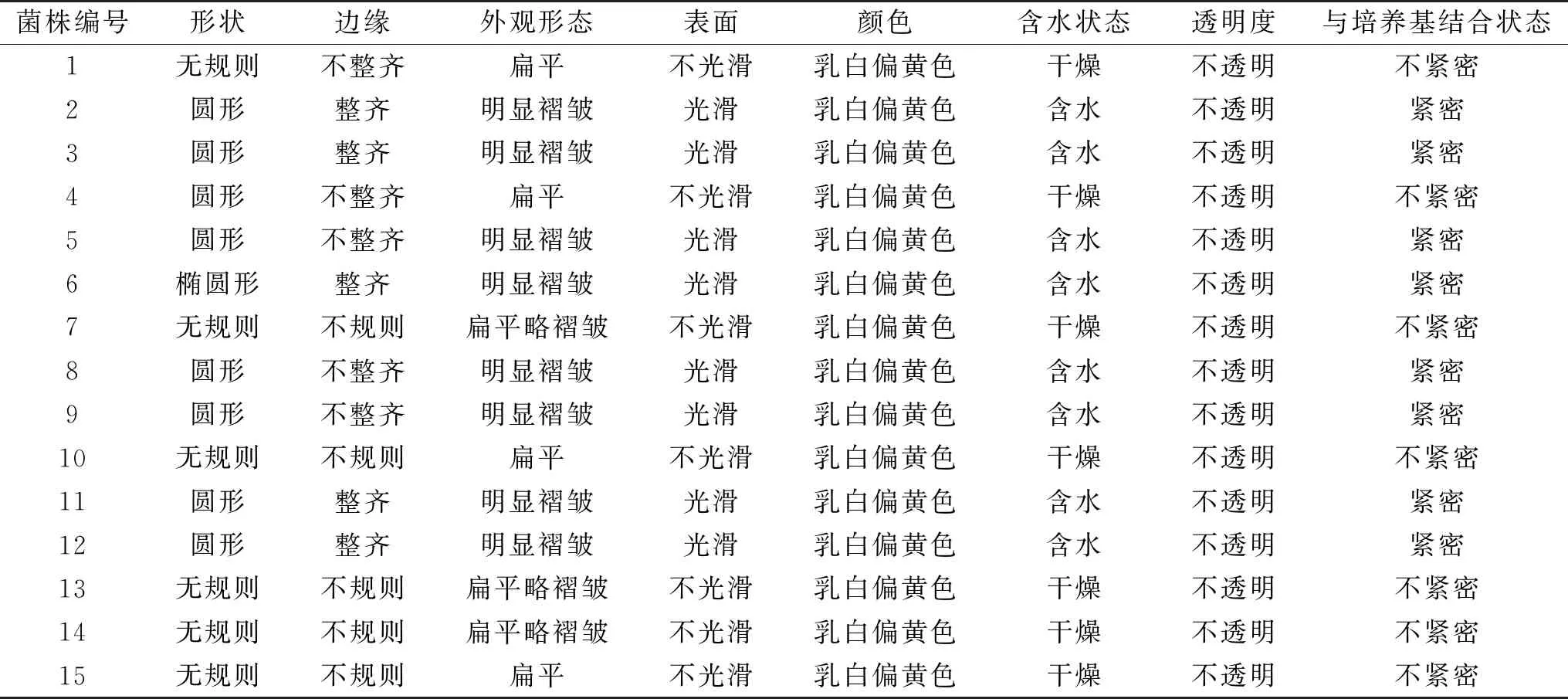
表2 枯草芽孢杆菌菌落形态Table 2 Colony morphology of Bacillus subtilis
从菌落形态来看,15株菌株都是乳白偏黄色,不透明。不同菌株之间菌落形态的其他6个方面有一定差异,这与其他学者研究报道的枯草芽孢杆菌形态多样性的结论一致[10]。但根据菌落形态难以将其分类。
2.1.2 枯草芽孢杆菌16S rRNA和QK基因序列分析 16S rRNA序列经PCR扩增后的片段长度都在1.5 kbp左右,QK基因序列经PCR扩增后的片段长度都在1149 bp左右,如图1。
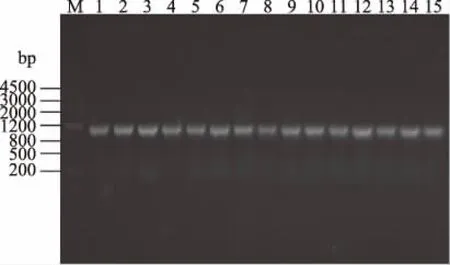
图1 PCR扩增QK基因Fig.1 Amplification of QK gene by PCR注:M:DL2000 DNA Marker; 1~15:15个菌株QK基因PCR产物。
15株菌株的16S rRNA经PCR扩增后送测序,将序列输入NCBI中进行同源搜索,所有15株的16S rRNA序列都与枯草芽孢杆菌具有超过99%的同源性。
2.1.3 枯草芽孢杆菌的QK蛋白序列分析 将15株菌株的QK基因序列输入NCBI中,与QK基因所对应的蛋白序列(GeneBank编号:CAE18180.2)进行比对(tBLASTx),氨基酸突变位点如表3所示。
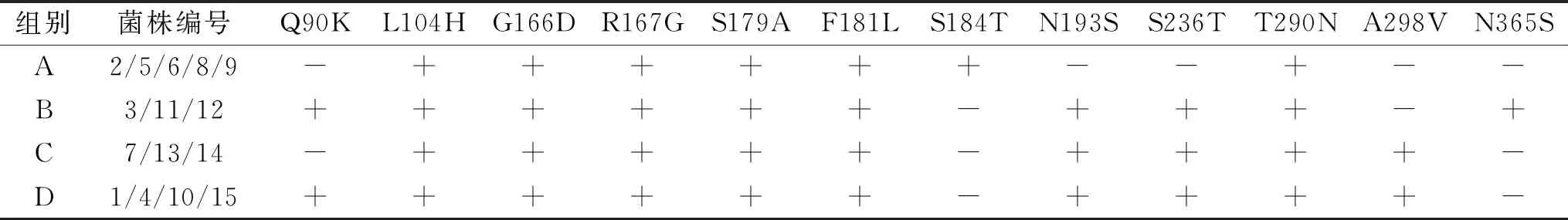
表3 15株菌株的氨基酸突变位点Table 3 Amino acid mutation sites of 15 strains
对比后发现,15株菌株均有的突变位点有6个:L104H,G166D,R167G,S179A,F181L和T290N。其余突变根据氨基酸位点的不同可以分为四类,以下把它们依次分为A、B、C、D四组。A组有5个菌株,分别是2、5、6、8、9号,特有的突变位点为S184T;B组有3个菌株,分别是3、11、12号,特有的突变位点为Q90K,N193S,S236T,N365S;C组有3个菌株,分别是7、13、14号,特有的突变位点为N193S,S236T,A289V;D组有4个菌株,分别是1、4、10、15号,特有的突变位点为Q90K,N193S,S236T,A289V。
2.1.4 枯草杆菌蛋白酶QK粗提液的酶活大小测定 尿激酶标准曲线做出后,可根据方程得出各菌株的酶活大小。具体数据见表4。由表4可知,6号菌株的酶活最高,达到了347.610 IU/mL,且A组的5株菌株的酶活显著(p<0.05)大于其他三组的10株菌株。4号菌株的酶活最低,仅2.719 IU/mL,且D组的4株菌株的酶活都比较低,但是B、C、D三组的10株菌株之间的酶活无显著差异。而A组特有的突变位点为S184T,D组特有的突变位点为A289V,由此结果可初步判断S184T这一位点的突变能提高单位酶活,而A289V这一突变能降低单位酶活。
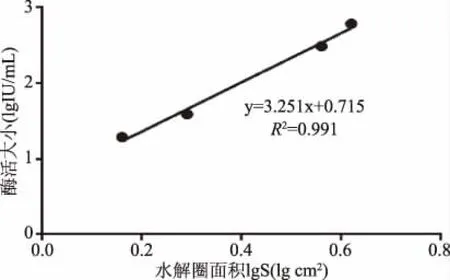
图2 尿激酶酶活标准曲线Fig.2 The standard curve of urokinase activity
2.1.5 枯草杆菌蛋白酶QK粗提液的蛋白浓度测定 根据实验结果所作标准曲线如图3所示。根据回归方程:y=0.368x+0.084,计算出15株菌株的蛋白浓度,结果见表4。D组的1号菌株蛋白浓度是18.410 mg/mL,显著低于其余的14株菌株。B组的3号菌株蛋白浓度最高,为35.235 mg/mL,但是除了与1号、8号的27.251 mg/mL有显著差异外,与其他菌株均无显著差异。蛋白浓度在组间的差异并不明显。
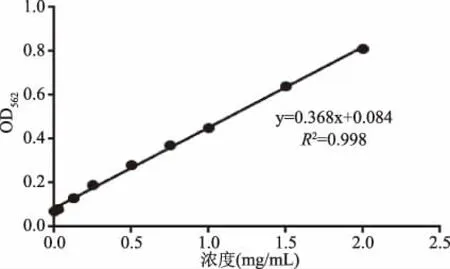
图3 牛血清白蛋白浓度标准曲线Fig.3 The standard curve of bovine serum albumin
2.1.6 枯草杆菌蛋白酶QK粗提液单位酶活的比较 单位酶活是以酶活与蛋白浓度的比值来定义的。用SPSS 19.0软件分析各菌株单位酶活数值,结果见表4。组间单位酶活比较结果见图4。
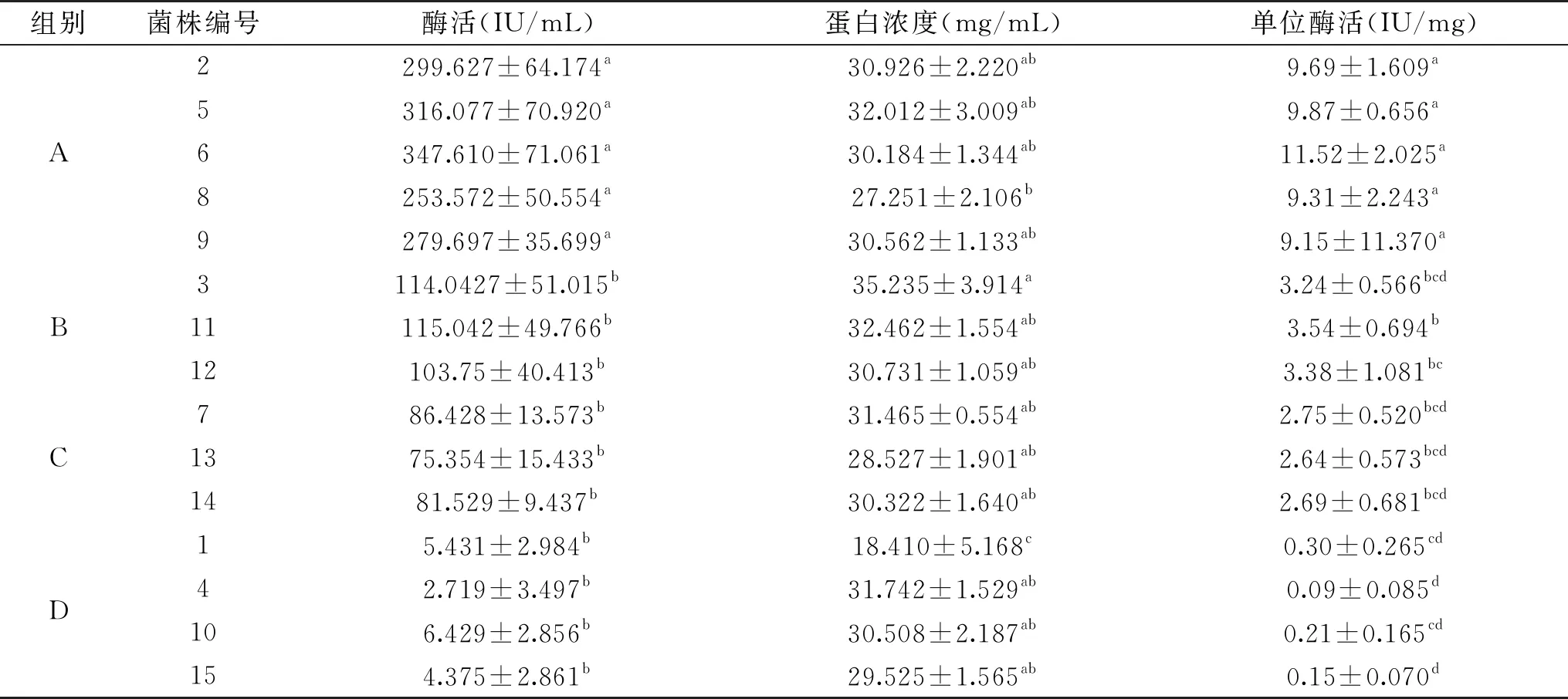
表4 15株菌株的酶活、蛋白浓度及单位酶活Table 4 Enzyme activity,protein concentration and unit enzyme activity of 15 strains
从15株菌株之间来看,单位酶活的大小差异较大,最低的是4号,仅有0.09 IU/mg,最高的是6号,达到了11.52 IU/mg。除此之外,还可以看出单位酶活的大小与组别联系密切:同一组之间的各菌株差别不大,不同组之间的差异明显。因此,对单位酶活进行了组间比较,得到图4所示的柱状图。
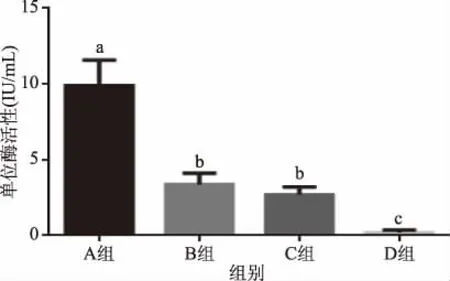
图4 各组单位酶活大小比较Fig.4 Comparison of enzyme activity in each group注:组间单位酶活比较采用One-Way ANOVA检验。 柱状图上不同字母表示有显著差异(p<0.05)。
A组的单位酶活最高,B、C组无显著(p>0.05)差异,D组最低。结合测定单位酶活的实验结果可以看出,单位酶活大小与突变位点的关系非常密切。其中,A组与其他组相比,QK蛋白氨基酸的S184T这一位点变化,可能对单位酶活性有促进作用。D组与C组相比,说明A289V这一位点的变化可能对单位酶活性有抑制作用。B组与C组相比,说明N365S的突变对单位酶活性的提升有积极作用。进而猜想184、289等位点可能位于枯草杆菌蛋白酶QK的活性中心。
3 结论
本实验对15株枯草芽孢杆菌的QK基因进行测序,测序结果与GenBank上已提交的QK基因所对应的蛋白序列(GeneBank编号:CAE18180.2)进行比对,根据突变位点的不同将这些菌株分为4组,除去15个菌株均有的6个突变位点:L104H,G166D,R167G,S179A,F181L和T290N。其余各突变如下:A组的突变位点为S184T,B组的突变位点为Q90K,N193S,S236T,N365S,C组的突变位点为N193S,S236T,A289V,D组的突变位点为Q90K,N193S,S236T,A289V。A组的单位酶活显著最高,B组和C组无显著差异但均显著低于A组,D组的单位酶活比其他三组显著最低(p<0.05)。据此,推测,S184T这一突变对于单位酶活有较大的提高作用,N365S这一突变对于单位酶活稍有提高作用,A289V这一突变对单位酶活有较明显的抑制作用。在以后的研究中,将会把来自15株菌株的QK基因克隆入载体,在毕赤酵母中表达蛋白,将蛋白纯化后进行比较,力求从根本上弄清楚上述位点是否位于枯草杆菌蛋白酶的活性中心。这对于提高QK蛋白在工业生产中的单位酶活性,提高工业生产的效率,有着非常重要的作用。

