富硒长双歧杆菌DD98菌株的黏附特性及黏附机制初步研究
周 艳,祁 艳,纪 瑞,谭 俊,*,陈代杰,3,*
(1.中国医药工业研究总院,上海 200040; 2.复旦大学,上海 200120; 3.上海交通大学,上海 200240)
双歧杆菌是存在于人体肠道内的具有重要益生功能的厌氧微生物,具有调节肠道微生物群、抵抗病原微生物及提高机体免疫力等功能[1-2]。有研究表明[3],双歧杆菌能够通过自身的生物转化吸收利用培养基中的元素,同时改变自身的生理生化特性。据此,研究人员可以采用特定的培养条件,使益生菌特定地富集某种元素,有目的地改进其生理特性,从而丰富并优化其益生功能[4]。硒元素是人体所必需的微量元素,具有抗氧化、抗肿瘤、增强机体免疫力等多种生物学活性,对人体的健康有诸多益处[5]。在高硒环境中发酵培养益生菌,使其将无机硒吸收转化为自身硒蛋白,即可制备有机硒和益生菌双重功效的富硒益生菌[6]。
双歧杆菌能否对机体产生益生作用与其能否在消化道内黏附、定植有关,其中黏附是其发挥作用的先决条件[7-8]。双歧杆菌对肠道上皮细胞的黏附能力、对胃酸胆盐的耐受力均会影响其在肠道的定植,因此分离培养得到具备肠道定植能力的双歧杆菌具有非常重要的应用价值和现实意义。体内研究益生菌对人肠道上皮细胞黏附性较为困难,体外研究益生菌黏附能力常用模型为人结肠癌细胞系的Caco-2细胞株,该细胞株在体外培养后能够较好地模拟人体肠上皮细胞的成熟形态[9]。同时研究表明[10-11],菌体表面疏水性、自聚集能力与细菌黏附性存在一定的相关性,细菌黏附能力与细菌表面性质有直接关系。表面疏水性(Cell surface hydrophobicity,CSH)常作为评价细菌黏附性的指标[12],用于表明细菌表面具有非极性成分,使菌体在极性较高的水中表现出非稳态,并引起非稳态体系中的热能和分子的重新排列[13]。自动聚集能力是指在培养菌体过程中,菌体快速大量繁殖从而自行聚集成团的现象[14]。菌体的自动聚集能力有助于其生物膜形成,从而能够在肠道内提前占位,抑制致病菌对人体肠道的侵袭[15]。
目前,有关双歧杆菌一类益生菌的黏附特性研究较多。Del等[16]研究双歧杆菌的黏附能力时,发现不同种类长双歧杆菌间黏附能力存在差异性。研究初步证明,细胞壁蛋白Tuf参与了B.LongumNCC2705黏附于Caco-2细胞的过程中,且Tuf蛋白能够明显抑制竞争性菌体黏附于Caco-2细胞,为黏附相关蛋白[17]。但关于富硒培养对益生菌黏附性质的影响研究尚未报道。本研究旨在探讨一株新的长双歧杆菌菌株DD98在富硒前后的黏附特性变化,并根据相关黏附蛋白Tuf转录表达情况,对富硒培养前后菌体黏附能力变化的机制进行初步探索,为研究和开发益生活性更优的新型富硒益生菌产品奠定基础。
1 材料与方法
1.1 材料与仪器
长双歧杆菌DD98菌株(CGMCC No. 16573) 本实验室经高通量筛选得到耐硒长双歧杆菌菌株[18],经16S rRNA测序及核苷酸序列BLAST分析,结果表明DD98菌株是一种新的长双歧杆菌;人结肠腺癌细胞系Caco-2株 上海来益生物药物研究开发中心有限责任公司惠赠;高糖型DMEM培养基、优级胎牛血清 Gibco;青链霉素(双抗) Thermo Scientific;胰蛋白酶、台盼蓝、二甲基亚砜(Dimethyl sulfoxide,DMSO) 上海合谷生物科技有限公司;亚硒酸钠 山东西亚化学工业有限公司;海藻糖 日本林源;脱脂奶粉 新西兰恒天然公司;二甲苯、硝酸钾、乙醇、尿素、SDS等 国药试剂。
400M厌氧培养箱 RUSKINN;SPX-150B-Z二氧化碳培养箱 松下电器产业;HITACHI S-4800型扫描电镜 株式会社日立制作所;SP-756P紫外分光光度计、Multiskan Go酶标仪 赛默飞世尔科技公司;XSP-2CA倒置显微镜 上海缔纶光学仪器有限公司;TL-18M冷冻离心机 上海市离心机械研究所;T100荧光定量PCR仪器 伯乐Bio-Rad公司。
1.2 实验方法
1.2.1 样品及培养基制备 RCM培养基:蛋白胨10.0 g、牛肉粉10.0 g、酵母粉3.0 g、葡萄糖5.0 g,可溶性淀粉1.0 g、氯化钠5.0 g、醋酸钠3.0 g、L-半胱氨酸盐酸盐0.5 g、琼脂0.5 g、蒸馏水1000 mL,pH6.7~6.9,121 ℃灭菌15 min。
DD98的培养:将长双歧杆菌DD98接种于RCM培养基中,厌氧培养24 h,收集菌体。
Se-DD98的培养:将长双歧杆菌DD98接种于RCM培养基中,厌氧培养12 h后,向培养基中添加亚硒酸钠,继续培养至24 h,在高硒环境下发酵制备Se-DD98。
将DD98及Se-DD98分别与冻干保护剂(海藻糖2%、脱脂奶粉10%,水70%)1∶1混合后,冷冻干燥48 h后得到冻干菌粉,密封保存于4 ℃,实验前采用平板涂布法检测样品活菌数。
1.2.2 细胞培养 液氮罐中取出Caco-2细胞,将冻存管迅速置于37 ℃水浴中复苏细胞,离心(1000 r/min,3 min)收集细胞后,加入4 mL含10%胎牛血清、1%双抗的DMEM高糖培养基,在37 ℃、5% CO2二氧化碳培养箱中培养,隔天换液。当细胞在培养瓶底长满至80%时,需要进行传代[19]。
用于黏附试验的细胞培养于细胞6孔培养板中,接种量为105个,待单层细胞汇合之后,继续培养10~15 d,即可用于黏附试验。进行黏附实验前24 h,需要提前更换为无双抗DMEM培养基(含有血清,不含抗生素)。
1.2.3 扫描电镜观察菌株黏附情况 采用无双抗的DMEM培养基将DD98及Se-DD98冻干菌粉浓度调整至108CFU/mL[15],然后加入到培养在6孔板中的已分化的Caco-2细胞层中,于37 ℃、5% CO2、95%空气的细胞培养箱中共同培养2 h。无菌PBS(pH7.4)洗涤5次,以除去未黏附的细菌后,取出6孔培养板中黏附细胞的盖玻片,加入2.5%的戊二醛固定过夜;采用PBS缓冲液漂洗样品3次,每次10 min;锇酸固定样品30 min后,以PBS缓冲液漂洗3次;样品于30%、50%、70%、90%、100% 梯度乙醇中脱水,每次15 min,样品经由无水乙醇/醋酸异戊酯(1∶1)的混合液过渡后,转入纯醋酸异戊酯,每次约10 min以置换酒精,样品置于预冷干燥室进行CO2临界点干燥(约4 h),喷金后采用扫描电镜观察[20]。
1.2.4 菌株黏附能力的测定 细胞、细菌培养及处理同1.2.3。无菌PBS(pH7.4)洗涤5次以除去未黏附的细菌后,加入胰酶250 μL,37 ℃孵育10 min,释放细胞上已黏附的细菌,然后向培养板每个孔中添加250 μL含无双抗DMEM的培养基以终止胰酶活力,用1 mL移液器将Caco-2细胞层吹打下来。黏附细菌经无菌生理盐水10倍梯度稀释后,涂布于RCM固体培养基平板上进行平板菌落计数,菌株的黏附能力以每100个Caco-2细胞黏附的细菌数量(CFU/100 cells)表示[21],进行3次独立的实验,计数样品均在37 ℃条件下厌氧培养。
1.2.5 菌体自聚合能力的测定 参考Collado等[22]、Tuo等[23]研究方法,将DD98及Se-DD98的细菌培养物,在室温下离心(6000 r/min,10 min),弃上清,收集菌体。菌体用灭菌的PBS(pH7.2)溶液洗涤两次,并重悬于PBS 溶液中,使其在600 nm下的吸光度达到0.5±0.02(记为A0)。将细胞悬液涡旋振荡15 s,于37 ℃分别静置30、60、90、120、150、180 min。吸取1 mL静置后的上清,测定其在600 nm的吸光度(At)。按公式(1)计算自聚合能力,重复三次实验取平均值。
自聚合能力(%)=(1-At/A0)×100
式(1)
式中:A0:菌体悬液的初始吸光度;At:静置不同时间后上清的吸光度。
1.2.6 菌体表面疏水性的测定 参考Rong等[24]研究方法,将DD98及Se-DD98菌液,在室温下离心(6000 r/min,10 min),倒去上清,收集菌体,菌体经PBS清洗2次后,再重悬于灭菌的0.1 mol/L KNO3溶液中。在600 nm处调节吸光度为0.5±0.02,记作A0。取3 mL菌悬液与1 mL二甲苯混匀后在室温静置10 min(此时形成两相体系)。将两相体系涡旋振荡2 min后再静置20 min,重新形成两相体系(水相和有机相)。小心吸取水相,在600 nm下测定吸光度(A)。按公式(2)计算细菌表面疏水性,重复三次实验取平均值。
表面疏水性(%)=(1-A/A0)×100
式(2)
式中:A0:菌体悬液的吸光度;A:两相混合后水相的吸光度。
1.2.7 Tuf蛋白转录水平表达情况的测定 收集与Caco-2细胞共孵育0、2 h的DD98及Se-DD98菌液混合物,使用RNA抽提试剂盒提取样品RNA,并进一步将其逆转录为cDNA。将所得cDNA稀释后与引物、SYBRGreen qPCRMix反应液混合,在Bio-Rad T100荧光定量PCR仪器进行反应,PCR反应条件为:95 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s共40个循环,每个样品做3个复孔,每个样品重复3次实验。16S rRNA作为内参基因,引物序列[25]见表1。

表1 荧光定量RT-PCR实验引物Table 1 Fluorescent quantitative RT-PCR experiment primers
1.3 数据处理

2 结果与分析
2.1 Se-DD98及DD98对Caco-2细胞的黏附现象观察结果
Se-DD98及DD98黏附于Caco-2单层细胞膜后,扫描电镜观察结果见图1。由图1可知,两种长双歧杆菌菌体形态完整,边缘清晰,均附着冻干保护剂颗粒,部分菌体出现冻干后的皱缩,电镜观察结果表明,富硒长双歧杆菌及长双歧杆菌均能够黏附于Caco-2单层细胞膜上。
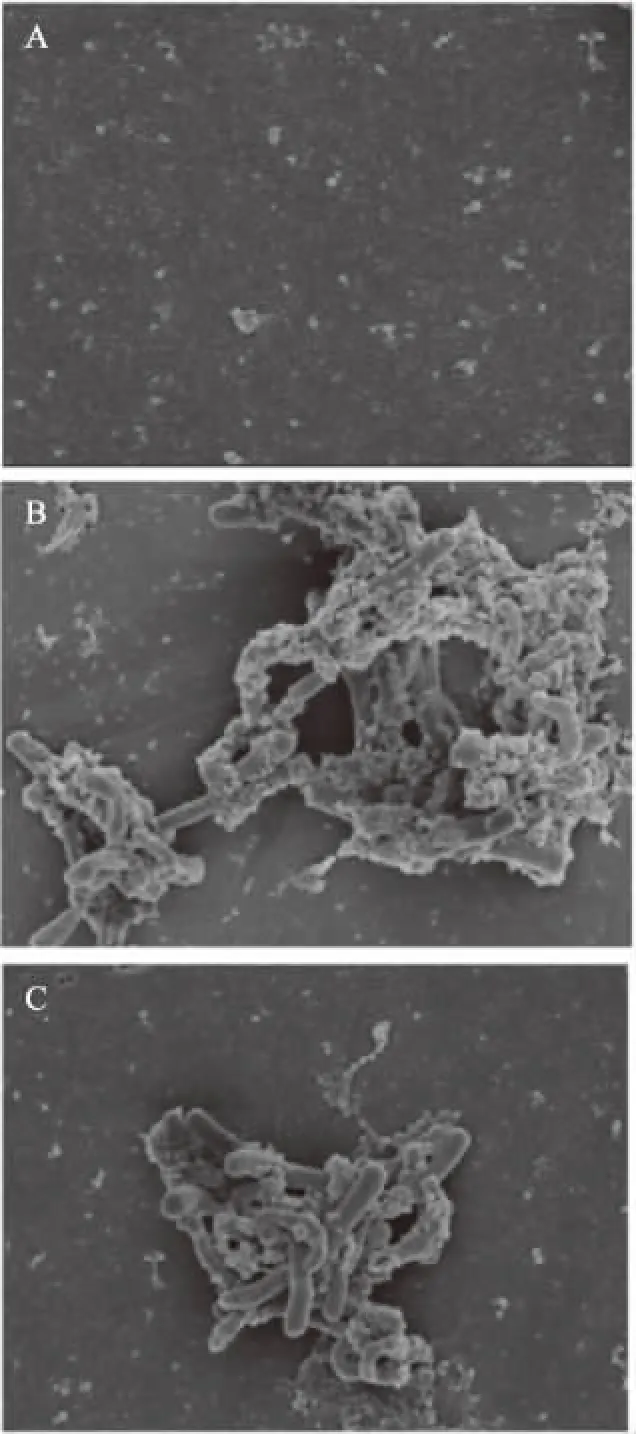
图1 扫描电镜下Se-DD98及DD98对Caco-2细胞的黏附情况(×103)Fig.1 Adhesion of Se-DD98 and DD98 strains to Caco-2 cells under scanning electron microscope(×103)注:A:单纯Caco-2细胞膜;B:Se-DD98黏附于 Caco-2细胞膜;C:DD98黏附于Caco-2细胞膜。
2.2 Se-DD98及DD98对Caco-2细胞的黏附能力
以Caco-2细胞为体外模型,采用平板计数法,分析Se-DD98、DD98对Caco-2细胞的黏附能力,结果见图2。由图2可知,相比DD98,Se-DD98能够黏附更多菌体在Caco-2细胞上,每100个Caco-2细胞平均黏附的DD98菌体为(39.12±17.57) CFU,每100个Caco-2细胞平均黏附Se-DD98菌体为(581.17±62.79) CFU。结果表明,长双歧杆菌DD98菌株经富硒培养后,对Caco-2细胞膜的黏附能力极显著提高(p<0.01)。

图2 Se-DD98及DD98对Caco-2细胞黏附能力Fig.2 Adhesion ability to Caco-2 cell of Se-DD98 and DD98 strains注:与DD98组相比,**表示差异极显著,p<0.01, *表示差异显著,p<0.05;图4~图5同。
2.3 自动聚集能力的测定
Se-DD98及DD98菌株自动聚集能力测定结果见图3。由图3可知,随着时间的推移,两组细菌悬浮液上层细胞均逐渐沉降,到180 min后,细菌悬浮液上层浑浊度明显下降,自聚合能力明显提高。相比DD98,Se-DD98的自动聚集能力略有上升,但无显著差别。

图3 Se-DD98及DD98在不同时间点自动聚集能力Fig.3 Auto-aggregation ability of Se-DD98 and DD98 strains
2.4 表面疏水性的测定
研究认为,细菌表面疏水性是由其表面蛋白、糖类及其他化合物所共同形成的一种菌体表面特性[22]。Se-DD98与DD98在碳氢化合物二甲苯中的表面疏水性如图4所示。由图4可知,相比DD98,Se-DD98在碳氢化合物二甲苯中表现出较高的表面疏水性,其结果平均为20.25%±2.14%,DD98的表面疏水性平均仅为5.12%±0.16%,两者有极显著性差异(p<0.01)。结果表明,长双歧杆菌在高硒压力下培养后,菌体表面性质发生改变,菌株表面疏水性增加。研究发现,菌体表面疏水性与其黏附能力呈正相关[16],据此可推测DD98菌株富硒培养后,其黏附能力增加,更易黏附并定植于机体肠道内壁。

图4 Se-DD98及DD98的表面疏水性Fig.4 Cell surface hydrophobicity of Se-DD98 and DD98 strains
2.5 细菌表面Tuf蛋白mRNA表达情况
细菌表面Tuf蛋白是已经报道过的兼职蛋白,具有翻译因子、宿主蛋白Plg受体双重功能[23]。研究证实,Tuf蛋白可以直接与人纤溶酶原(Plg)相互作用,是Plg的受体,在长双歧杆菌黏附于肠上皮细胞的过程中产生重要影响[24]。本实验设计引物,以转录相对保守16S rRNA作为内参,通过荧光定量RT-PCR法,检测Se-DD98及DD98与Caco-2细胞共孵育0、2 h,细菌表面Tuf蛋白mRNA的表达量,结果以2-ΔΔCt值表示,其Tuf蛋白mRNA表达情况如图5所示。由图5可知,与Caco-2细胞共孵育前,Se-DD98与DD98菌体Tuf蛋白mRNA表达量无明显差异。与Caco-2细胞共孵育2 h后,DD98及Se-DD98Tuf蛋白mRNA表达量相比与细胞孵育前均上调,且相比DD98,Se-DD98的Tuf蛋白mRNA表达量显著上调更多(p<0.05)。推测长双歧杆菌DD98菌株富硒培养后具有更高的黏附能力与细菌表面Tuf蛋白mRNA的表达有关。

图5 Se-DD98及DD98与Caco-2细胞共孵育 2 h后其Tuf蛋白mRNA表达情况Fig.5 The Tuf protein mRNA transcription result of Se-DD98 and DD98 after co-incubation with Caco-2 cells for 2 h
3 结论
菌体黏附能力是双歧杆菌在肠道中定植的先决条件,也是其发挥益生功能的基础。本研究以DD98为对象,在以Caco-2为模型、研究其富硒前后黏附能力变化的实验中发现,Se-DD98的黏附能力明显升高。在菌体表面性质的研究中,发现Se-DD98菌体表面疏水性极显著升高(p<0.01),表明富硒培养能够改变DD98的表面特性,使其黏附能力增强,推测富硒培养使双歧杆菌表面黏附相关蛋白发生改变,从而引起菌体黏附能力升高。本通过荧光定量RT-PCR法,分析与Caco-2细胞共孵育0、2 h的Se-DD98及DD98的Tuf蛋白mRNA转录情况,发现相比DD98,Se-DD98的Tuf黏附蛋白mRNA表达量显著上调更多(p<0.05),推测Se-DD98具有更高的黏附能力与Tuf黏附蛋白的转录能力有关,具体机制还需更进一步的研究。

