不同抗性烟草种质对CMV侵染的细胞响应差异分析
文柳璎 程亚增 郑业强 程立锐 刘旦 蒋彩虹 张映杰 杨爱国
摘 要:为解析烟草对CMV的抗病细胞学机制,以抗病品种台烟8号和感病品种NC82为材料,利用透射电子显微镜对比两品种在接种CMV后发病过程中的细胞超微结构变化。结果表明:(1)接种CMV后,台烟8号发病症状多为花叶,NC82发病症状多泡斑和深绿、褪绿区域相间;(2)对比NC82轻微花叶和泡斑的超微结构发现,二者叶绿体类囊体片层都减少,但泡斑症状细胞内线粒体嵴和CMV颗粒密度都高于轻微花叶症状细胞,说明泡斑的细胞病变程度重于花叶症状;对比NC82和台烟8号的深绿和褪绿区域细胞超微结构发现,深绿区域的叶绿体形态较完整,而褪绿区域的叶绿体严重变形、类囊体片层紊乱、淀粉粒畸形或消失,说明褪绿区域叶肉细胞病变程度重于深绿区域;(3)对比所有病变叶片中过氧化物酶、自噬小体及内膜系统结构发现,台烟8号在CMV侵染后,其三者形态结构都比NC82的更规则有序。研究结果为进一步探究抗CMV烟草品种的抗性分子机制提供理论依据。
关键词:黄瓜花叶病;透射电子显微镜;超微结构;自噬
中图分类号:S435.72 文章编号:1007-5119(2019)03-0067-08 DOI:10.13496/j.issn.1007-5119.2019.03.010
: In order to reveal the cytological mechanism of tobacco resistance to CMV, we compared the ultrastructure of the leaves between resistant variety Taiyan 8 (T.T.8) and susceptible variety NC82 after CMV inoculation by transmission electronic microscopy (TEM). The results showed that (1) After CMV infection, the disease symptoms of T.T.8 were mild mosaic, while that of NC82 often were bubble spot, light green island (LGI) and dark green island (DGI). (2) Comparing the ultrastructure of mild mosaic and bubble spot in NC82, thylakoid lamellae of both symptoms were reduced, but the density of mitochondrial cristae and CMV coat particles in bubble spot cell was higher than that in slight mosaic. This indicated that the damage degree of cell structure of bubble spot was more severe than mild mosaic. Comparing the ultrastructure of LGI and DGI in NC82 and T.T.8, the structure of chloroplasts in DGI was integrated, while chloroplasts in LGI were seriously deformed, thylakoid lamellae was disordered, starch granules were abnormal or disappeared. It inferred that the degree of cell structure lesion in LGI was more serious than that in DGI. (3) Comparing to all pathological leaves, the morphology of autophagy structure, peroxisome and endomembrane system in T.T.8 were more orderly than NC82. The results from this study provide theoretical basis for further study on molecular resistance mechanisms of T.T.8.
cucumber mosaic virus; transmission electronic microscopy (TEM); ultrastructure; autophagy
![]()
黃瓜花叶病毒(Cucumber mosaic virus, CMV)病是危害烟草的主要病毒病之一,在烟草整个生育期都可以导致植株发病,严重影响烟叶的产质量及经济效益。通过解析烟草与CMV的互作机制,可为挖掘抗病基因、培育抗病品种提供理论依据,从而进一步推动抗CMV烟草品种的选育。
烟草受CMV侵染后发病初期表现为明脉,随后发展成花叶、斑驳或泡斑,发病后期形成明显的深绿和褪绿区域。通过细胞超微结构观察,CMV侵染会导致叶绿体结构肿胀、外膜破裂、内部片层松散,直至整个叶绿体解体。而对于不同发病症状的叶肉细胞,其细胞超微结构有所不同,发病叶片的深绿区域细胞中叶绿体形态相对正常,类囊体数量较多且基粒堆叠紧密;而褪绿区域叶绿体中类囊体较少,基粒不完整且形态异常。CMV侵染还会引起烟草其他细胞器的变化,如CMV侵染后诱导内质网应激,细胞器降解。
CMV病毒有多个亚组,不同亚组的致病力差异较大,引起烟草表型也不同,亚组II侵染后烟株发病较轻,亚组I能引起严重的褪绿、矮化甚至坏死症状,CMV(Y)的突变株侵染黏烟草后能够引起接种部位局部坏死。而植物细胞抵御CMV不同病毒亚组,其互作机制也有所差异,如活性氧迸发,细胞自噬等。本研究针对我国绝大部分烟区的CMV主流病毒IB亚组,利用透射电子显微镜(TEM)观察CMV侵染不同抗性烟草品种的叶片超微结构变化,分析引起其细胞结构改变的原因,为揭示CMV与烟草互作机制提供细胞学证据,同时为有针对性培育抗CMV烟草品种提供理论依据。
1 材料与方法
1.1 试验材料
供试烟草材料为CMV抗病品种台烟8号,感病品种NC82。CMV病毒为目前我国云南、贵州、湖南等烟叶主产区的主流病毒IB亚组。烟草种子和CMV病毒均由中国农业科学院烟草研究所烟草遗传育种研究中心保存。
1.2 材料种植及病毒接种
烟草材料按照托盘育苗法育苗,每个材料播种3盘,每盘32株,于人工气候室培养,培养条件为(25±1)℃,光照16 h/d。CMV病毒采用摩擦接种法接种烟苗最上部叶,方法参考文献[12]。
1.3 病情调查
烟草幼苗接种CMV病毒后30 d进行病情调查,调查方法同文献[13]。
1.4 超薄切片制备及TEM观察
接种CMV病毒后,取两个品种接种后的发病心叶叶片,以PBS处理同时期两品种未接种病毒的健康心叶为对照。样品切成1 mm×5 mm大小,用2.5%戊二醛前固定24 h,1%锇酸后固定1.5 h。乙醇系列脱水,环氧树脂812包埋,10 ℃放置17 h,15 ℃放置20 h,60 ℃放置17 h。样品切片厚度为50~70 μm,利用柠檬酸铅和醋酸双氧铀在25 ℃下分别对样品进行20 min染色,在透射电镜下观察并拍照。
2 结 果
2.1 CMV侵染后烟草不同抗、感品种的发病情况
接种CMV 30 d后,台烟8号的病情指数为12.33(表1),表现为高抗,多数叶片发育正常,仅个别叶片出现轻微花叶,植株生长健壮,无明显矮化现象; NC82病情指数为75.78,表现为高感,发病严重,多数叶片发育畸形,叶缘卷曲,细长且褪绿,并出现黄绿相间的泡斑和深绿斑点,多数烟株矮化无法正常生长。
观察两品种接种CMV后0~20 d心叶发病情况,发现接种CMV 8 d时,NC82第一片心叶表现轻微花叶,而台烟8号无发病症状;接种CMV后13 d,台烟8号第一片心叶才出现轻微花叶。接种CMV 20 d后,NC82心叶生长受到抑制,出现皱缩和泡斑,而台烟8号仅表现轻微花叶,叶片大小无明显变化。
2.2 CMV侵染后烟草不同发病时期的细胞超微结构变化
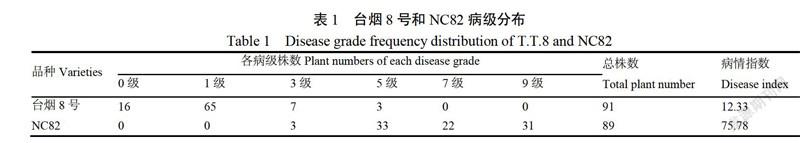
为进一步明确CMV病毒对烟草叶片细胞结构造成的损伤,分析了感病品种NC82在接种CMV后不同时期(8 d、20 d和30 d)的叶片细胞超微结构变化。结果如图1所示,经PBS处理未接种病毒的NC82(设为CK)叶片细胞结构完整,叶绿体、线粒体的内部结构清晰,过氧化物酶体形态正常(图1A,E,I)。接种病毒8 d的NC82烟株叶片出现轻微花叶症状,细胞结构异常,主要表现在:叶绿体外部围绕着囊泡且叶绿体瘦长,类囊体片层变薄,淀粉粒消失(图1B,C,H);线粒体嵴褶皱增多(图1C,K);过氧化物酶体内,物质密度不均,结晶形状不规则(图1J);细胞质中出现直径约20 nm的CMV病毒颗粒(图1L)。从而说明,在烟叶发生轻微花叶时,CMV病毒颗粒就已在细胞质中积累,病毒复制引起叶绿体类囊体片层减少,叶片光合作用减弱、呼吸作用增强,而且细胞内的活性氧水平也会发生改变。
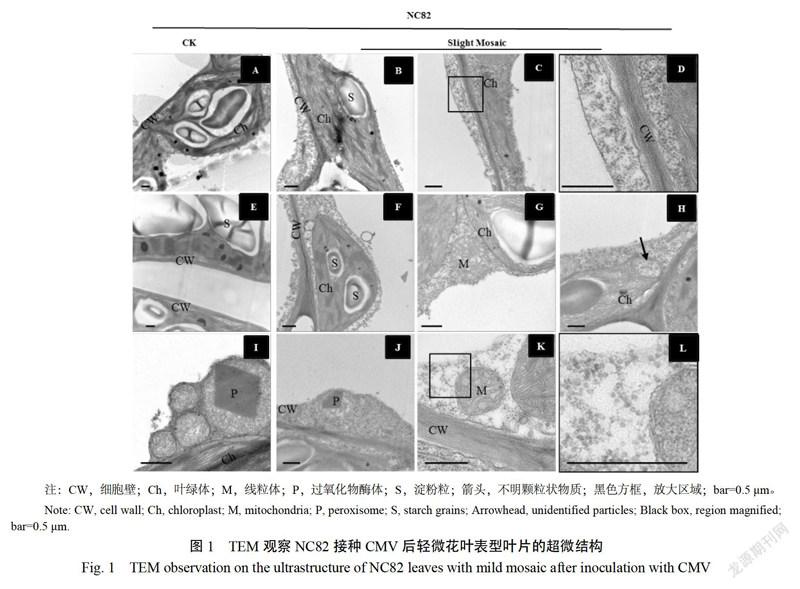
接种CMV病毒20 d的NC82叶片出现泡斑皱缩,细胞质中充满了病毒颗粒(图2C,D),叶绿体类囊体片层变薄,膜结构已经不清晰(图2A,B)。同时,该时期细胞内线粒体数目增加,体积膨大,嵴褶皱增多(图2E)。整体上,接种20 d细胞内CMV复制积累数量增加,导致叶片光合作用进一步下降,呼吸作用进一步增强,病毒对叶片的细胞结构破坏增强。
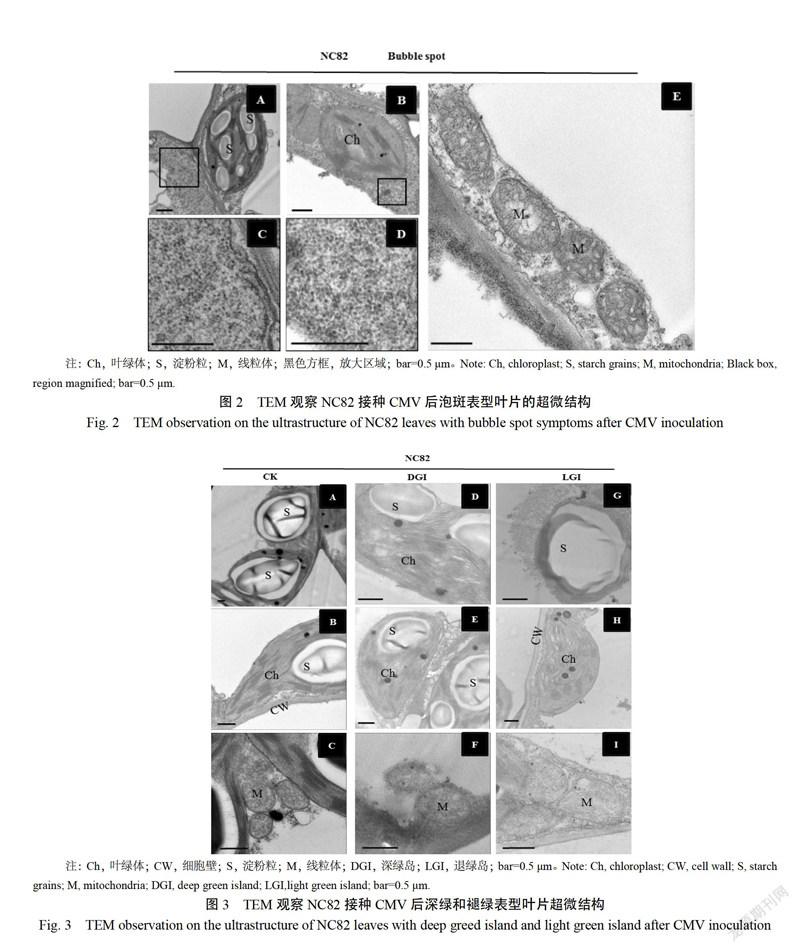
接种CMV病毒30 d时,从表型上看,NC82发病叶上出现明显的深绿和褪绿分区。对超微结构观察发现,深绿区域细胞的叶绿体与对照相似,类囊体片层轻微疏松,淀粉粒结构清晰,但线粒体外膜有明显破损(圖3A-F)。而褪绿区域的细胞中,叶绿体形状不规则,类囊体片层模糊,片层间无连接,淀粉粒畸形或消失(图3G,H)。此外,褪绿区域的细胞中,线粒体也出现畸形,其内部嵴密度明显增多(图3I)。以上表明,CMV的进一步侵染会严重破坏褪绿区域细胞的光合作用和淀粉合成功能,并且褪绿区域的叶片颜色发黄,这可能与其叶绿体结构和生理功能损失有关。
与此同时,台烟8号接种CMV病毒30 d后也偶尔出现深绿和褪绿症状。对抗、感材料中两种症状的超微结构进行对比。结果发现,无论是在发病叶片的深绿区域,还是褪绿区域,两个品种叶肉细胞叶绿体结构相似。例如在发病叶片的深绿区域,叶绿体和淀粉粒均为结构清晰,类囊体片层疏松(图4D,E);在褪绿区域,叶绿体和淀粉粒形状畸形,类囊体片层模糊(图4G,H)。但是在发病叶片的深绿区域,抗病品种台烟8号的过氧化物酶体和线粒体形态正常,并聚集在一起(图4F),而感病品种NC82中线粒体外膜破损,内含物外流。在褪绿区域细胞内,两品种线粒体都发生重塑,抗病品种台烟8号中,线粒体嵴不可见且内部中空,而感病品种NC82线粒体与之相反,内部嵴显著增多。线粒体是细胞的供能细胞器,为生化反应提供能量,台烟8号深绿区域的线粒体保持完整性,并与过氧化物酶体聚集,这可能为细胞上调表达抗性相关代谢物的合成,提供充足的能量。而病毒复制也大量消耗寄主能量,线粒体褪绿区域的细胞中发生重塑,可能与病毒复制有关。从线粒体在抗、感品种的不同表现推测,线粒体在台烟8号抗病过程中可能发挥一定作用。

2.3 CMV侵染后烟草不同抗、感品种细胞内膜系统结构变化
在对台烟8号和NC82的发病叶片超微结构进行观察时发现,两个品种在病毒侵染后内膜系统发生了不同变化。其中,NC82病变细胞中,内膜系统出现异常扩大且层叠扭曲(图5F,H);细胞液泡内部出现大小不均一的囊泡,而且部分液泡内部有颗粒状物质,推测这是由CMV病毒颗粒聚集产生(图5G);病变细胞中过氧化物酶体也发生畸形,其内部也充满大小不均一的颗粒(图5E)。由此推测,CMV可能利用NC82的内膜系统进行复制,使得细胞产生内质网应激,生理功能发生紊乱。而在抗病品种台烟8号的病变细胞中,上述现象较少,但可观察到大量形状规则,偏圆形,大小在0.3~1.0 μm左右且内含囊泡性质物质的自噬小体出现在细胞壁附近(图5A-D)。自噬小体内有降解细胞物质的功能,因此,台烟8号有可能通过自噬小体降解CMV病毒从而产生防御反应,详细过程仍需进一步研究。另外,在台烟8号深绿区域细胞中观察到过氧化物酶体出现,而过氧化物酶能够调节细胞的
活性氧代谢水平,维护细胞膜的稳定性。这或许与台烟8号对CMV表现抗病的机制有关。总之,受CMV病毒侵染后,两个品种在内膜系统结构上的差异可能与限制病毒复制有关,这也是进一步解析台烟8号对CMV抗病机制的切入点。

3 讨 论
3.1 CMV侵染烟草的细胞学研究
目前,对CMV侵染烟草的病理学研究主要是根据叶片表型和病情指数分析不同品种的抗性,缺乏从细胞学角度分析抗、感材料接种CMV病毒后的受损情况,以及细胞学结构变化差异。徐鹏飞等报道,疫霉根腐病菌对不同抗性大豆品种细胞结构的影响不同,抗病大豆下胚轴细胞结构略有变化,而感病大豆几乎无完整细胞结构。文柳璎等研究指出,TMV侵染不同抗性烟草品种72 h后,抗病和感病品种相比其叶绿体等细胞器均出现显著差异。本研究分析了CMV病毒IB亚组接种烟草叶片后心叶发病过程和发病症状,同时利用TME观察了轻微花叶、泡斑、深绿和褪绿4种发病症状的叶肉细胞超微结构。结果表明,抗病品种台烟8号总体表现症状轻于感病品种NC82,其细胞病变程度也轻于感病品种;在感病品种NC82中,泡斑症状的细胞病变程度重于花叶症状;褪绿症状的叶肉细胞病变程度重于深绿症状。而CHEN等研究指出在深绿症状细胞中,叶绿体比褪绿中的更有序,且其抗性相关的代谢物表达水平也比褪绿中的高。这说明细胞结构的变化反应出细胞生化功能的变化程度。本研究从亚细胞水平解析CMV病毒对烟叶细胞内超微结构影响,为从细胞学上解析烟草抗病机理提供理论依据。
3.2 活性氧代谢与烟草CMV抗性
活性氧迸发(ROS)是植物抵抗病原菌侵染的一种有效手段。细胞中过氧化物酶体能够清除细胞内的活性氧,减少活性氧对细胞结构损伤,因此过氧化物酶体的活性与植物的抗病性密切相关。QUEIROS等研究报道马铃薯愈伤组织在盐胁迫下,细胞整体结构会发生改变,亚细胞结构如叶绿体、线粒体、过氧化物等也发生了重塑。在本研究中发现,抗病品种台烟8号发病叶片深绿部位中,其过氧化物酶体形态保持正常,并且紧邻线粒体,而感病品种NC82发病叶片中过氧化物酶体出现畸形,由此推测两品种细胞ROS的调控系统可能存在差异。
活性氧还是调控很多代谢途径的信号因子,与抗病基因的表达水平息息相关。SUN等研究指出,烟草接种CMV、TMV后会引起h型硫氧还蛋白(NtTRXh3)特异性表达,过表达NtTRXh3可提高烟草对病毒的抗性,而沉默NtTRXh3基因则会增加烟草感病程度。此外,TADA等指出硫氧还蛋白可调节病程相关基因非表达子NPR1的构象,从而诱导病程相关基因的表达,使植株产生抗性。由于硫氧还蛋白受细胞内氧化水平调控,因此台烟8号与NC82的ROS水平差异可能影响抗病基因表达水平,这或许是台烟8号病程延缓或抗性产生的原因。
3.3 细胞内膜系统与烟草CMV抗性
细胞内膜系统是细胞功能实现的重要组成部分。CMV病毒侵染本氏烟和三生烟,会导致寄主细胞内膜系统发生紊乱,产生内质网应激,重构形成特异的细胞结构,如小泡、多泡体等。单链正义RNA病毒复制复合体与细胞内膜密不可分。雀麦草花叶病毒(BMV)的RNA复制依赖于类脂双层膜中脂肪酸的构成。酵母基因参与调节细胞膜流动性,其功能缺失突变体会严重抑制BMV的复制。本研究中,NC82内膜系统出现大量异常,液泡内部出现囊泡结构,并内含一些颗粒物质(图5G,H),推测为CMV侵染NC82的细胞后形成的特异性结构,从而为病毒复制提供环境。另一方面,动物RNA病毒侵染可使细胞产生内质网应激,引起内质网的未折叠蛋白應答,继而产生细胞自噬。植物病毒TMV-U1株系侵染亮黄烟72 h 也出现自噬现象。TMV侵染Hela肿瘤细胞后,细胞也产生自噬。本研究中台烟8号发病叶多表现为轻微花叶症状,感病细胞中出现大量自噬现象,并且靠近细胞壁出现很多小囊泡(图7A-D),这可能与细胞清除CMV病毒,限制CMV病毒复制相关,也是台烟8病程延缓、发病较轻的原因。
目前,煙草CMV抗性分子机制尚不清楚,课题组已经利用SSR,SNP等标记尝试定位台烟8号的CMV抗性主效基因,并已经获得一些候选基因。本研究从细胞学角度解析台烟8号的抗性机理,研究结果为进一步阐明CMV抗性机制提供实验证据,为精确定位抗性基因提供筛选依据。
4 结 论
通过对比台烟8号和NC82在CMV侵染后4种发病症状的叶肉细胞超微结构变化差异,发现:(1)泡斑症状细胞内的病毒复制积累水平高于轻微花叶症状,其叶绿体和线粒体病变程度重于花叶症状。褪绿区域细胞的叶绿体严重畸形,其光合作用和淀粉合成功能损失重于深绿区域。(2)发病叶中的线粒体、过氧化物酶体和细胞自噬等结构,三者在台烟8号中的形态比NC82中的形状更规则,结构更有序,这些结构差异可能与台烟8号抗病机制有关。
参考文献
代帅帅,任民,蒋彩虹,等. 烟草骨干亲本主要病毒病抗性鉴定及遗传多样性分析[J]. 中国农业科学,2015,48(6):1228-1239.
DAI S S, REN M, JIANG C H, et al. Identification of resistance to main virus diseases and genetic diversity study of tobacco foundation parents[J]. Scientia Agricultura Sinica, 2015, 48(6): 1228-1239.
范静苑,王元英,蒋彩虹,等. 烟草CMV抗性鉴定及抗性基因的SSR标记研究[J]. 分子植物育种,2009,7(2):355-359.
FAN J Y, WANG Y Y, JIANG C H, et al. Resistance identification and SSR marking of resistance gene of tobacco cucumber mosaic virus[J]. Molecular Plant Breeding, 2009, 7(2): 355-359.
胡向武,陈士超,张林普. 黄瓜花叶病毒的侵染扩散及病变细胞的电镜观察[J]. 安徽师大学报(自然科学版),1998,21(4):354-357.
HU X W,CHEN S C, ZHANG L P. Observation on the invasion and diffusion of cmv particles and pathologic changes of cells under the electron microscope[J]. Journal of Anhui Normal University, 1998, 21(4): 354-357.
CHEN L J, LIU J, ZHAO F F, et al. Characterisation of the dark green islands of cucumber mosaic virus infected Nicotianatabacum[J]. Plant Cell Report, 2015, 34(7): 1225-1238.
申莉莉. CMV诱导烟草内质网应激及调控因子NbbZIP28的研究[D]. 沈阳:沈阳农业大学,2017.
SHEN L L. Endoplasmic reticulum stress induced by CMV and research on the regulator NbbZIP28 in
Nicotiana[D]. Shenyang: Shenyang Agricultural University, 2017.
李方方,申莉莉. 植物病毒侵染诱导寄主内质网应激反应[J]. 中国烟草科学,2016,37(6):95-100.
LI F F, SHEN L L, Endoplasmic reticulum stress induced by plant viral infection[J]. Chinese Tobacco Science, 2016, 37(6): 95-100.
HAASE A, RICHTER J, RABENSTEIN F. Monoclonal antibodies for detection and serotyping of cucumber mosaic virus[J]. Journal of Phytopathology, 2010, 127(2): 129-136.
MOCHIZUKI T, OHKI S T. Single amino acid substitutions at residue 129 in the coat protein of cucumber mosaic virus affect symptom expression and thylakoid structure[J]. Archives of virology, 2011, 156: 881-886.
TAKAHASHI H, SUZUKI M, NATSUAKI K, et al. Mapping the virus and host genes involved in the resistance response in Cucumber mosaic virus-infected Arabidopsis thaliana[J]. Plant cell physiology, 2001, 42: 340-347.
金大伟. 我国主要烟区烟草黄瓜花叶病毒的鉴定及全基因组序列分析[D]. 武汉:华中农业大学,2014.
JIN D W. Identification and complete sequence analysis of cucumber mosaic virus from tobacco in the main tobacco growing areas in china[D]. Wuhan: Huazhong Agricultural University, 2014.
宋丽云. 我国烟草TMV和CMV种群结构遗传分析[D].北京:中国农业科学院,2012.
SONG L Y. Phylogeographic analysis of TMV and CMV of Tobacco in china[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012.
陈小翠,代帅帅,张兴伟,等. 烤烟CMV抗性的主基因+多基因混合遺传模型分析[J]. 植物遗传资源学报,2014,15(6):1278-1286.
CHEN X C, DAI S S, ZHANG X W, et al. Mixed major-gene plus polygenes inheritance analysis for CMV disease resistance in flue-cured tobacco[J]. Journal of Plant Genetic Resources, 2014, 15(6): 1278-1286.
程立锐,陈小翠,代帅帅,等. 烟草黄瓜花叶病毒抗性位点发掘[J]. 中国烟草科学,2018,39(4):1-6.
CHENG L R,CHEN X C, DAI S S, et al. Identification of QTL associated with resistance to cucumber mosaic virus in tobacco[J]. Chinese Tobacco Science, 2018, 39(4):1-6.
徐鹏飞,吴俊江, XUE A G, 等. 大豆疫霉根腐病菌游动孢子侵染野生大豆下胚轴的透射电镜观察[J]. 大豆科学,2012,31(3):462-465.
XU P F, WU J J, XUE A G, et al. Ultrastructure of hypocotyls of glycine soja infected with zoospores of phytophthorasojae[J]. Soybean Science, 2012. 31(3): 462-465.
文柳璎,刘旦,龚敏,等. 抗病毒病K326新品系Y48抗TMV的细胞学机制研究[J]. 中国烟草科学,2018,39(4):18-25.
WEN L Y, LIU D, GONG M, et al. Analysis of cytological mechanism of TMV resistance in novel anti-viral disease variety developed from K326[J]. Chinese Tobacco Science, 2018, 39(4): 18-25.
TRIPATHI D N, WALKER C L. The peroxisome as a cell signaling organelle [J]. Current Opinion in Cell Biology, 2016, 39: 109-112.
QUEIROS F, RODRIGUES J A, ALMEIDA J M, et al. Differential responses of the antioxidant defense system and ultrastructure in a salt-adapted potato cell line[J]. Plant Physiology and Biochemistry, 2011, 49(12): 1410-1419.
SUN L J, REN H Y, LIU R X, et al. An h-type thioredoxin functions in tobacco defense responses to two species of viruses and an abiotic oxidative stress[J]. Mol Plant-Microbe Interact, 2010, 23(11): 1470-1485.
TADA Y, SPOEL S H, PAJEROWSKA-MUKHTAR K, et al. Plant immunity requires conformational charges of NPR1 via S-nitrosylation and thioredoxins[J]. Science, 2008, 321(5891): 952-956.
SCHAAD M C, JENSEN P E, CARRINGTON J C. Formation of plant RNA virus replication complexes on membranes: role of an endoplasmic reticulum-targeted viral protein[J]. EMBO Journal, 2014, 16: 4049-4059.
MAGLIANO D, MARSHALL J A, BOWDEN D S, et al. Rubella virus replication complexes are virus-modified lysosomes[J]. Virology, 1998, 240: 57-63
LEE W M, ISHIKAWA M, AHLQUIST P. Mutation of host δ9 fatty acid desaturase inhibits brome mosaic virus RNA replication between template recognition and RNA synthesis[J]. Journal of Virology, 2001, 75(5): 2097-2106
JHENG J R, HO J Y, HORNG J T. ER stress, autophagy, and RNA viruses[J]. Frontiers in Microbiology, 2014, 5: 388.
刘伟,李方方,孙航军,等. TMV侵染烟草诱导寄主产生细胞自噬[J]. 植物病理學报,2016,46(6):759-766.
LIU W, LI F F, SUN H J, et al. Tobacco mosaic virus infection on tobacco plants induces autophagy[J]. ActaPhytopathologica Sinica, 2016, 46(6): 759-766.
LI L, WANG L, XIAO R, et al. The invasion of tobacco mosaic virus RNA induces endoplasmic reticulum stress-related autophagy in HeLa cells[J]. Bioscience Reports, 2012, 32(Pt 2): 171.
任民,程立锐,刘旦,等. 基于RAD重测序技术开发烟草品种SNP位点[J]. 中国烟草科学,2018,39(3):10-17.
REN M, CHENG L R, LIU D, et al. Development of tobacco SNPs based on RAD re-sequencing technology[J]. Chinese Tobacco Science, 2018, 39 (3): 10-17.
潘旭浩,程立锐,陈小翠,等. 基于SLAF-seq技术的烟草抗CMV主效QTL定位[J]. 中国烟草科学,2018,39(5):4-11.
PAN X H, CHENG L R,CHEN X C, et al. CMV resistance QTL analysis in tobacco based on SALF-seq technique[J]. Chinese Tobacco Science, 2018, 39(5): 4-11.

