加味生脉补心丹对2型糖尿病大鼠心肌损伤的保护作用
吴华英 夏帅帅 黄惠勇 潘继兴 李静 贺佐梅 邵峰 曾光




〔摘要〕 目的 探讨加味生脉补心丹(以下简称BXD)对自发性非肥胖2型糖尿病Goto-kakisaki (GK) 大鼠心肌损伤的保护作用。方法 8~9周龄雄性Wistar大鼠8只作为空白组,另将40只糖尿病模型GK大鼠按随机数字表将大鼠分为5组,分别为:模型组、西药组(格列齐特缓释片组)、BXD低剂量组、BXD中剂量组、BXD高剂量组。各组大鼠按治疗方法给药10周后处死,腹主动脉采血检测空腹血糖(FPG)、糖化血红蛋白(HbAlc)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA),取左心室行心肌组织HE染色、PAS染色观察病理改变,免疫组化测定心肌凋亡相关蛋白Bax、Bcl-2的表达。结果 与空白组比较,模型组FPG、HbAlc显著升高(P<0.01),SOD、GSH-Px均显著降低(P<0.01),MDA显著升高(P<0.01);HE染色可见心肌组织水肿坏死、纤维溶解断裂;PAS染色可见大量糖原物質沉积;免疫组化示心肌组织Bax表达增多、Bcl-2表达减少(P<0.01)。与模型组比较,BXD低剂量组FPG降低(P<0.05),西药组和BXD中、高剂量组FPG均显著降低(P<0.01);西药组HbAlc显著降低(P<0.01),BXD高剂量组HbAlc降低(P<0.05);西药组与BXD高剂量组SOD、GSH-Px均显著升高(P<0.01)、MDA含量均降低(P<0.05);西药组、BXD高剂量组Bax表达显著减少(P<0.01),西药组及BXD中剂量组、高剂量组Bcl-2表达显著增多(P<0.01)。结论 BXD对GK大鼠心肌损伤具有保护作用,其机制可能是通过增强抗氧化能力、抑制心肌细胞凋亡,从而起到心肌保护作用。
〔关键词〕 糖尿病心肌病;加味生脉补心丹;GK大鼠;氧化应激;细胞凋亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.005
Protective Effects of Jiawei Shengmai Buxin Dan (BXD) on Myocardial Injury in
Type 2 Diabetic Rats
WU Huaying1, XIA Shuaishuai1, HUANG Huiyong1*, PAN Jixing2, LI Jing1, HE Zuomei1, SHAO Feng1, ZENG Guang3
(1. Hunan University of Chinese Medicine, Hunan Provincial Key Laboratory of Diagnostic in Chinese Medicine, Changsha, Hunan 410208, China; 2. Changsha Traditional Chinese Medicine Hospital, Changsha, Hunan 410005, China; 3. College of Integrated Traditional Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To investigate the protective effects of Jiawei Shengmai Buxin Dan (BXD) on myocardial injury in spontaneous non-obese type 2 diabetes Goto-kakisaki (GK) rats. Methods Eight male Wistar rats aged 8-9 weeks were used as a blank group. 40 diabetic GK rats were randomly divided into 5 groups: the model group, the Western medicine group (Gliclazide Sustained-release Tablets), BXD low dose group, BXD medium dose group, BXD high dose group. The rats in each group were sacrificed 10 weeks after treatment, and abdominal aortic blood sampling was used to detect fasting blood glucose (FPG), glycosylated hemoglobin (HbAlc), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), and malondialdehyde (MDA). The left ventricle was taken for myocardial tissue HE staining. PAS staining was performed to observe pathological changes. The immunohistochemistry was used determine the expression of Bax and Bcl-2 protein related to myocardial apoptosis. Results Compared with the blank group, FPG and HbAlc were significantly increased in the model group (P<0.01); SOD and GSH-Px were significantly decreased (P<0.01), and MDA was significantly increased (P<0.01); HE staining showed edema necrosis and fibrinolysis rupture in myocardial tissue; PAS staining showed a large amount of glycogen deposition; immunohistochemistry showed increased expression of Bax and decreased expression of Bcl-2 in myocardial tissue (P<0.01). Compared with the model group, the FPG of the BXD low-dose group was decreased (P<0.05), and the FPG of the western medicine group, the BXD medium and high dose group were significantly decreased (P<0.01); HbAlc in the western medicine group was significantly decreased (P<0.01), and decreased in the BXD high dose group (P<0.05). The SOD and GSH-Px in the western medicine group and the BXD high dose group were significantly increased (P<0.01) and the MDA content was decreased (P<0.05). The expression of Bax in the western medicine group and BXD high dose group was significantly decreased (P<0.01), and the expression of Bcl-2 in the western medicine group, BXD middle dose group and high dose group increased significantly (P<0.01). Conclusion BXD has protective effects on myocardial injury in GK rats. The mechanism may enhance myocardial cell apoptosis by enhancing antioxidant capacity and inhibiting cardiomyocyte apoptosis.
〔Keywords〕 diabetic cardiomyopathy; Jiawei Shengmai Buxin Dan; GK rats; oxidative stress; apoptosis
糖尿病心肌病(diabetic cardiomyopathy, DCM)是排除了因高血压病、冠状动脉粥样硬化、心脏瓣膜病及其他心脏病导致的心肌结构与功能异常的心肌病,最终可发展为心力衰竭而死亡[1],属于糖尿病微血管并发症之一,具有症状隐匿、致病长久等特点。糖尿病心肌病发病机制复杂,涉及到多种调控途径,目前尚未阐释清楚,氧化应激被广泛认为是该疾病发病机制的主要原因之一[2],糖尿病状态下机体氧化应激增强,大量活性氧(reactive oxygen species, ROS)产生,使促凋亡基因释放,启动细胞凋亡程序,从而引起心肌细胞损伤[2-3]。“加味生脉补心丹”(以下简称BXD)是已在临床使用多年的经验方[4],在我们前期的实验研究中,发现该方能显著改善2型糖尿病心肌损伤大鼠糖脂代谢紊乱,明显减轻心肌纤维化、心肌肥大程度[5-6]。Goto-Kakisaki(GK)大鼠属自发性非肥胖型2型糖尿病大鼠,是选择糖耐量处于上限的Wistar大鼠经过近亲繁殖数代产生[7]。文献报道GK大鼠在8周龄时即可出现心肌细胞肥大等病理改变[8],且随周龄增大其心脏功能及结构也会不同程度受损[9-12],在我们的预实验中发现12周龄的GK大鼠可出现空腹血糖升高并伴有心肌组织轻度损伤等病理改变,故本研究采用更加符合人类致病特征的GK大鼠,联合高糖高脂饮食构建糖尿病心肌病模型,观察BXD对GK大鼠氧化应激相关指标及心肌凋亡相关蛋白Bax、Bcl-2的影响,探讨该方对GK大鼠心肌损伤的防治作用及其可能机制。
1 材料与方法
1.1 实验动物
8~9周龄SPF级雄性Wistar大鼠8只,8~9周龄SPF级雄性GK大鼠42只,体质量(200±20)g,适应性喂养1周。(实验动物来源:上海斯莱克实验动物有限责任公司;合格证编号:311615200002581)。Wistar大鼠予普通饲料喂养,GK大鼠予高糖高脂饲料喂养,高糖高脂饲料配方如下:基础饲料60.7%、蔗糖15%、胆固醇4%、胆盐0.3%、猪油10%、蛋黄粉10%。饲料来源:湖南斯莱克实验动物有限责任公司。
1.2 实验药品
加味生脉补心丹:人参10 g,黄芪20 g,炒柏子仁10 g,茯苓8 g,生地黄15 g,天花粉12 g,荷叶15 g,丹参15 g,水蛭6 g,檀香2 g,枳实10 g,炙甘草6 g,购自湖南中医药大学第一附属医院,加水煎煮,浓缩至含生药4 g/mL。格列齐特缓释片[施维雅(天津)制药有限公司],规格:30 mg/片×30片,溶于生理盐水,按2.7 mg/kg予大鼠灌胃。
1.3 主要试剂与仪器
超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成,A001-1-1-48T;A003-1-48T;A005-48T);Bax、Bcl-2兔抗鼠多克隆抗体(Proteintech公司,50599-2-Ig;12789-1-ap);全自动酶标洗板机:深圳市汇松科技发展有限公司,型号:PW-812;多功能酶标分析仪:深圳市汇松科技发展有限公司,型号:MB-530。
1.4 分组及给药
Wistar大鼠作为空白组,予普通饲料喂养;42只GK大鼠予高糖高脂饲料连续喂养4周后,经尾静脉采血测空腹血糖(fasting plasma glucose, FPG)和随机血糖,以两次FPG≥7.0 mmol/L或随机血糖≥11.1 mmol/L认为2型糖尿病模型成立,随后将成模的40只GK大鼠按随机数字表分为5组,分别为:模型组,西药组(格列齐特缓释片),BXD低、中、高剂量组。各组大鼠予相应药物进行灌胃,模型组及空白组给予等体积蒸馏水灌胃。BXD低、中、高剂量组分别按6、12、24 g/kg体质量给药,西药组按2.7 mg/kg体质量灌胃,灌胃体积为10 mL/kg。各组大鼠每天灌胃1次,连续给药10周后处死。实验过程中BXD低、中剂量组各死亡1只,其中1只死于气道损伤,另1只死因不明。
1.5 指标检测
记录大鼠体质量,尾静脉采血测FPG;末次给药后,大鼠隔夜禁食12 h,取材前对各组大鼠称体质量,按3 mL/kg体质量向各组大鼠腹腔注射10%水合氯醛进行麻醉,固定大鼠,经腹主动脉取血,3 500 r/min,4 ℃,离心10 min,取上清,采用全自动生化分析仪检测糖化血红蛋白(HbAlc),严格按试剂盒说明检测血清SOD、MDA、GSH-Px。取左心室心肌组织,浸入4%多聚甲醛溶液中固定,石蜡包埋,制成切片,行HE染色、PAS染色等病理形态学观察;免疫组化检测Bax、Bcl-2表达。
1.6 统计学处理
所有计量资料以“x±s”表示,采用SPSS 23.0统计软件进行数据处理,多组间两两比较采用单因素方差分析法,方差齐时采用LSD检验,方差不齐则采用Dunnett’s T3检验,P<0.05则认为差异有统计学意义,P<0.01认为差异有显著统计学意义。
2 结果
2.1 加味生脉补心丹对GK大鼠一般情况的影响
空白组大鼠毛发色白干净、有光泽,精神状态良好,活泼好动,垫料干净无异味,体质量增长明显,舌色、唇色淡紅润泽;模型组毛发明显发黄枯燥、杂乱易脱落,精神萎靡,活动量明显减少,反应迟钝、嗜睡,喜溜边、扎堆,垫料潮湿、有烂气味,大便软,舌色、唇色暗紫。从外在证候观察,BXD低剂量组一般情况无明显改善。西药组及BXD中、高剂量组毛发无明显发黄,精神状态、活动度较好,唇色及舌色红润。
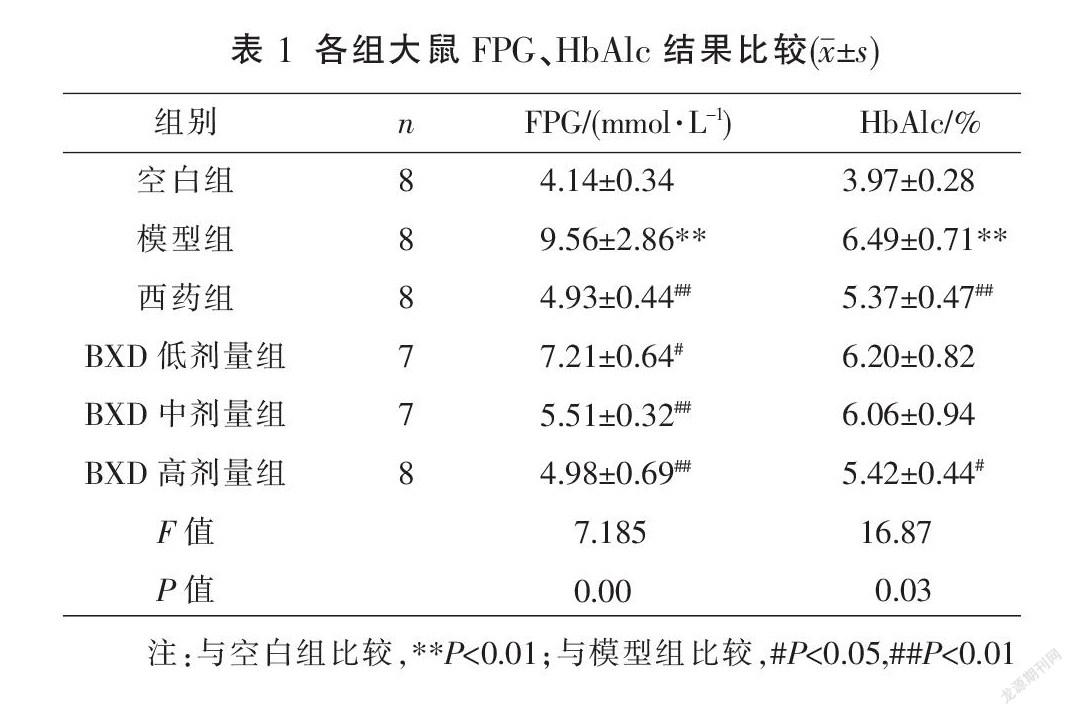
2.2 加味生脉补心丹对GK大鼠FPG、HbAlc的影响
FPG:药物干预10周后,与空白组比较,模型组FPG显著升高(P<0.01);与模型组比较,BXD低剂量组FPG降低(P<0.05);西药组、BXD中、高剂量组FPG显著降低(P<0.01)。
HbAlc:与空白组比较,模型组HbAlc显著升高(P<0.01)。与模型组比较,西药组HbAlc显著降低(P<0.01),BXD高剂量组HbAlc降低(P<0.05),BXD低、中剂量组HbAlc差异无统计学意义(P>0.05)。见表1。
2.3 加味生脉补心丹对GK大鼠氧化应激相关指标的影响
与空白组比较,模型组SOD、GSH-Px均显著降低(P<0.01),MDA显著升高(P<0.01)。与模型组比较,西药组SOD、GSH-Px均显著升高(P<0.01),MDA降低(P<0.05);BXD高剂量组SOD、GSH-Px显著升高(P<0.01),MDA降低(P<0.05);BXD中、低剂量组GSH-Px显著升高(P<0.01或P<0.05);BXD中、低剂量组MDA、SOD差异无统计学意义(P>0.05)。见表2。
2.4 加味生脉补心丹对GK大鼠心肌病理形态学的影响
HE染色:光镜下可见空白组心肌细胞核呈圆形或者椭圆形,细胞核位于中央细胞内肌原纤维排列整齐,心肌纤维完整无断裂、重排,心肌细胞未见固缩性坏死。模型组明显可见心肌细胞核边缘模糊,有毛刺,胞核位置偏向两端,心肌纤维排列紊乱,可见断裂不完整纤维;心肌细胞肥大、水肿明显(淡染),可见固缩变性、局灶性坏死的心肌细胞;西药组心肌纤维排列较整齐,偶可见溶解断裂,心肌细胞水肿及坏死明显减少;BXD低剂量组心肌纤维可见明显的溶解断裂,心肌细胞水肿坏死、排列紊乱;BXD中、高剂量组可见心肌细胞肌原纤维排列整齐,边缘光滑,无明显斷裂,未见明显水肿及坏死细胞。见图1。
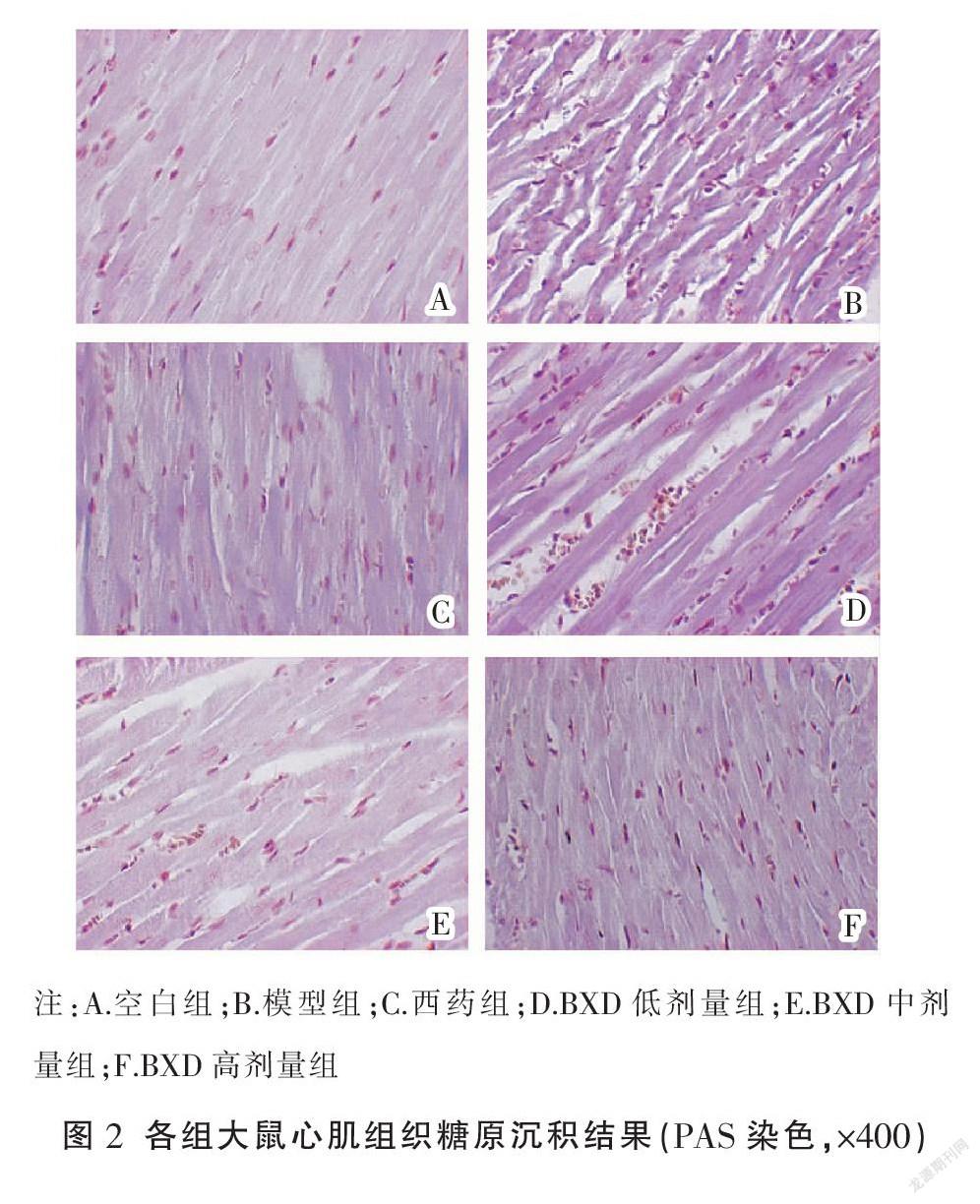
PAS染色可见:空白组心肌组织淡染,紫红色糖原阳性染色区域极少;模型组心肌组织中明显可见大量深染的糖原阳性物质沉积;BXD低剂量组心肌组织中糖原阳性物质沉积明显;西药组及BXD中、高剂量组心肌组织淡染,糖原阳性物质明显减少。见图2。
2.5 加味生脉补心丹对糖尿病心肌病大鼠心肌Bax、Bcl-2蛋白表达的影响
Bax蛋白表达:空白组心肌组织中空白组心肌组织中Bax蛋白染色较淡、表达较弱,厚度小;与空白组比较,模型组Bax表达显著增多(P<0.05);与模型组比较,西药组、BXD高剂量Bax表达显著减少(P<0.01);BXD中剂量组Bax表达减少(P<0.05)。见图3、表3。
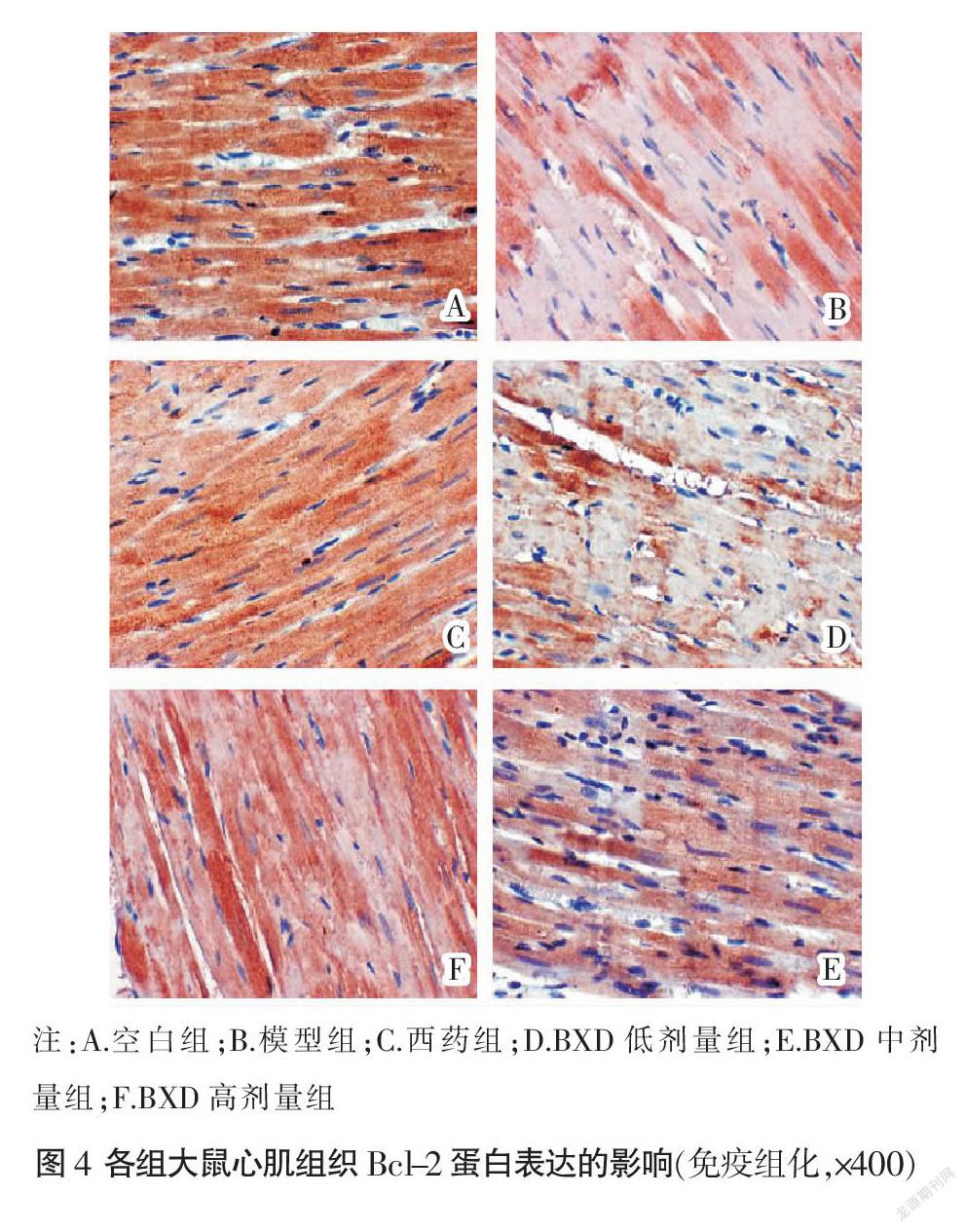
Bcl-2蛋白表达:空白组心肌组织中Bcl-2蛋白染色呈深棕色,呈强阳性表达,厚度适中;与空白组比较,模型组心肌组织Bcl-2表达显著减少(P<0.01);与模型组比较,西药组及BXD中、高剂量组Bcl-2表达显著增多(P<0.01);BXD低剂量组Bcl-2表达差异无统计学意义(P>0.05)。见图4、表3。
3 讨论
糖尿病在中医中属“消渴病”范畴,糖尿病心肌病作为糖尿病心血管并发症之一,目前多根据临床所表现的不同症状,如糖尿病患者并发心悸、心慌、胸痛、心痛等,而将其归类为“消渴病”并发“心悸”“怔忡”“胸痹”“心痛”,属于“消渴病心病”范畴。林兰教授[13]指出糖尿病心肌病病机是以心气虚、心阴虚为主,兼夹血瘀的本虚标实证,故在治疗上主要以益气养阴为主,再佐以活血化瘀、化痰通络等治法。加味生脉补心丹是课题组在长期临床实践的基础上自拟而成,具有益气养阴、活血化瘀、化痰通络之功。该方由人参、黄芪、生地黄、天花粉、丹参、水蛭、檀香、柏子仁、枳实、茯苓、荷叶、炙甘草等组成,全方补气阴之虚以治本为主,泻痰瘀之实以治标为辅,对糖尿病及其并发症的治疗效果显著,在我们前期的实验研究中也得到了验证[5-6]。
本研究中我们采用自发性非肥胖2型糖尿病GK大鼠联合高糖高脂饲料喂养建立糖尿病心肌病模型。GK大鼠是选取口服糖耐量处于上限的Wistar大鼠,经过反复近交繁殖数代而来,该鼠种主要表现为空腹血糖增高,进食后高血糖、胰岛素分泌受损与葡萄糖不耐受等,是研究2型糖尿病较为理想的国际公认的动物模型之一,长期患病后容易并发心血管病症[14-15]。本研究结果中发现GK大鼠在实验后期体质量增幅缓慢,这与该鼠种属非肥胖型的特性有关;模型组大鼠FPG显著高于空白组,且心肌组织HE染色可见心肌细胞肥大,心肌纤维排列紊乱、断裂及局灶性坏死;PAS染色可见心肌组织内大量糖原阳性物质沉积等病理性改变,成功构建了糖尿病心肌病模型,成模率可达95.2%。
本研究中采用的阳性对照药格列齐特缓释片是第二代磺脲类口服降糖药,是临床上治疗非肥胖、空腹胰岛素水平正常或偏低2型糖尿病首选药物之一;其结构中含有氮杂环,该杂环具有清除自由基的作用,因而具有改善氧化应激的独特作用[16-17],同时还具有减少动脉粥样硬化和心血管疾病发生的作用[16,18]。氧化应激是胰岛素抵抗、糖尿病和心血管疾病发病的共同土壤[19],SOD、GSH-Px等是机体抗氧化损伤的重要屏障;SOD是体内唯一可清除超氧阴离子的天然抗氧化酶,在对抗氧化损伤方面具有重要作用。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,它能够催化还原型谷胱甘肽(reducedglutathione, GSH)变为氧化型谷胱甘肽(oxidizidedglutathione, GSSG),使细胞不受过氧化物的干扰及损害。MDA是自由基作用于脂质发生过氧化反应的氧化终产物,具有细胞毒性。在本实验中我们发现模型组SOD、GSH-Px水平显著降低,MDA水平显著升高,而BXD能显著提高SOD、GSH-Px水平,减少MDA含量,表明该方具有良好的抗氧化作用。Bcl-2是首个被发现与凋亡有关的基因,Bcl-2基因家族主要包括Bcl-2等抑制凋亡蛋白及Bax等促凋亡蛋白;大量研究发现氧化应激介导了心肌细胞凋亡,高血糖状态下大量ROS生成,可激活多条信号通路诱导细胞自噬、损伤内皮细胞、导致心肌肥厚等[20];此外,ROS还可以引起线粒体的损伤,释放促凋亡基因,引起一系列级联反应活化下游的Caspase家族,启动细胞的凋亡程序,从而引起心肌细胞损伤[21]。在本研究中我们发现模型组Bcl-2表达显著减少,Bax表达显著增加,而BXD能显著增加Bcl-2的表达,减少Bax表达,说明该方具有抑制心肌细胞凋亡的作用,其可能机制是通过增强抗氧化能力从而减少心肌细胞损伤。
中医药在防治糖尿病并发症的整体调节上具有很大优势,BXD一方通过诸药配伍起到标本兼治的作用,能够从多靶点、多方位对疾病起到整体治疗的效果,这也是中药复方的特色与优势所在,然而其作用的内在分子机制是一个复杂的网络体系,还有许多值得深入探讨的地方。通过增强机体抗氧化防御系统清除能力,抑制氧化应激对心肌的损伤,从而发挥对心肌的保护作用,是延缓糖尿病心肌病发展的治疗策略之一。
参考文献
[1] BERRY C, BRETT M, STEVENSON K, et al. Nature and prognostic importance of abnormal glucose tolerance and diabetes in acute heart failure[J]. Heart, 2008,94(3):296-304.
[2] LIU Q, WANG S, CAI L.. Diabetic cardiomyopathy and its mechanisms: Role of oxidative stress and damage[J]. Journal of Diabetes Investigation,2014,5(6):623-634.
[3] FARIA A, PERSAUD S J. Cardiac oxidative stress in diabetes: Mechanisms and therapeutic potential[J]. Pharmacology and Therapeutics,2017,172:50-62.
[4] 黃惠勇,吴华堂,李路丹,等.生脉补心丹治疗冠心病的临床研究[J]. 中国中医药科技,1997,(6):329-331,5.
[5] 吴华英,潘继兴,邓文祥,等.加味生脉补心丹对2型糖尿病心肌病大鼠糖脂代谢与脂联素的影响[J].江西中医药大学学报,2017,
29(2):74-76.
[6] 陈青扬,黄惠勇,刘卜菡,等.加味生脉补心丹对防治2型糖尿病大鼠心肌损害的影响[J].湖南中医药大学学报2016,36(3):5-8.
[7] GOTO Y, KAKIZAKI M, MASAKI N. Production of spontaneous diabetic rats by repetition of selective breeding[J]. Tohoku Journal of Experimental Medicine,1976,119(1):85-90.
[8] D'SOUZA A, HOWARTH F C, YANNI J, et al. Left ventricle structural remodelling in the prediabetic Goto-Kakizaki rat[J]. Expeimental Physiology,2011,96(9):875-888.
[9] EL-OMAR M M, YANG Z K, PHILLIPS A O, et al. Cardiac dysfunction in the Goto-Kakizaki rat. A model of type II diabetes mellitus[J]. Basic Research in Cardiology, 2004,99(2):133-141.
[10] DESROIS M, LAN C, MOVASSAT J, et al. Reduced up-regulation of the nitric oxide pathway and impaired endothelial and smooth muscle functions in the female type 2 diabetic goto-kakizaki rat heart[J]. Nutrition and Metabolism, 2017,14:6.
[11] KORKMAZ-IC?魻Z S, LEHNER A, LI S, et al. Left ventricular pressure-volume measurements and myocardial gene expression profile in type 2 diabetic Goto-Kakizaki rats[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2016,311(4):H958-H971.
[12] ILTIS I, KOBER F, DESROIS M, et al. Defective myocardial blood flow and altered function of the left ventricle in type 2 diabetic rats: a noninvasive in vivo study using perfusion and cine magnetic resonance imaging[J]. Investigative Radiology, 2005,40(1):19-26.
[13] 陈世波,倪 青.林兰辨治糖尿病心肌病的遣药组方思路[J].辽宁中医杂志,2006,33(8):919-920.
[14] D'SOUZA A, HOWARTH F C, YANNI J, et al. Chronic effects of mild hyperglycaemia on left ventricle transcriptional profile and structural remodelling in the spontaneously type 2 diabetic Goto-Kakizaki rat[J]. Heart Failure Reviews,2014,19(1):65-74.
[15] HOWARTH F C, SHAFIULLAH M, QURESHI M A. Chronic effects of type 2 diabetes mellitus on cardiac muscle contraction in the Goto-Kakizaki rat[J]. Experimental Physiology, 2007,
92(6):1029-1036.
[16] JENNINGS P E. Vascular benefits of gliclazide beyond glycemic control[J]. Metabolism, 2000,49(10 Suppl 2):17-20.
[17] 張慧娟,刘晓民,王月影,等.格列齐特对2型糖尿病患者氧化应激状态的影响[J].中国糖尿病杂志,2007,15(12):748-749.
[18] KIMOTO K, SUZUKI K, KIZAKI T, et al. Gliclazide protects pancreatic beta-cells from damage by hydrogen peroxide[J]. Biochemical and Biophysocal Research Communications,2003,303(1):112-119.
[19] CERIELLO A, MOTZ E. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes, and cardiovascular disease? The common soil hypothesis revisited[J]. Arteriosclerosis, Thrombosis, and Vascular Biology,2004,24(5):816-823.
[20] HORI M, NISHIDA K. Oxidative stress and left ventricular remodelling after myocardial infarction[J]. Cardiovascular Research, 2009,81(3):457-464.
[21] LONG X, GOLDENTHAL M J, MARíN-GARCíA J. Oxidative stress enhances phosphorylation of p53 in neonatal rat cardiomyocytes[J]. Molecullar and Cellular Biochemistry,2007,303(1/2):167-174.

