冰片配伍黄芪甲苷与三七总皂苷抗脑缺血再灌注损伤 有效剂量的研究
杨筱倩 陈仙蕾 杨仁义 唐标 刘晓丹 邓常清 黄小平







〔摘要〕 目的 探討冰片配伍黄芪甲苷(astragalosides Ⅳ, AST Ⅳ)和三七总皂苷(panax notoginseng saponins, PNS)抗脑缺血再灌注损伤的有效剂量。方法 采用U6*(64)均匀设计实验,设立6个不同剂量的冰片、AST Ⅳ和PNS配伍,予大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)再灌注大鼠灌胃干预,以神经功能评分、脑梗死率、脑含水量、脑组织病理形态、血脑屏障(blood-brain barrier, BBB)通透性评价药物的作用,对效应指标进行多重线性回归分析,确立3种组(成)分的有效配伍剂量,并在此基础上进行验证。结果 均匀设计实验表明,大鼠脑缺血再灌注后,出现明显的神经功能障碍,脑梗死率、脑含水量、神经细胞损伤率和BBB通透性均显著增加。冰片、AST Ⅳ、PNS不同剂量配伍对上述指标均有一定的改善作用;多重线性回归分析表明,冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg配伍为其抗脑缺血再灌注损伤的有效配伍剂量。验证实验显示,3种药物高、低剂量配伍能显著降低脑缺血再灌注大鼠神经功能评分和脑梗死率,3种药物配伍的效应显著优于各药物单用或AST Ⅳ+PNS配伍(P<0.05或P<0.01)。结论 冰片、AST Ⅳ、PNS配伍可增强抗脑缺血再灌注损伤的效应,3种药物的有效配伍剂量为冰片7.5 mg/kg+AST Ⅳ 10 mg/kg+PNS 25 mg/kg。
〔关键词〕 冰片;黄芪甲苷;三七总皂苷;脑缺血再灌注;配伍剂量
〔中图分类号〕R285.5;R743 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.003
Study on the Effective Dosage of Borneol Combined with Astragalosides Ⅳ and Panax
Notoginseng Saponins Antagonizing Cerebral Ischemia-Reperfusion Injury
YANG Xiaoqian, CHEN Xianlei, YANG Renyi, TANG Biao, LIU Xiaodan, DENG Changqing*, HUANG Xiaoping*
(Molecular Pathology Laboratory, Key Laboratory of Hunan Province for Prevention and Treatment of Integrated Traditional Chinese and Western Medicine on Cardio-Cerebral Diseases, Key Laboratory of Hunan Universities for Cell Biology and Molecular Techniques, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To explore the effective dosage of Borneol combined with Astragalosides Ⅳ (AST Ⅳ) and panax notoginseng saponins (PNS) antagonizing cerebral ischemia-reperfusion injury. Methods According to U6*(64) uniform design experiment, 6 different dosage combinations of Borneol, AST Ⅳ and PNS were set. The middle cerebral artery occlusion (MCAO)-reperfusion rats was administrated. The neurological function score, cerebral infarct volume, brain water content, brain histopathological morphology, blood-brain barrier (BBB) permeability were used to assess the effects of drugs. The effect index was analyzed using multiple linear regression method, thus to ascertain the effective combination dosage of 3 ingredients (components), and the effective combination dosage were exerted to the experimental verification. Results The uniform design experiment results showed that the rats appeared obvious neurological dysfunction, cerebral infarction rate, brain water content, nerve cell injury rate and BBB permeability were all increased after cerebral ischemia-reperfusion. The different dosage combinations of Borneol, AST Ⅳ and PNS could improve the index above. Multiple linear regression analysis showed that the effective combination dosage of Borneol, AST Ⅳ and PNS antagonizing cerebral ischemia-reperfusion injury was Borneol 7.5 mg/kg, AST Ⅳ 10 mg/kg, PNS 25 mg/kg, respectively. Verification experiment results showed that 3 drug combinations with high or low dosage could significantly decrease neurological function score and cerebral infarct volume of cerebral ischemia-reperfusion rats, and the effects of the combinations were significantly better than that of single drug or AST Ⅳ+PNS (P<0.05 or P<0.01). Conclusion The combinations of Borneol, AST Ⅳ and PNS can enhance the effects of anti-cerebral ischemia-reperfusion injury, and the effective combination dosage is Borneol 7.5 mg/kg+AST Ⅳ 10 mg/kg+PNS 25 mg/kg.
〔Keywords〕 Borneol; Astragalosides Ⅳ; panax notoginseng saponins; cerebral ischemia-reperfusion; combination dosage
脑梗死是由于脑组织动脉血管阻塞使其血供障碍,进而导致脑组织形态和功能受损,该病具有发病率高、致残率高、死亡率高和复发率高等特点,严重危害了人类的健康[1]。研究表明[2-3],脑组织在缺血再灌注后会发生更严重的损伤,这种损伤常由Ca2+超载、脑组织能量代谢紊乱、氧化应激损伤、炎症反应等一系列变化引起,最终将导致神经细胞损伤甚至细胞死亡。
中医学认为脑卒中的基本病机是虚、火、气、血、风、痰,以气虚和血瘀为主,气虚血瘀为缺血性中风的主要病理机制,运用益气活血法治疗常可收到良好的疗效[4]。针对缺血性中风的治疗,临床常以益气药黄芪和活血药三七配伍使用,符合中医学益气活血的治疗原则。药物化学研究表明,黄芪总苷(astragalosides, AST)是黄芪中具有心脑血管药理作用的主要药效组分,主要含黄芪甲苷(astragalosides Ⅳ, AST Ⅳ)等;三七总皂苷(panax notoginseng saponins, PNS)是三七中具有心脑血管效应的主要药效组分,主要含人参皂苷Rg1、Rb1和三七皂苷R1等。目前对AST和PNS两类有效组分配伍的心脑血管效应研究已有相关报道,我们的研究发现,黄芪和三七中的主要有效组(成)分及其配伍可通过脑缺血后的多个病理生理环节,协同发挥抗脑缺血再灌注损伤的作用[5-8]。但AST给药后主要分布于肝、脾、心、肺中,在脑组织中分布较少,难以穿透血脑屏障(blood-brain barrier, BBB)[9-10]。PNS给药后,人参皂苷Rg1、Rb1及三七皂苷R1等主要分布于肾、肺、肝、心脏,在脑组织中含量均较少[11]。由此可见,AST和PNS的主要成分由于其分子量大、脂溶性低,透过BBB的量少,难以更好地在病变脑组织发挥药效作用。冰片相对分子质量为154.24,是一种小分子脂溶性单萜类物质,不仅本身能透过BBB,还可促进其它药物进入脑组织[12],具有“引药上行”的作用,常作为辅药或引经药使用以促进药物吸收及进入病变部位,从而对脑相关疾病的治疗发挥协同增效作用[13]。张青等[14]采用冰片400 mg/kg+黄芪40 mg/kg组合,发现冰片能开放脑缺血再灌注后BBB,促进药物入脑。吴俊杰等[15]研究发现,冰片20 mg/kg+梓醇49 mg/kg+葛根素200 mg/kg可以增加脑缺血模型BBB通透性,并促进梓醇、葛根素透过BBB。因此,本研究采用大鼠脑缺血再灌注模型和功能、形态评价方法,探讨冰片配伍AST Ⅳ和PNS抗脑缺血的增效作用,确立3种组(成)分配伍的有效剂量,为新型抗脑缺血中药的开发与应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 冰片(左旋龙脑,质量分数86%),购自本校附属医院药剂科;AST IV(质量分数≥98%,批号:MUST-15032010)、PNS(质量分数≥98%,批号:MUST-14122912),均购自成都曼思特生物科技有限公司,药物用时以0.5%羧甲基纤维素钠配成相应浓度混悬液。2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium hloride, TTC,美国Sigma公司,批号:T8877-5G),水合氯醛(梯希爱化成工业发展有限公司,批号:8MQ20-CC),伊文思蓝(美国Sigma公司,批号:314-13-6),PBS(Solarbio公司,批号:P1010)。
1.1.2 动物 SPF级雄性SD大鼠,体质量200~250 g,由湖南斯莱克景达实验动物有限公司提供(动物合格证号:43004700037715)。饲养于湖南中医药大学动物实验中心[场地许可证号:SKY(湘)2013-0005]。实验前适应性喂养饲养5~7 d,给药前禁食12 h,自由饮水。
1.2 方法
1.2.1 药物剂量、配制、分组与干预 根据《中华人民共和国药典》记载,冰片成人每天用量为0.15~0.3 g,大鼠的等效剂量为15~30 mg/kg,故以30 mg/kg为本实验的冰片常用剂量。根据我们前期研究,AST IV在大鼠以40 mg/kg剂量单独应用及与PNS配伍时具有抗脑缺血再灌注损伤的作用,故以40 mg/kg为本实验AST Ⅳ的常用剂量;PNS在大鼠以100~120 mg/kg单用及与AST Ⅳ配伍时,具有抗脑缺血作用,故以100 mg/kg为本实验PNS的常用剂量。以常用剂量为中点,采用基线等比设计方法,每个药物设计6个剂量水平,药物剂量以50%递增或递减。见表1。
采用U6*(64)均匀设计实验,根据表1设定的6个剂量水平,得到3种药物6个不同的配伍实验组。见表2。
另设模型组、假手术组,共计8组。取SPF级SD大鼠,灌胃干预3 d,每天2次,2次给药间隔时间12 h。于第3天干预后1 h制作大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)缺血模型[6],假手术组仅游离颈总动脉、颈外动脉和颈内动脉,不做结扎、插线处理,其他操作同其它组。缺血2 h后进行再灌注,再灌注期间继续给药。假手术组和模型组灌胃等容量0.5%羧甲基纤维素钠。于再灌注后24 h进行相应指标检测。
1.2.2 神經功能学评分 大鼠再灌注24 h后,参考文献[6]对动物的神经功能进行评分。
1.2.3 脑梗死率测定 于再灌注24 h后,麻醉处死大鼠,迅速取脑。置-20 ℃冰箱15 min,去除小脑、脑干等,沿冠状面将脑组织连续切片5片,每片厚2 mm,立即将切片放入2% TTC磷酸缓冲液中,置37 ℃水浴避光染色20 min,每5分钟将脑片轻轻翻动1次。染色后置于4%多聚甲醛溶液中固定,24 h后将每片脑组织拍照。用Image-pro plus 6.0图像分析软件测量梗死灶面积。根据公式
V=t(A1+A2……+An)/全脑体积
计算梗死灶体积,再进一步计算梗死灶体积占全脑体积的百分比即为脑梗死率。其中t为切片厚度,A为梗死面积。
1.2.4 脑水肿率测定 计算出梗死灶体积和/全脑体积后,根据文献[16]计算脑水肿率
S=(∑LT-∑RT)/(∑LT+∑RT)×100%
∑LT代表大脑左侧半球总体积,∑RT代表大脑右侧半球总体积。两侧大脑半球体积也由TTC染色结果可得。
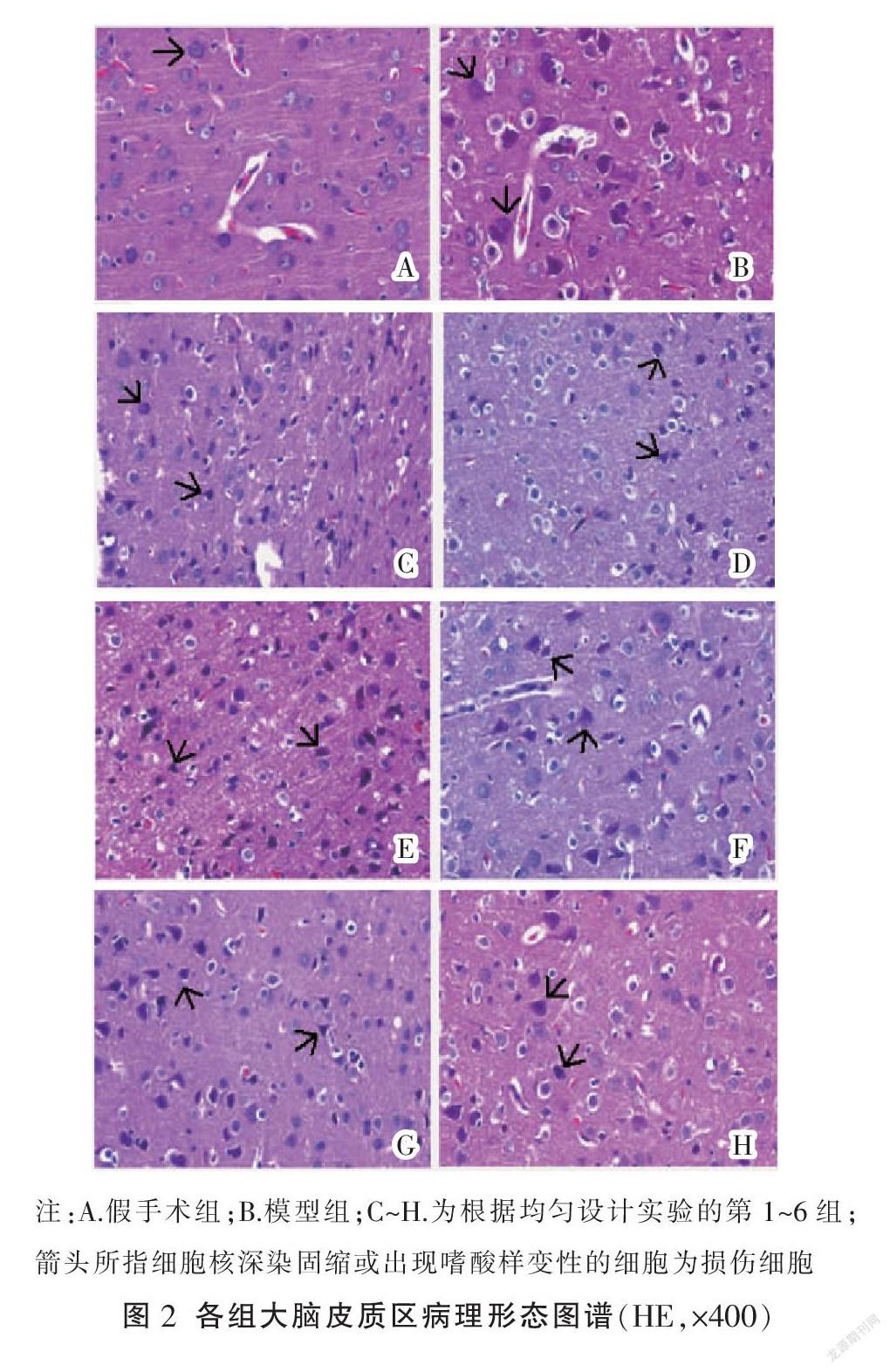
1.2.5 脑组织病理形态测定 将脑组织放入4%多聚甲醛中固定2~3 d,经视交叉平面冠状切片,经梯度酒精脱水、二甲苯透明、石蜡包埋,切成4 μm的切片,用于HE染色。将切片在显微镜(10×40)下随机取缺血侧皮质区的5个非重叠视野对损伤细胞进行观察,损伤细胞表现为空泡样变性、嗜酸性样变性、核固缩、核溶解等改变。分别计数每个高倍视野中的细胞总数及损伤细胞数。取5个视野的平均值作为该样本的细胞损伤率。
细胞损伤率=(损伤细胞数/细胞总数)×100%
1.2.6 伊文思蓝(Evans blue, EB)法测定血脑屏障通透性 于动物处死前30 min用10%水合氯醛麻醉,经股静脉注入2%EB生理盐水溶液(2 mL/kg)。30 min后放血处死大鼠,立即断颈取脑,滤纸吸干组织表面水分,小心剥取两侧大脑半球,按EB试剂盒说明书进行吸光度测定,根据EB标准曲线,计算脑组织EB漏出量(μg/g脑组织),以此反映BBB受损情况。
1.3 验证实验
根据均匀设计实验得出冰片、AST Ⅳ、PNS配伍的有效配伍剂量(冰片7.5 mg/kg,AST Ⅳ 10 mg/kg,PNS 25 mg/kg),将动物随机分为:假手术组、模型组、冰片7.5 mg/kg组、AST Ⅳ 10 mg/kg组、PNS 25 mg/kg组、AST Ⅳ 10 mg/kg+PNS 25 mg/kg组、冰片7.5 mg/kg+AST Ⅳ 10 mg/kg+PNS 25 mg/kg低剂量配伍组、冰片15 mg/kg+AST Ⅳ 20 mg/kg+PNS 50 mg/kg高剂量配伍组,以及依达拉奉4 mg/kg组,每组5只。灌胃干预3 d,每日2次,两次间隔时间12 h,于第3天给药后1 h同“1.2.1”制作MCAO模型。缺血2 h后进行再灌注,再灌注期间继续给药。于再灌注后24 h进行神经功能学评分及脑梗死率测定,方法同“1.2.2”及“1.2.3”。
1.4 统计方法
实验数据用“x±s”表示,采用SPSS 20.0统计软件分析。各组计量资料比较用单因素方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用Dunnet T3检验。P<0.05为差异具有统计学意义。均匀设计实验的二次回归分析,首先对各个效应指标进行多重线性回归分析,再将各效应指标赋予不同权重,计算其综合效应,同样采用均匀设计实验多重线性回归分析方法分析,明确三种药物配伍抗脑缺血再灌注损伤的有效配伍剂量。
2 结果
2.1 均匀设计实验分析
与假手术组比较,模型组神经功能评分、脑梗死率、脑水肿率、细胞损伤率、EB漏出量均显著增加(P<0.01),表明脑缺血再灌注后神经细胞损伤,脑含水量增多,BBB受损,出现神经功能缺损症状。与模型组比较,第1~5组能显著减少脑组织EB漏出量(P<0.01),且第5配伍组还能显著降低神经功能评分、脑梗死率、脑水肿率,差异均具有统计学意义(P<0.01)。见表3。
将实验药物配比方案及以上的实验结果进行多重线性回归分析(回歸方程中设定X1为冰片,X2为AST Ⅳ,X3为PNS,Y为各组各指标的数据),结果如下。
2.1.1 神经功能评分 多重线性回归分析为
Y=2.072+0.002X2
由于要求神经功能评分(Y值)越小越好,故冰片、AST Ⅳ、PNS均应取实验范围内的最小值,即冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg。
2.1.2 脑梗死率 白色区为梗死灶,红色区为正常脑组织。假手术组脑组织未见苍白梗死区,模型组出现较大范围的苍白梗死灶,各药物组梗死体积均有不同程度减少,见图1。多重线性回归分析为
Y=18.039+0.21X1+0.117X2+0.044X3
由于要求脑梗死率(Y值)越小越好,故冰片、AST Ⅳ、PNS均应取实验范围内的最小值,即冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg。
2.1.3 脑水肿率 多重线性回归方程为
Y=4.819+0.29X1+0.45X2+0.3X3
由于要求脑水肿率(Y值)越小越好,故冰片、AST Ⅳ、PNS均应取实验范围内的最小值,即冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg。
2.1.4 细胞损伤率 假手术组大脑皮质区细胞结构完整,形态规则,排列紧密。模型组脑组织细胞周围间隙增大,胞核不规整,间质水肿明显,排列紊乱,细胞核深染固缩或出现嗜酸性样变性,损伤细胞增多,各给药组细胞损伤程度有所减轻,见图2。多重线性回归方程为
Y=84.538-0.12X1+0.026X2-0.038X3
由于要求细胞损伤率(Y值)越小越好,故冰片、PNS应取实验范围内的最大值,AST Ⅳ取最小值,即冰片120 mg/kg、AST Ⅳ10 mg/kg、PNS400 mg/kg。
2.1.5 EB漏出量 多重線性回归方程为
Y=0.72+0.02X1+0.01X2
由于要求EB漏出量(Y值)越小越好,故冰片、AST Ⅳ、PNS均应取实验范围内的最小值,即冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg。
2.1.6 各指标综合加权评分的多重线性回归分析 在5个指标单独分析的基础上进行综合分析,对每个指标赋予不同的权重,总权重为1,每个指标的平均权重系数为0.20。根据各指标的特异性和对脑损伤评价的重要性对每个指标赋予不同的权重。脑梗死率是直接评价脑组织损伤的指标,其特异性高;神经细胞损伤率是在微观上评价神经细胞损伤的指标,也具有特异性高和直观的特点。因此,将脑梗死率和神经细胞损伤率两个指标在平均权重系数的基础上各增加50%,即脑梗死率和细胞损伤率权重系数均为0.3。脑水肿率是评价脑缺血后脑水肿程度的指标,但由于本实验的脑水肿率是根据脑梗死率来间接计算的,因此,脑水肿率的权重系数在平均权重系数的基础上减少25%,即为0.15;EB漏出率是评价BBB受损的指标,但测定EB漏出率时受血管和血流状态等的影响,是间接评价BBB受损程度的指标,因此,其权重系数也是在平均权重系数的基础上减少25%,即为0.15。神经功能评分在一定程度上反映了神经功能缺损情况,该指标虽然在一定程度上可反映脑组织受损,但受机体状态和代偿功能等的影响,故权重系数是在平均权重系数的基础上减少50%,即为0.10。将各指标的平均值×权重系数得到每项指标的权重得分,将各项指标的权重得分相加得到权重总分,再进行分析,见表3。将实验药物配比方案及其对应的实验结果进行多重线性回归分析,得回归方程为
Y=4.446+0.007X2+0.000 005X3
由于要求权重总分(Y值)越小越好,故冰片、AST Ⅳ、PNS均应取实验范围内的最小值,即冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS25 mg/kg。
2.2 验证实验
假手术组大鼠无神经缺损症状。与假手术组比较,模型组神经功能评分显著升高(P<0.01)。与模型组比较,3种药物配伍低、高剂量组及依达拉奉组神经功能评分显著降低(P<0.05或P<0.01),且3种药物配伍低剂量组的效应显著优于各药物单用组(P<0.05)。见图3。
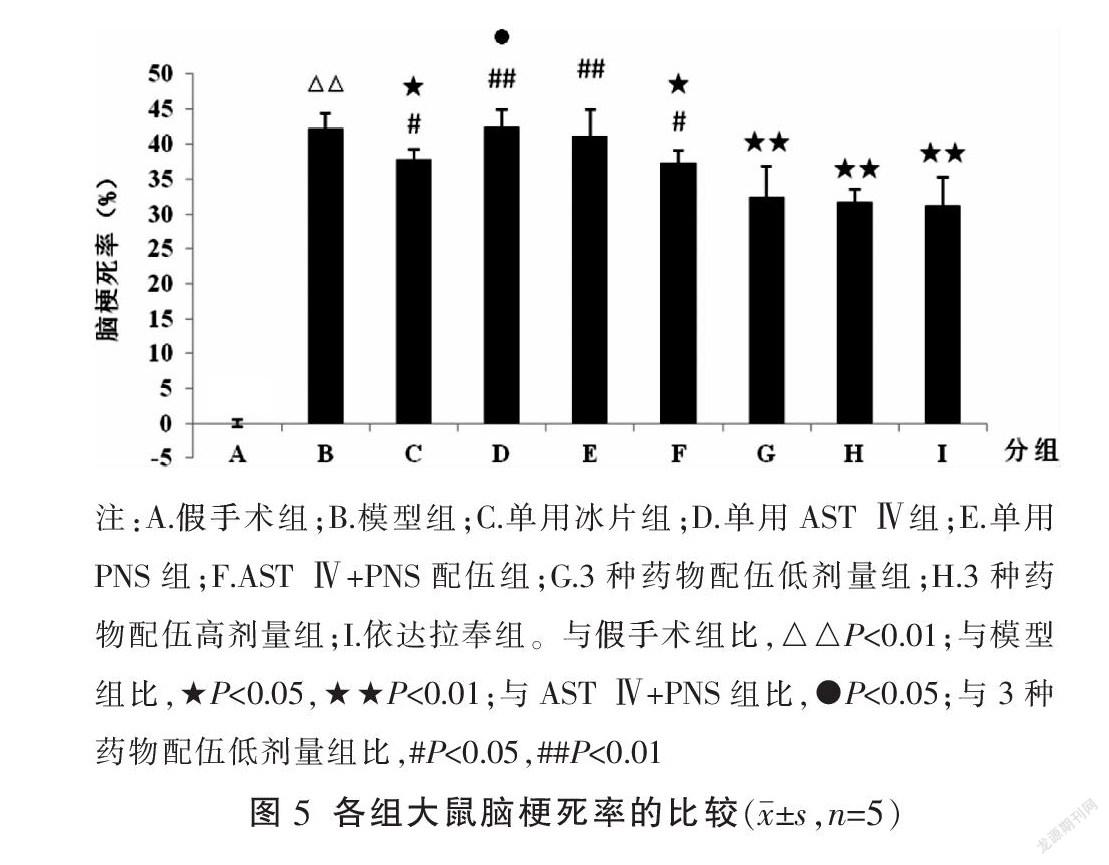
脑梗死率比较表明,假手术组无梗死灶形成,脑梗死率为0。与假手术组比较,模型组脑梗死率显著升高(P<0.01)。与模型组比较,冰片组,AST Ⅳ+PNS配伍组,3种药物配伍高、低剂量组及阳性药物依达拉奉组脑梗死率显著缩小(P<0.05或P<0.01),且AST Ⅳ+PNS配伍组的效应强于AST Ⅳ单用组(P<0.05),3种药物配伍低剂量组效应强于各药物单用组及AST Ⅳ+PNS配伍组(P<0.05或P<0.01)。见图4-5。
3 讨论
冰片口服后可经胃肠道迅速吸收,广泛分布于心、肺、脾脏,且极易透过血脑屏障进入脑组织。冰片及其配伍抗脑缺血的作用主要反映在两个方面:一是冰片单用具有一定的抗脑缺血作用,能减少脑缺血再灌注模型的脑梗死体积[17],抑制大鼠脑缺血再灌注急性期炎症损伤[18],抑制氧化应激损伤和细胞凋亡[19]。但冰片单用抗脑缺血的作用不强,常常作为佐使药与其它药物配伍使用,通过促进药物吸收和进入病变部位,发挥协同增效作用。在抗脑缺血方面,研究表明,冰片配伍麝香可改善脑缺血动物血脑屏障通透性,减少脑梗死体积,抑制缺血后脑组织的炎症反应[20];冰片及丹参三七配伍后可通过促进血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达发挥脑保护作用[21]。因此,以冰片配伍其它药物,可促进药物吸收和进入病变脑组织,增强药物的抗脑缺血作用。
本研究采用均匀设计实验,研究表明,脑缺血2 h再灌注24 h后,大鼠出现神经功能障碍,脑梗死体积增大,脑含水量、神经细胞损伤率增加,血脑屏障受损严重,呈现明显的脑组织损伤。冰片、ASTⅣ、PNS不同剂量配伍可在一定程度上降低神经功能评分,减轻神经功能缺损症状,缩小脑梗死体积、降低脑含水量、神经细胞损伤率,减轻血脑屏障受损。各指标综合加权计分的多重线性回归分析表明,冰片7.5 mg/kg、AST Ⅳ10 mg/kg、PNS 25 mg/kg配伍具有较好的抗脑缺血再灌注损伤作用,为三者抗脑缺血再灌注损伤的有效配伍剂量。验证实验结果显示,3种药物配伍的高、低剂量均能能显著降低大鼠神经功能评分,且3种药物低剂量配伍的效应显著优于各药物单用,表明冰片、AST Ⅳ、PNS配伍可增强对脑缺血再灌注后神经功能缺损障碍的改善作用;同时,冰片、AST Ⅳ+PNS配伍,3种药物高、低剂量配伍能显著降低脑梗死率,3种药物低剂量配伍效应强于各药物单用及AST Ⅳ+PNS配伍,也表明冰片、AST Ⅳ、PNS配伍对减轻脑缺血再灌注后脑组织损伤具有增效作用。至于冰片是否是通过促进AST Ⅳ和PNS透过血脑屏障发挥协同增效作用,以及入脑后的具体作用机制如何,尚待我们进一步研究。
参考文献
[1] 王陇德,王金环,彭 斌,等.《中国脑卒中防治报告2016》概要[J]. 中国脑血管病杂志,2017,14(4):217-224.
[2] 刘 磊,刘丽华,马玉奎.脑缺血再灌注损伤机制研究进展[J].药学研究,2016,35(9):542-544.
[3] 侯 昆,戴海龙,肖志成.脑缺血再灌注损伤研究进展[J].中国心血管病研究,2016,14(1):11-15.
[4] 李 颖,黄 桢,季晓霞,等.益气活血法治疗缺血性脑卒中研究进展[J].中西医结合心脑血管病杂志,2012,10(9):1112-1114.
[5] 黄小平,王 蓓,邱咏园,等.黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血再灌注氧化应激损伤和促进能量代谢的配伍研究[J].湖南中医药大学学报,2014,34(7):5-11.
[6] 李静娴,杨筱倩,唐 标,等.黄芪甲苷和三七总皂苷配伍抗大鼠脑缺血再灌注损伤及其药动学的研究.中国中药杂志,2017,42(19): 3786-3794.
[7] HUANG X P, TAN H, CHEN B Y, et al. Combination of total astragalus extract and total panax notoginseng saponins strengthened the protective effects on brain damage through improving energy metabolism and inhibiting apoptosis after cerebral ischemia-reperfusion in mice[J]. Chinese Journal of Integrative Medicine, 2017, 23(6): 445-452.
[8] HUANG X P, DING H, Lu J D, et al. Effects of the combination of the main active components of astragalus and panax notoginseng on inflammation and apoptosis of nerve cell after cerebral ischemia-reperfusion[J]. American Journal of Chinese Medicine, 2015, 43(7): 1419-1438.
[9] CHANG Y X, SUN Y G, LI J, et al. The experimental study of astragalus membranaceus on meridian tropsim: The distribution study of astragaloside IV in rat tissues[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2012, 911: 71-75.
[10] ZHANG W D, ZHANG C, LIU R H, et al. Preclinical pharmacokinetics and tissue distribution of a natural cardioprotective agent astragaloside IV in rats and dogs[J]. Life Sciences, 2006, 79(8): 808-815.
[11] LIU H, YANG J, DU F, et al. Absorption and disposition of ginsenosides after oral administration of panax notoginseng extract to rats[J]. Drug Metabolism and Disposition, 2009,37(12): 2290-2298.
[12] 王利蘋,奉建芳,胡凯莉.芳香开窍中药对血脑屏障通透性的调节作用及其机制研究进展[J].中国中药杂志,2014,39(6):949-954.
[13] 汪宏锦,吴俊杰,薛 强,等.冰片对血脑屏障通透性的双向调节作用影响因素及机制探讨[J].中国中药杂志,2017,42(11):2200-2205.
[14] 张 青,李茂利,赵 阳,等.黄芪加冰片对大鼠脑缺血再灌注损伤后VEGF表达的影响[J].山东医药,2010,50(7):88.
[15] 吴俊杰,汪宏锦,杨 帅,等.冰片对梓醇及葛根素透过局灶性脑缺血模型大鼠血脑屏障作用的研究[J].中国中药杂志,2016,41(21):3988-3995.
[16] 江 君,杨巍巍,张 楠,等.低氧预适应减轻脑中动脉阻塞所致小鼠缺血性脑损伤[J].基础医学与临床,2009,29(2):113-118.
[17] 夏鑫华,刘亚敏,赵光峰.麝香配伍冰片对大鼠局灶性脑缺血再灌注损伤的脑保护研究[J].中国实验方剂学杂志,2009,15(2):42-45.
[18] 何晓静,吕庆杰,刘玉兰.冰片注射液对缺血再灌注大鼠脑内炎症反应的影响[J].华西药学杂志,2006,21(6):523-526.
[19] LIU R, ZHANG L, LAN X, et a1. Protection by borneol on cortical neurons against oxygen-glucose deprivation/reperfusion: involvement of anti-oxidation and anti-inflammation through nuclear transcription factor kapaB signaling pathway[J]. Neuroscience, 2011, 176: 408-419.
[20] 李 欢,夏鑫华,刘 梅,等.麝香配伍冰片干预局灶性脑缺血-再灌注损伤的代谢组学研究[J].中药材,2012,35(8):1274-1279.
[21] 胡利民,张艳军,王 威,等.冰片与丹酚酸B和三七总皂苷配伍对局灶性脑缺血-再灌注大鼠脑VEGF mRNA表达的影响[J].中国中西医结合急救杂志,2005,12(5):263-266.

