理冲生髓饮对卵巢癌SKOV3细胞周期和凋亡影响
付杨 杨莉莉 韩凤娟

摘要 目的:探讨理冲生髓饮对卵巢癌SKOV3细胞周期和凋亡影响。方法:以卵巢癌SKOV3细胞为研究对象,采用CCK-8法检测不同浓度顺铂对SKOV3细胞抑制作用,Annexin V-FITC法检测SKOV3细胞凋亡情况,细胞周期与细胞凋亡检测试剂测定SKOV3细胞周期变化,流式细胞术检测SKOV3细胞中CD44+CD117+细胞比例。结果:与空白组比较,24 h和48 h顺铂组SKOV3细胞凋亡率明显增加,G0/G1期细胞比例降低,S期细胞比例升高,CD44+CD117+细胞比例明显增加,与顺铂组比较,24 h和48 h理冲生髓饮联合顺铂组SKOV3细胞凋亡率明显增加,G1期细胞比例降低,S期细胞比例升高,CD44+CD117+细胞比例明显降低,其中理冲生髓饮中剂量组联合顺铂组作用效果最强。结论:理冲生髓饮具有抗肿瘤作用,其机制可能是增加顺铂对卵巢癌SKOV3细胞凋亡,调控细胞周期阻滞,降低卵巢癌SKOV3细胞中干细胞数量。
关键词 理冲生髓饮;卵巢癌SKOV3细胞;卵巢癌干细胞;细胞周期;细胞凋亡
Abstract Objective:To explore the effects of Lichong Shengsui decoction on cycle and apoptosis of ovarian cancer SKOV3 cells.Methods:Taking ovarian cancer SKOV3 cells as the research objects,the inhibitory effect of different concentrations of cisplatin on SKOV3 cells was detected by CCK-8 method.The apoptosis of SKOV3 cells was detected by Annexin V-FITC method.The cycle changes of SKOV3 cells was detected with the cell cycle and apoptosis detection reagents,and the ratio of CD44+CD117+ cells in SKOV3 cells was detected by flow cytometry.Results:Compared with the blank group,the apoptosis rate of SKOV3 cells in the cisplatin group was significantly increased in the 24 h and 48 h.The proportion of cells in G0/G1 phase was decreased,the proportion of cells in S phase cells was increased,and the proportion of CD44+ CD117+ cells was significantly increased.Compared with the cisplatin group,the apoptosis rate of SKOV3 cells in Lichong Shengsui Decoction combined with cisplatin was significantly increased in the 24 h and 48 h.The proportion of cells in G1 phase was decreased,the proportion of cells in S phase was increased,and the proportion of CD44+CD117+cells was significantly decreased.Among them,the middle dose of Lichong Shengsui Decoction combined with cisplatin group had the strongest effects.Conclusion:Lichong Shengsui Decoction has anti-tumor effect,and its mechanism maybe increase the apoptosis of ovarian cancer SKOV3 cells by cisplatin,regulate cell cycle arrest and decrease the number of stem cells in ovarian cancer SKOV3 cells.
Key Words Lichong Shengsui Decoction; Ovarian cancer SKOV3 cells; Ovarian cancer stem cells; Cell cycle; Cell apoptosis
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.06.008
卵巢癌死亡率居女性生殖系统恶性肿瘤第一位,病因和发病机制尚不明确。据统计全世界范围内每年有将近20万例患者被诊断为卵巢癌,12.5万例患者死亡[1]。理想的肿瘤细胞减灭术辅以系统的铂类药物为基础的化疗是卵巢癌的规范性治疗方案,尽管患者对肿瘤细胞减灭术和化疗最初治疗反应良好,而多数患者会因复发最终导致死亡,对铂类制剂的敏感程度决定卵巢癌患者最终疾病进展,化疗耐药是卵巢癌复发和治疗失败的最主要原因之一[2-3]。自20世纪70年代肿瘤干细胞学说提出以来,肿瘤干细胞被认为是肿瘤治疗失败的根本原因,干细胞特殊的生物学特性存在决定了肿瘤干细胞成为肿瘤治疗过程中的巨大障碍。有研究者提出,消灭肿瘤干细胞的多能性和自我更新能力可阻止上皮性卵巢癌疾病的进展和消除化疗耐药及其引起的复发[4,5]。因此,靶向消灭卵巢癌干细胞成为科研工作者的一个研究方向。课题组基于“温煦肾阳,搜剔胞络瘀滞”提出理冲生髓饮组方,该组方临床研究发现可减轻卵巢癌化疗患者化疗反应、提高机体免疫力,进而达到抗肿瘤作用,然而作用机制并不明确。基于此本研究探讨理冲生髓饮对卵巢癌SKOV3细胞增殖、凋亡以及亚细胞表型影响。
1 材料与方法
1.1 材料
1.1.1 动物 SD大鼠,雌性,体质量180~220 g,购于黑龙江中医药大学动物实验中心,饲养于黑龙江中医药大学妇科药理实验室,温度(25±2)℃,湿度45%~50%。
1.1.2 药物 理冲生髓饮有效药物组成:莪术、三棱、人参、黄芪、水蛭、浙贝母、鹿茸、淫羊藿,中药购于黑龙江中医药大学附属第一医院中药局。
1.1.3 试剂与仪器 青霉素和链霉素溶液(美国hyclone公司,批号:J170012)、胰蛋白酶(美国hyclone公司,批号:J180025)、1640培养液(美国hyclone公司,批号:AD17321268);胎牛血清(美国gibco公司,批号:1989478);CCK-8试剂盒(日本Dojindo公司,批号:LQ727);FITC Mouse Anti-Human CD44(美国BD公司,批号:5275777),PE Mouse Anti-Human CD117(美国BD公司,批号:5153811);APC Mouse Anti-Human CD133(美国BD公司,批号:5160823188);Annexin V-FITC细胞凋亡检测试剂盒(天津三箭生物技术有限公司,批号:AGZ20)和细胞周期与细胞凋亡检测试剂盒(碧云天生物技术研究所,批号:0101419190308);光学显微镜(日本Olympus公司,型号:IX51);酶标仪(瑞士TECAN公司,型号:Infinite M200 Pro);人卵巢癌SKOV3细胞株(上海中桥新舟生物技术有限公司,货号:ZQ0074)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 卵巢癌细胞培养和实验分组 卵巢癌细胞SKOV3用含10%FBS的1640培养基置于37 ℃,5%CO2培养箱中进行培养,3~4 d进行传代处理,取对数生长期细胞进行相关实验研究,实验分为:空白组:正常培养基培养、顺铂组:10 μg/mL顺铂、理冲生髓饮低剂量+顺铂组:10%含药血清+10 μg/mL顺铂,理冲生髓饮中剂量+顺铂组:10%含药血清+10 μg/mL顺铂,理冲生髓饮高剂量+顺铂组:10%含药血清+10 μg/mL顺铂,共5组。
1.2.1.2 理冲生髓饮含药血清制备 SD大鼠适应性喂养1周,随机分为空白组、理冲生髓饮低、中、高剂量组,每组8只,理冲生髓饮低剂量组予有效组分2.66 g/kg(相当于中药饮片8.55 g/kg),中剂量组给予有效组分5.32 g/kg(相当于中药饮片17.1 g/kg),高剂量组予有效组分10.64 g/kg(相当于中药饮片34.2 g/kg),蒸馏水稀释有效组分;空白组予同体积蒸馏水,连续灌胃7 d。于末次给药结束2 h眼眶取血,室温下静置30 min,离心机3 500 r/min 4 ℃离心10 min,抽取血清0.22 μm无菌条件下过滤2次,56 ℃恒温水浴锅灭活30 min,置-80 ℃冰箱保存备用。
1.2.2 给药方式 取对数生长期卵巢癌skov3细胞以104接种于24孔培养板中培养12 h,再分别加入不同浓度含药血清及顺铂干预24 h或者48 h,收集细胞用于后期实验。
1.2.3 检测指标与方法
1.2.3.1 CCK-8检测顺铂对卵巢癌细胞增殖抑制作用 取对数生长期人卵巢癌SKOV3细胞,调整细胞密度为104/mL加入96孔培养板,每孔加入100 μL置于5% CO2、37 ℃培养箱中孵育待细胞铺满瓶底后加入顺铂浓度梯度为0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、25 μg/mL、30 μg/mL,每孔加入含顺铂的培养液100 μL,每个浓度重复5个复孔,继续培养24 h,干预结束后每孔加入10 μL的CCK-8继续孵育4 h,酶标仪检测450 nm处的吸光度值。根据吸光度值计算顺铂对SKOV3细胞抑制率,求算IC50值。
1.2.3.2 Annexin V-FITC法检测理冲生髓饮联合顺铂对SKOV3细胞的凋亡情况影响 取对数生长期人卵巢癌SKOV3细胞,调整细胞密度为104/mL加入6孔培養板,每孔加入2 000 μL置于5% CO2、37 ℃培养箱中孵育24 h,实验分为空白组、顺铂组、顺铂+低剂量组、顺铂+中剂量组和顺铂+高剂量组,每孔加入2 000 μL含有相应药物的培养基,继续培养24 h和48 h,胰酶进行消化收集细胞,进行细胞计数,PBS洗涤2次,1 000 r/min离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC,轻轻混匀,加入10 μL碘化丙啶染色液,混匀,室温避光孵育20 min,孵育完成进行流式细胞仪检测。
1.2.3.3 流式细胞术检测理冲生髓饮联合顺铂对SKOV3细胞周期调控影响 取对数生长期人卵巢癌SKOV3细胞,调整细胞密度为104/mL加入6孔培养板,每孔加入2 000 μL置于5% CO2、37 ℃培养箱中孵育24 h,实验分为空白组、顺铂组、顺铂+低剂量组、顺铂+中剂量组和顺铂+高剂量组,每孔加入2 000 μL含有相应药物的培养基,继续培养24 h和48 h,胰酶进行消化收集细胞,进行细胞计数,加入1 mL冰浴预冷70%乙醇,轻轻吹打混匀,4 ℃固定2 h。1 000 r/min离心3~5 min,沉淀细胞,加入1 mL冰浴预冷的PBS,重悬细胞,1 000 r/min左右离心3~5 min离心弃上清,每管细胞样品中加入染色缓冲液0.5 mL,PI染色液25 μL,RNase A 10 μL,重悬细胞,37 ℃避光温浴30 min,用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。采用MODFIT分析软件进行细胞DNA含量分析和光散射分析。
1.2.3.4 理冲生髓饮联合顺铂对SKOV3细胞中CD44+CD117+的比例 取对数生长期人卵巢癌SKOV3细胞,调整细胞密度为104/mL加入6孔培养板,每孔加入2 000 μL置于5% CO2、37 ℃培养箱中孵育24 h,实验分为空白组、顺铂组、顺铂+低剂量组、顺铂+中剂量组和顺铂+高剂量组,每孔加入2 000 μL含有相应药物的培养基,继续培养24 h,胰酶进行消化收集细胞,进行细胞计数,PBS洗涤2次,1 000 r/min离心5 min,弃上清,加入100 μL PBS重悬细胞,加入20 μL FITC小鼠抗人CD44、5 μL PE小鼠抗人CD117、10 μL APC小鼠抗人CD133,混匀,避光孵育20 min,孵育结束后,加入2 mL PBS洗涤细胞,1 000 r/min离心5 min弃上清,加入500 μL PBS重悬细胞,上机进行检测。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,所得计量数据资料用均数±标准差(±s)表示,各组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
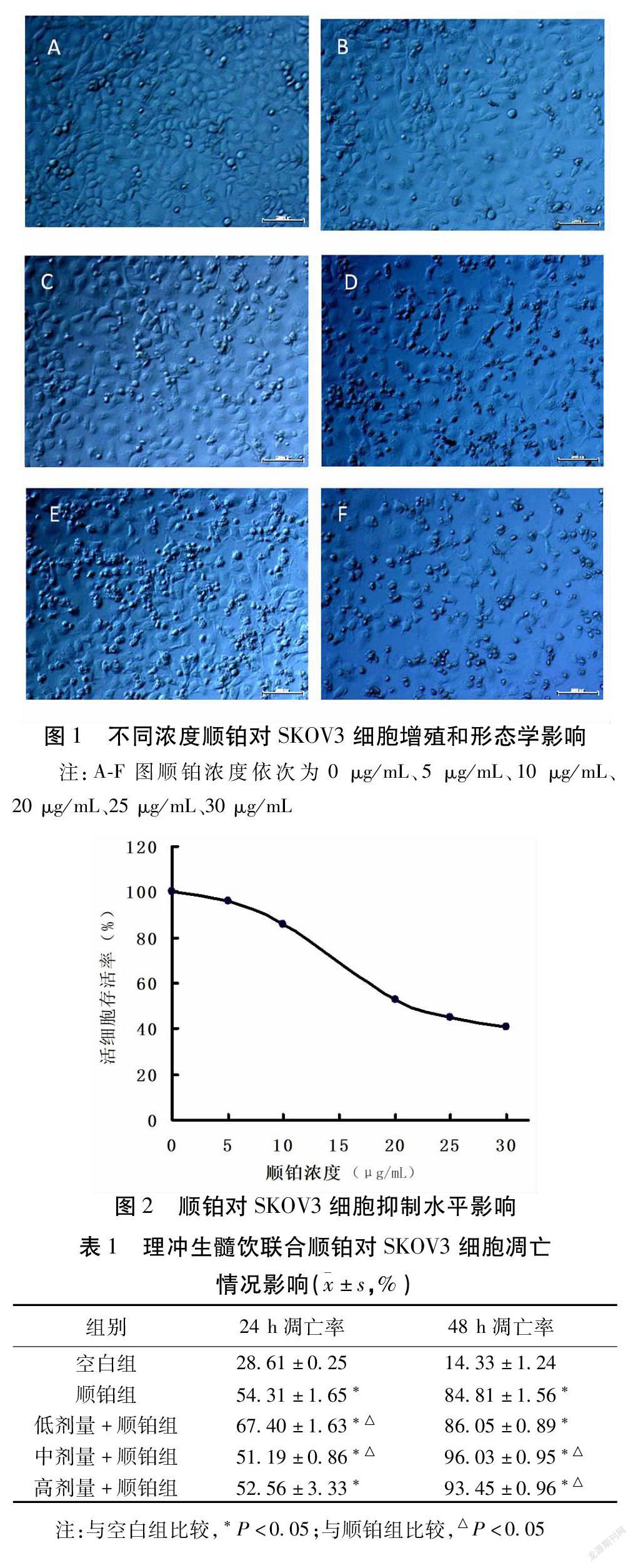
2.1 顺铂对SKOV3细胞增殖抑制作用影响 显微镜下观察不同浓度的顺铂对SKOV3细胞增殖及形态影响,随着顺铂浓度的升高贴壁细胞数量逐渐减少,凋亡细胞呈悬浮状态并且伴有细胞形态的改变。见图1。不同浓度顺铂对SKOV3细胞抑制作用影响,从图中可以看出SKOV3细胞存活率随着顺铂浓度的增加而降低,与顺铂浓度呈负相关,根据曲线进行拟合算出顺铂的IC50值为23.19 μg/mL。见图2。
2.2 理冲生髓饮联合顺铂对SKOV3细胞凋亡影响与空白组比较,药物处理24 h和48 h的顺铂组SKOV3细胞凋亡率明显增加,差异有统计学意义(P<0.05),顺铂联合低剂量组、顺铂联合中剂量组和顺铂联合高剂量组SKOV3细胞凋亡率增加,差异有统计学意义(P<0.05);与顺铂组比较,药物处理24 h的顺铂联合低剂量组、顺铂联合中剂量组SKOV3细胞凋亡率明显增加,差异有统计学意义(P<0.05),顺铂联合高剂量组SKOV3细胞凋亡没有明显变化;药物处理48 h的顺铂联合中剂量组、顺铂联合高剂量组SKOV3细胞凋亡率明显增加,差异有统计学意义(P<0.05),顺铂联合低剂量组SKOV3细胞凋亡没有明顯变化。见表1、图3。
2.3 理冲生髓饮联合顺铂对SKOV3细胞周期影响药物干预24 h的流式细胞术结果显示第1个高峰为G0/G1期、凹谷为S期、第2峰为G2/M期,其显示区域的峰面积的比例就是各周期的比例。与空白组比较,顺铂组中G0/G1期细胞数量有所降低(P<0.05),G2/M期细胞数量有所增加(P>0.05),S期细胞数量明显增加,差异有统计学意义(P<0.05)。与顺铂组比较,理冲生髓饮中、低剂量联合顺铂组中G0/G1期细胞数量明显升高(P<0.05),理冲生髓饮低剂量联合顺铂中G2/M期细胞数量明显降低(P<0.05),理冲生髓饮中剂量联合顺铂组中G2/M期细胞数量略有增加(P>0.05),S期细胞数量明显降低,差异有统计学意义(P<0.05)。理冲生髓饮高剂量联合顺铂组中G0/G1期细胞数量明显降低(P<0.05),S期细胞数量明显升高(P<0.05),G2/M期细胞数量略有增加(P>0.05)。见表2、图4。
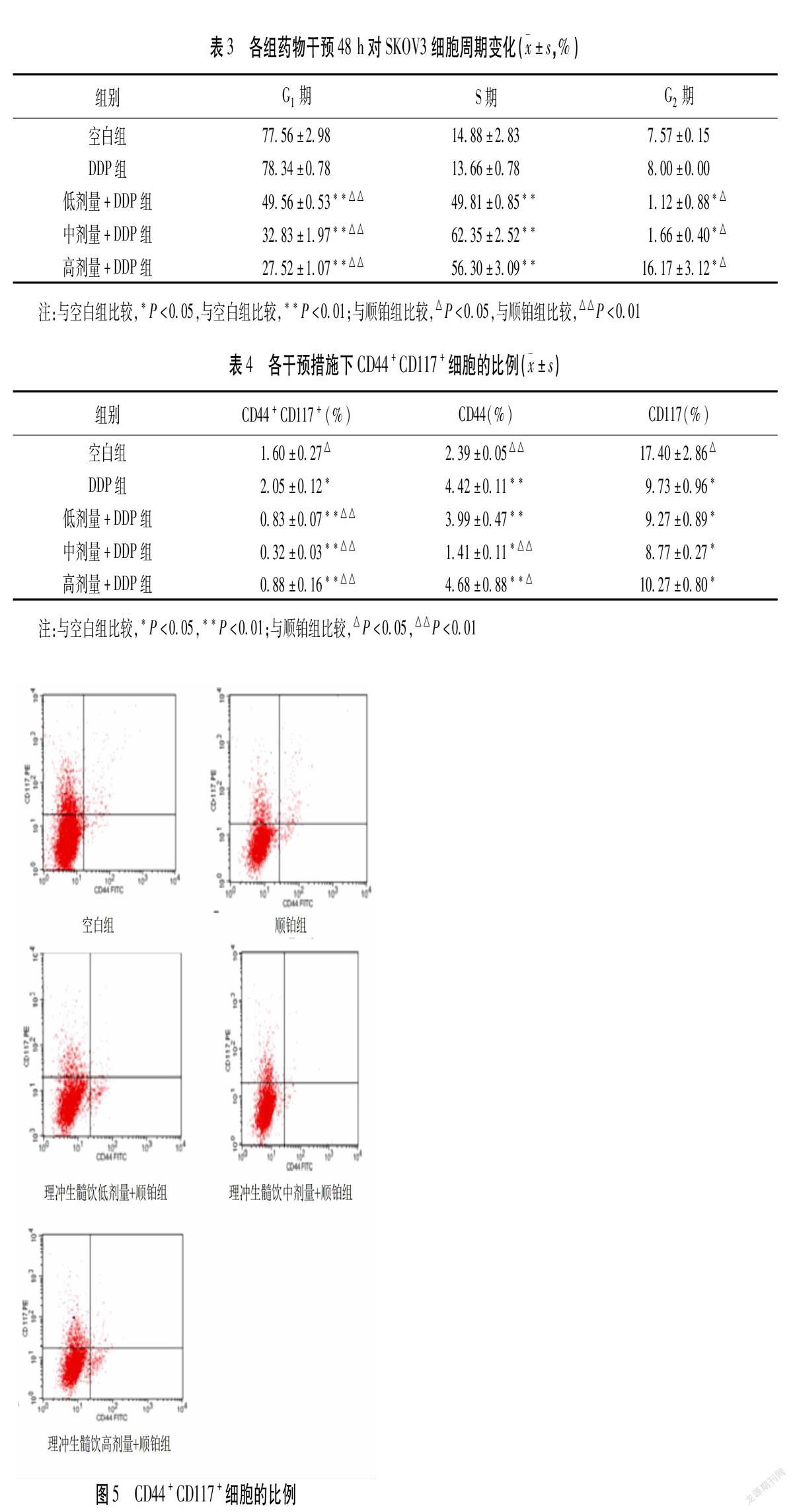
药物干预48 h的流式细胞术结果显示与空白组比较,顺铂组中G0/G1期、G2/M期和S期细胞数量差异无统计学意义(P>0.05)。与顺铂组比较,理冲生髓饮高、中、低剂量联合顺铂组中G0/G1期细胞数量明显降低(P<0.05),S期细胞数量明显升高(P<0.05),理冲生髓饮低、中剂量联合顺铂组中G2/M期细胞数量明显降低(P>0.05),理冲生髓饮高剂量联合顺铂组中G2/M期细胞数量明显升高(P>0.05)。见表3、图4。
2.4 理冲生髓饮联合顺铂对SKOV3细胞中CD44+CD117+细胞比例 CD44+CD117+细胞分布于右上象限,荧光信号越多表明细胞比例越大。与空白组比较,顺铂组中CD44+CD117+细胞数量明显升高(P<0.05),与顺铂组比较,理冲生髓饮低、中、高剂量联合顺铂组中CD44+CD117+细胞数量明显降低,差异有统计学意义(P<0.05)。其中理冲生髓饮中剂量联合顺铂组中CD44+CD117+细胞数量降低最为明显。见表4、图5。
3 讨论
王秀霞教授针对卵巢癌“肾阳虚衰,血瘀于胞”病机以及“久病入于络”,确立“温煦肾阳,搜剔胞络瘀滞”的治疗原则,反复推敲确立理冲生髓饮组方。理冲生髓饮组方由人参、鹿茸、黄芪、淫羊藿、水蛭、莪术、三棱、浙贝母组成,其中三棱、莪术为君药。从药物作用来说,张寿甫老先生认为“三棱、莪术性近和平,而以治女子瘀血,虽坚如铁石亦能徐徐消除,而猛烈开破之品转不能建此奇功,此三棱、莪术独具之良能也”,“……若与参、术、耆诸药并用大能开胃进食,调血和血”[6]。三棱、莪术不仅能消癥,且配合人参、黄芪可改善卵巢癌患者食欲不振情况,提高机体免疫力[7];水蛭破瘀血而不伤新血,《本经》曰:“水蛭最善食人之血,而性又迟缓善入。迟缓则生血不伤,善入则坚积易破,借其力以消既久之滞,自有利而无害也”,可搜剔胞络之瘀滞;浙贝母软坚散结;人参、鹿角霜、黄芪、淫羊藿益气温阳补肾,提高机体免疫力[8-9]。卵巢癌发病属正虚邪实,过用攻伐恐犯虚虚之戒,缓攻缓消,攻补兼施,寓补于攻,寓攻于补,方能奏效,基于此理冲生髓饮全方药物性温或平,味多甘辛苦,共奏温煦肾阳、流行脉络、搜剔胞络瘀滞之功效。
细胞周期是细胞生命活动的基本过程,它控制着细胞从静止期向生长增殖期转化。哺乳动物的细胞生长和分裂周期分为4个阶段,即G1期、S期、G2期、M期,在细胞周期过程中通过细胞周期检测点来保证细胞周期事件忠实性及按序完成[10],肿瘤是在环境因素和遗传因素共同作用下引起的细胞周期紊乱、细胞失控性生长的一类疾病,失控性生长是各种肿瘤共同的生物学特征,其主要分子机制是细胞周期紊乱导致细胞增殖过多和凋亡过少[11-12],其中S期的DNA合成和G2/M期的细胞有丝分裂对维持肿瘤细胞的恶性增殖尤为重要。本实验结果发现理冲生髓饮有效组分联合顺铂可显著提高SKOV3细胞的凋亡率,在顺铂作用下,SKOV3细胞细胞周期主要分布于G1期,理冲生髓饮有效组分中剂量联合顺铂干预48 h时G1期细胞减少、S期细胞增多,总凋亡率可达96.03%,而顺铂组总凋亡率仅为84.81%,作用最为显著。理冲生髓饮联合顺铂可以通过提高S期细胞比例,增加细胞凋亡,促进顺铂的抗肿瘤作用,该研究结果与刘念的研究结果相似[13]。
CD44+CD117+细胞是由CD44和CD177共同结合来标记卵巢癌干细胞[14]。CD44是透明质酸受体,与细胞迁移有关,是乳腺癌、前列腺癌、结直肠癌、胰腺癌等恶性肿瘤的干细胞标记物[15];CD117也被称为c-kit,是酪氨酸激酶Ⅲ型受体,被认为是干细胞因子受体,且具有抗凋亡作用。CD44+CD117+细胞对顺铂具有耐药性,且100个CD44+CD117+细胞就可在体内形成肿瘤[16]。研究表明,降低CD44+CD117+细胞的比例可减轻肿瘤进展、增强顺铂敏感性[17-18]。本研究应用理冲生髓饮干预卵巢癌SKOV3细胞,24 h后发现顺铂对CD44+CD117+细胞具有富集作用,顺铂作用下CD44+CD117+细胞比例明显高于空白组,理冲生髓饮中剂量联合顺铂降低CD44+CD117+细胞比例作用最为明显。该结果表明理冲生髓饮能够降低顺铂对卵巢癌干细胞的富集作用,靶向降低卵巢癌干细胞CD44+CD117+比例,通过对卵巢癌干细胞的靶向作用达到治疗卵巢癌的目的。综上所述,理冲生髓饮联合顺铂能够增加卵巢癌SKOV3细胞凋亡,影响调控细胞周期,降低CD44+CD117+细胞数量,进而增加抗肿瘤作用及逆转多药耐药。
参考文献
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Eisenhauer EA,Vermorken JB,van Glabbeke M.Predictors of response to subsequent chemotherapy in platinum pretreated ovarian cancer:a multivariate analysis of 704 patients[J].Ann Oncol,1997,8(10):963-968.
[3]Meinhold-Heerlein I,Hauptmann S.The heterogeneity of ovarian cancer[J].Arch Gynecol Obstet,2014,289(2):237-239.
[4]于风胜,李艺,崔恒.卵巢癌干细胞及卵巢癌治疗[J].中国实用妇科与产科杂志,2014,30(1):14-17.
[5]王文静,吴韶飞,郭飘婷,等.熊果酸对卵巢癌干细胞荷瘤裸鼠耐药的逆转作用[J].上海中医药杂志,2016,50(5):70-76.
[6]张锡纯.医学衷中参西录·下册[M].北京:人民卫生出版社,2006:120.
[7]程堃.理冲生髓饮对卵巢癌术后化疗患者减毒增效作用的临床研究[D].哈尔滨:黑龙江中医药大学,2010.
[8]辛宇,邱智东,董金香,等.中药治疗卵巢癌研究进展[J].世界最新医学信息文摘,2018,18(21):21-22.
[9]郝悦,张新.中医药治疗卵巢癌研究进展[J].实用中医内科杂志,2011,25(7):35-36.
[10]Funk JO,Kind P.Cell cycle control,genetic instability and cancer[J].Hautarzt,1997,48(3):157-165.
[11]Otto T,Sicinski P.Cell cycle proteins as promising targets in cancer therapy[J].Nat Rev Cancer,2017,17(2):93-115.
[12]曹亞.细胞周期与肿瘤[J].国外医学:生理、病理科学与临床分册,2002,22(2):103-105.
[13]刘念,江彩霞,刘力,等.黄连素对人卵巢癌细胞增殖和凋亡的影响[J].中国妇幼保健,2018,33(4):911-914.
[14]Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311-4320.
[15]Burgos-Ojeda D,Rueda BR,Buckanovich RJ.Ovarian cancer stem cell markers:prognostic and therapeutic implications[J].Cancer Lett,2012,322(1):1-7.
[16]Ffrench B,Gasch C,O′Leary JJ,et al.Developing ovarian cancer stem cell models:laying the pipeline from discovery to clinical intervention[J].Mol Cancer,2014,13:262.
[17]Amy PN Skubitza,Elizabeth P Taras,Kristin LM Boylan,et al.Targeting CD133 in an in vivo ovarian cancer model reduces ovarian cancer progression[J].Gynecol Oncol,2013,130(3):579-587.
[18]Zhang R,Zhang P,Wang H,et al.Inhibitory effects of metformin at low concentration on epithelial-mesenchymal transition of CD44+CD117+ovarian cancer stem cells[J].Stem Cell Res Ther,2015,6:262.
(2018-11-01收稿 责任编辑:王明)

