基于新一代测序技术的易栓症基因检测Panel的建立及其在中国静脉血栓患者遗传背景研究中的临床应用
李 蕾, 吴 希, 许冠群, 梁 茜, 戴 菁, 武文漫, 丁秋兰, 王鸿利, 王学锋,3
(1.上海交通大学医学院附属瑞金医院 医学基因组国家重点实验室 上海血液学研究所,上海 200025;2.上海交通大学医学院附属瑞金医院检验科,上海 200025;3.上海交通大学医学院检验系,上海 200025)
易栓症是指由于遗传性或获得性原因导致机体容易发生血栓的一种病理生理过程,临床上以静脉血栓(venous thromboembolism,VTE)更为多见,如下肢深静脉血栓、肺栓塞等[1]。遗传性易栓症占易栓症的30%~50%,其中的抗凝血酶(antithrombin,AT)、蛋白 C(protein C,PC)和蛋白 S(protein S,PS)缺陷是我国VTE人群最主要的遗传性危险因素[2-4],此外,编码凝血因子、纤溶蛋白、富组氨酸糖蛋白等的基因发生突变也可能会引起易栓倾向[5-8]。由于遗传性危险因素携带终生,对其进行明确诊断对患者及其家系成员有效的抗凝治疗及VTE预防具有重要意义。
传统的遗传性易栓症诊断主要依赖表型检测,当表型检测结果异常时,再针对相关基因进行以一代测序技术为基础的基因检测,寻找是否存在致病突变。然而,表型诊断有诸多局限性,如只能检测血浆中的蛋白成分,当患者处于血栓急性期或口服抗凝药物期间会影响检测结果的准确性,且表型检测由于方法学上的局限性,很难反映被检蛋白的全部情况[1],且有些VTE发生相关的蛋白尚无有意义的表型检测方法,如血栓调节蛋白、内皮细胞PC受体、肝素辅因子Ⅱ等[9-11]。目前,不断有新的遗传性血栓危险因素被报道[12],基因拷贝数变异(copy number variation,CNV)也被证实与血栓的发生密切相关[13-14],这提示传统的遗传性易栓症诊断方式已无法满足现阶段的临床诊断需求。
新一代测序技术的发展为易栓症遗传背景检测打开了新的局面,实现了同时对多个基因或目的区域进行快速有效地基因检测。上海交通大学医学院附属瑞金医院设计了适用于我国VTE患者的易栓症基因检测Panel,共包含了18种与血栓发生相关的候选基因,采用二代测序和CNVplex®技术对基因的编码区和调控区进行点突变、小缺失或插入及CNV的检测,结合生物信息学手段对测序结果进行深度分析,进而确定相关基因的变异情况。本研究利用该Panel对前期收集的VTE患者进行了基因检测,不仅验证了该Panel应用于临床诊断的可行性,同时调查了我国VTE患者的遗传背景。
资料与方法
一、临床资料
收集2015年1月至2018年6月期间就诊于上海交通大学医学院附属瑞金医院血栓与止血门诊、并经影像学方法检测(多普勒超声、静脉造影及肺动脉CT等)确诊患有VTE的患者[3],这些患者来自我国各地,以华东和华南地区为主,绝大多数为汉族人,通过对其病史、家族史等进行评估,筛选出发病年龄<50岁或复发型VTE或罕见部位(上肢深静脉血栓、浅静脉血栓、颅内静脉窦血栓及门静脉系统血栓等)的VTE患者,同时排除处于肿瘤活动期的患者,最终本研究共纳入246例VTE患者。
二、方法
1.易栓症的表型检测:采集患者的静脉血,置于 1∶9抗凝的枸橼酸钠抗凝管中,2 000×g离心15 min分离血浆和血细胞。采用ACL-TOP全自动血凝仪(IL公司,美国)对患者血浆中的凝血因子、抗凝蛋白、纤溶蛋白及狼疮抗凝物进行检测,其中凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅺ、Ⅻ及 PS活性采用凝固法测定;血管性血友病因子抗原及活性测定采用免疫比浊法,AT、PC和纤溶酶原活性采用发色底物法测定;狼疮抗凝物采用稀释的蝰蛇毒时间法测定;抗心磷脂抗体和抗β2糖蛋白Ⅰ采用酶联免疫吸附法测定。
2.易栓症基因检测Panel:遗传性易栓症可由多种基因突变导致。本研究主要检测VTE患者的抗凝蛋白、凝血因子及纤溶相关蛋白等是否存在基因突变导致其功能障碍。根据目前已知的文献报道[15],全基因组关联分析证实有17种基因与静脉血栓发生相关;本研究又通过在人类孟德尔遗传学数据库 (Online Mendelian Inheritance in Man,OMIM)中检索“thrombophilia”、“venous thromboembolism”及“deep venous thrombosis”等关键词,最终遴选出18种与易栓症或静脉血栓发生相关的基因,组成了易栓症基因检测Panel(见表1)。突变筛查涉及到2种高通量检测技术,其中点突变或小缺失/插入的检测使用以新一代测序为基础的目的区域富集测序技术,而CNV的检测采用CNVplex®高通量拷贝数检测技术。
(1)多重目的区域富集测序及分析:采用Fast-TargetTM富集技术(天昊生物科技,上海),针对18种基因的启动子区域、5′和3′非编码区、编码区、剪切位点附近序列设计多重PCR扩增体系,富集目的片段;再利用Illumina Hiseq测序仪 (Illumina,美国)的2×150 bp测序模式对目的片段进行双向测序验证;最后,通过生物信息学手段对测序结果进行测序深度分析[16]。在检出的基因变异中,先去除在dbSNP135数据库中有记录或在千人基因组项目里面我国汉族人群中的频率≥1%的单核苷酸变异;然后采用 PolyPhen-2、SIFT和MutationTaster软件对非同义单核苷酸变异的功能进行预测,如果2个及以上软件认为突变具有致病性,即将该突变归为致病突变;剪切位点突变采用Alamut v2.7对正常剪切的影响进行预测,如果2个及以上软件认为突变具有致病性,则将其归为致病突变;最后,筛选出的突变通过一代测序进行验证,进而确定样品中易栓症相关基因的外显子、剪切点区域、转录调控区的点突变变异情况。
(2)CNVplex®高通量拷贝数检测:采用CNVplex®高通量拷贝数检测技术(天昊生物科技,上海)对上述18种基因的目的区域进行高通量CNV检测。首先,采用连接酶高特异性连接反应对上述目的区域进行杂交、连接,通过在连接探针末段引入不同长度的标签序列获得长度各异的目的探针连接产物,利用荧光标记的通用引物对连接产物进行PCR扩增,通过荧光毛细管电泳对扩增产物进行电泳分离检测,最后通过对电泳图谱的分析获取各个位点的峰高,进而对样品目的区域的拷贝数进行分析确定。
3.生物学意义分析:参考美国医学遗传学与基因组学学会对基因变异致病性的分类标准[17],已有文献报道与VTE发病有关的突变定义为“致血栓”的突变;新的点突变、剪切位点突变,结合软件预测结果及表型结果,显示相关蛋白功能异常且与VTE相关时,可将其归类为“致血栓”的突变。其他与VTE无明确相关性的基因变异定义为“致病性不明确”的变异。
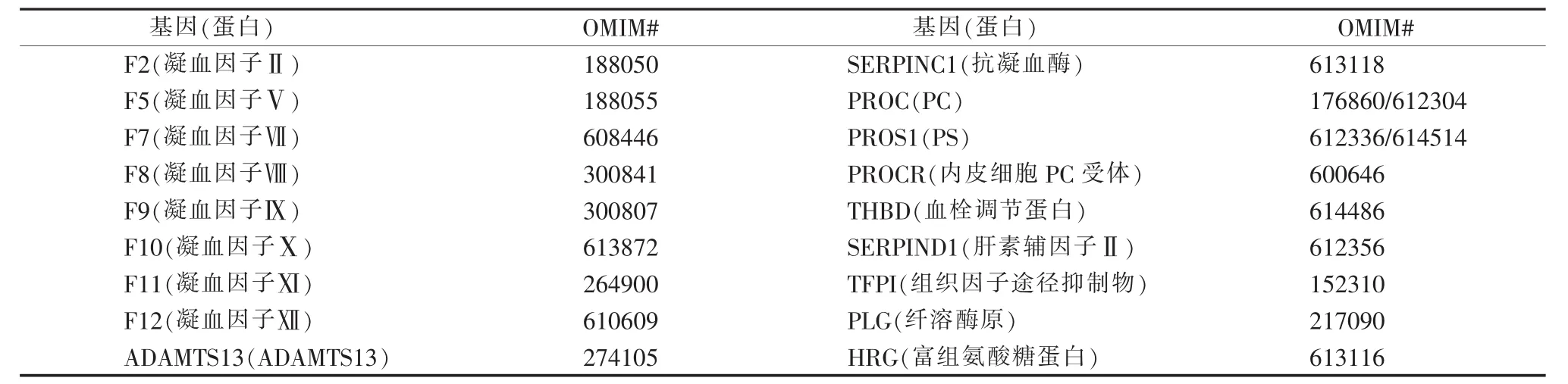
表1 易栓症基因检测Panel包含的18种基因
结 果
一、对象的基本资料
本研究纳入246例VTE患者,男性173例,女性 73例,首次发病年龄为(34.3±13.2)岁。 46.3%(114/246)的患者曾反复发生VTE,约25%的患者伴有获得性血栓危险因素,如抗磷脂综合征、外科手术、长期卧床或妊娠等。
二、筛查对象的基因检测结果
经易栓症基因检测 Panel发现,64.6%(159/246)的患者携带基因突变,其他87例患者未检测到突变。在携带突变的患者中,69.2%(110/159)携带单一基因突变,13.2%(21/159)携带单基因的复合杂合突变,17.6%(28/159)携带2种及以上的基因突变 (见图1)。根据突变类型分类,88%(140/159)的患者仅携带点突变、小缺失或插入,5.7%(9/159)的患者仅携带基因拷贝数变异,另外6.3%(10/159)的患者两者均携带。
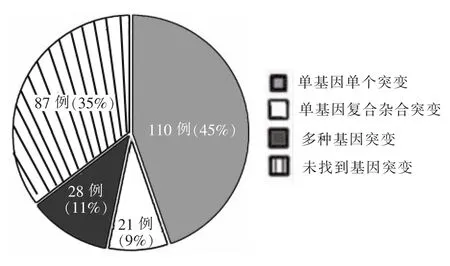
图1 246例静脉血栓栓塞患者的易栓症基因检测Panel结果
本研究建立的易栓症基因检测Panel中,有6种基 因 (PROCR、THBD、SERPIND1、TFPI、HRG 和ADAMTS13)目前尚缺乏有意义的表型指标,只能通过基因检测、生物信息学分析及体外实验对其功能进行分析。其次,有72例患者因处于血栓急性期或口服抗凝药物期间,无法进行表型检测,经易栓症基因检测Panel分析发现,其中32例患者携带致病性基因突变。另有56例患者的实验室表型检测结果均为正常,而易栓症基因检测Panel结果显示其中20例患者携带致病性基因突变。
1.携带单基因单个突变患者的表型及基因检测结果:本研究中共有110例患者携带单一基因突变,平均年龄为(33.7±12.6)岁,其中半数的患者曾多次发生VTE,四分之一的患者合并获得性血栓危险因素,如抗磷脂综合征、妊娠或外科手术等。如表2所示,96例患者携带抗凝蛋白突变,其中90例患者携带点突变、小缺失或插入,6例患者携带基因拷贝数变异。抗凝蛋白突变中有31个突变为首次发现,经表型验证均为致血栓性突变。另外,有5例患者携带凝血因子突变,其中有1例年轻男性患者,反复发生VTE,家族史阳性,但易栓症表型检测均未发现异常,经易栓症基因Panel检测发现其携带F2基因Arg596Gln突变 (已有研究表明该突变导致抗凝血酶抵抗,是VTE的严重危险因素[18-19])。还有一例14岁的VTE患者携带F9基因Arg384Gln突变 (体外研究表明该突变导致凝血因子Ⅸ活性显著升高,为VTE的危险因素之一)。此外,还有2例F5突变、1例F12突变、4例PROCR突变、2例THBD突变、2例SERPIND1突变和1例PLG突变的致病性需要进一步行功能性实验以验证。
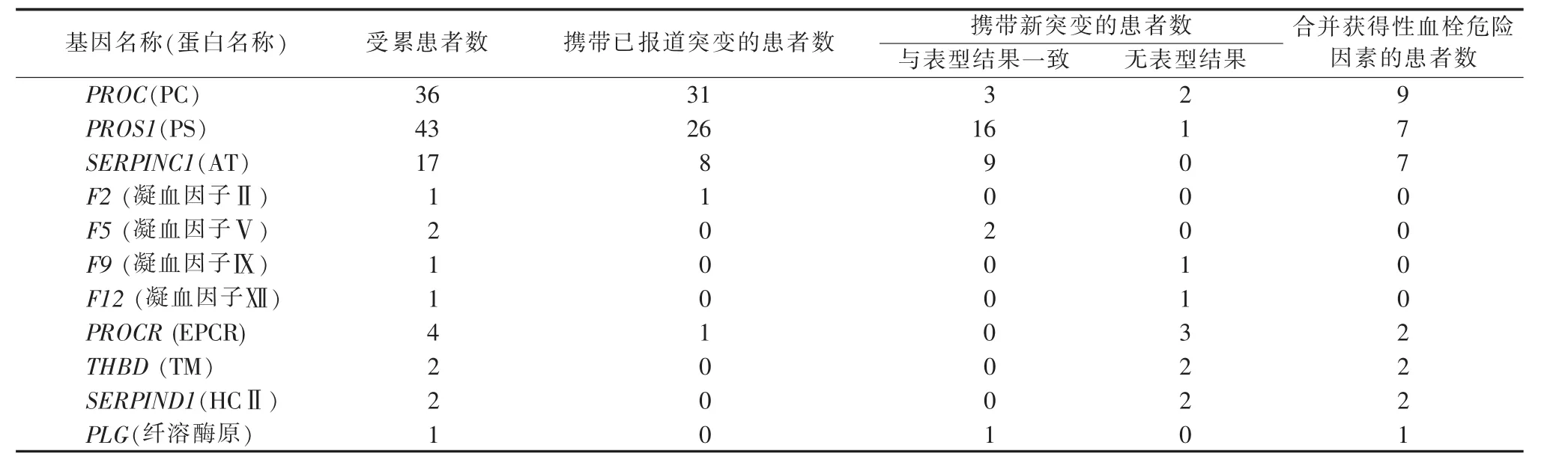
表2 携带单基因单个突变患者的表型及基因检测结果(n)
2.携带单基因复合杂合突变患者的表型及基因检测结果:本研究中有21例患者携带单基因复合杂合突变(见表 3),首次发病年龄为(31.4±11.5)岁,81%的患者曾发生无明显诱因的VTE事件,57%的患者曾反复发生VTE。有17例患者为PROC复合杂合突变,PC活性在15%至90%之间,其中有14例患者携带中国人群的PROC热点突变 (R189W或K192del)。另外,有4例患者携带PROS1复合杂合突变,PS活性显著下降 (18%~38%),其中3例携带中国人群的PS热点突变(E67A或R561W)。在这21例患者中,共有11例患者携带新的基因突变,包括8种PROC新突变和3种PROS1新突变,通过对患者家系中携带相同突变的成员进行表型验证后证实,以上新突变均会导致受累者的PC或PS活性下降,为致血栓性突变。家系调查显示,以上患者所携带的复合杂合突变均来源于其父母。
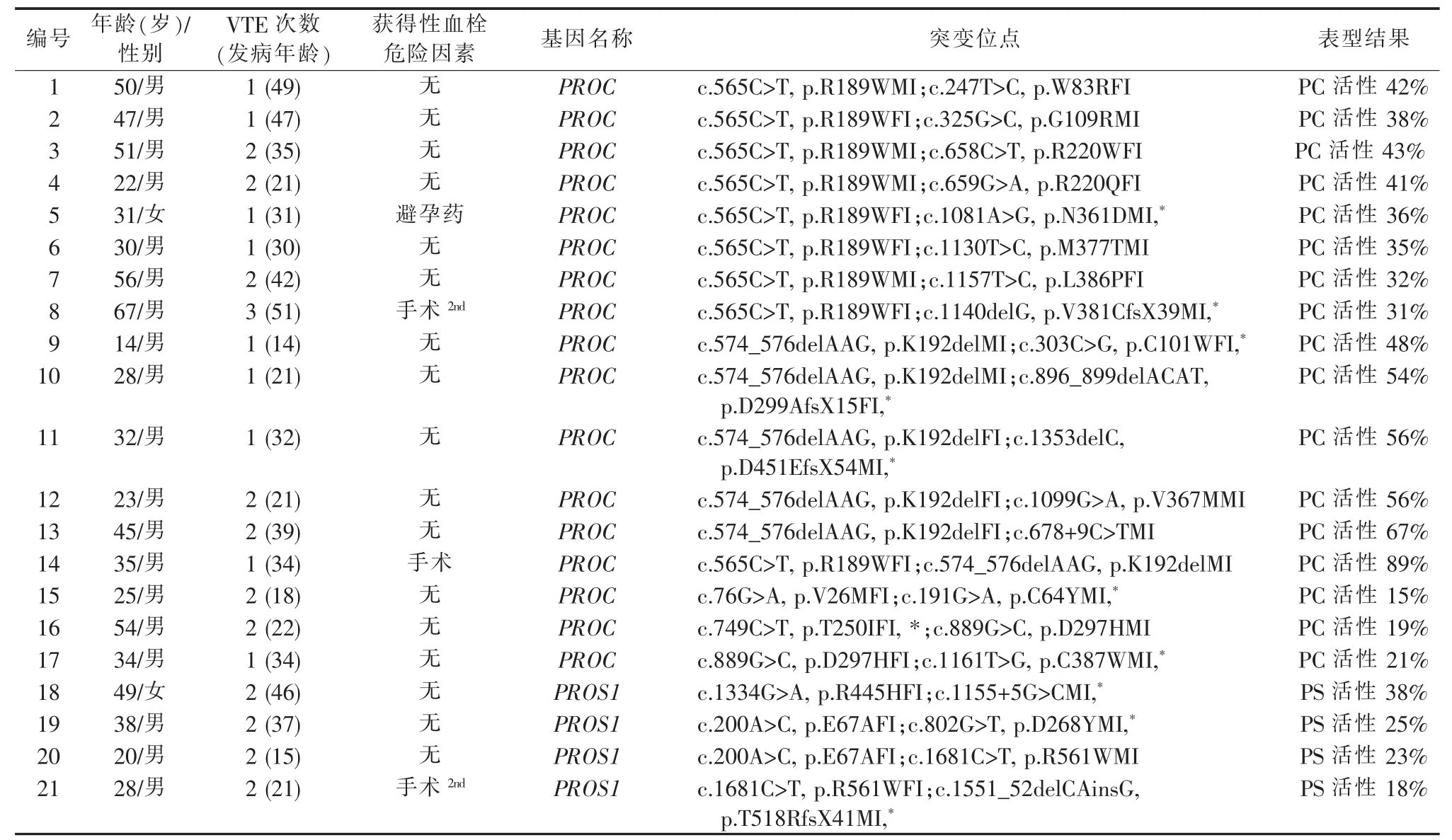
表3 携带单基因复合杂合突变患者的表型及基因检测结果
3.携带多种基因突变患者的表型及基因检测结果:本研究建立的易栓症基因检测Panel的结果显示,共有28例患者携带多种基因的突变,首次发病年龄为 (32.0±13.3)岁。16例患者曾反复发生VTE,其中6例伴有获得性血栓危险因素。在这些患者中,抗凝蛋白联合缺陷最为常见(11/28),其中PROC合并PROS1突变的比例最高(7/28),受累患者的PS活性均显著降低,但有5例患者的PC活性处于正常水平。其次,有3例患者同时携带SERPINC1和PROC突变,1例患者携带SERPINC1合并PROS1突变,除了SERPINC1新突变Met313Thr致病性尚不明确,其他突变均为致血栓性突变。另有10例抗凝蛋白缺陷患者携带合并PROCR突变,抗凝蛋白的表型检测证实所有突变均为致病性突变,但PROCR突变(Pro145Leu和1~3号外显子重复)的致病性仍需进一步实验验证。除此之外,有1例PC缺陷患者合并PLG基因1~2号外显子杂合缺失,该突变导致PLG活性降至正常水平的50%。另有1例男性患者同时携带PROC纯合突变(c.-148T>C)、F12 纯合突变(Gly473Arg)和F2杂合子突变(His479Arg),PROC突变导致其PC活性严重降低,仅为正常水平的14%,凝血因子Ⅻ和Ⅱ的活性分别为15%和75%。此外,有4例患者携带抗凝蛋白缺陷合并THBD、TFPI或ADAMTS13等新突变,这些突变的致病性需要进一步行功能性实验以验证。
4.未找到基因突变的患者:本研究纳入246例VTE患者中,有87例患者未找到基因突变(结果未显示)。患者的首次发病年龄为(36.53±14.15)岁,其中,35.6%(31/87)的患者曾反复发生VTE。21例患者的VTE发生有明显诱因,其中7例患者的狼疮抗凝物或抗心磷脂抗体呈阳性,其他诱因包括外科手术、长期卧床或妊娠等。
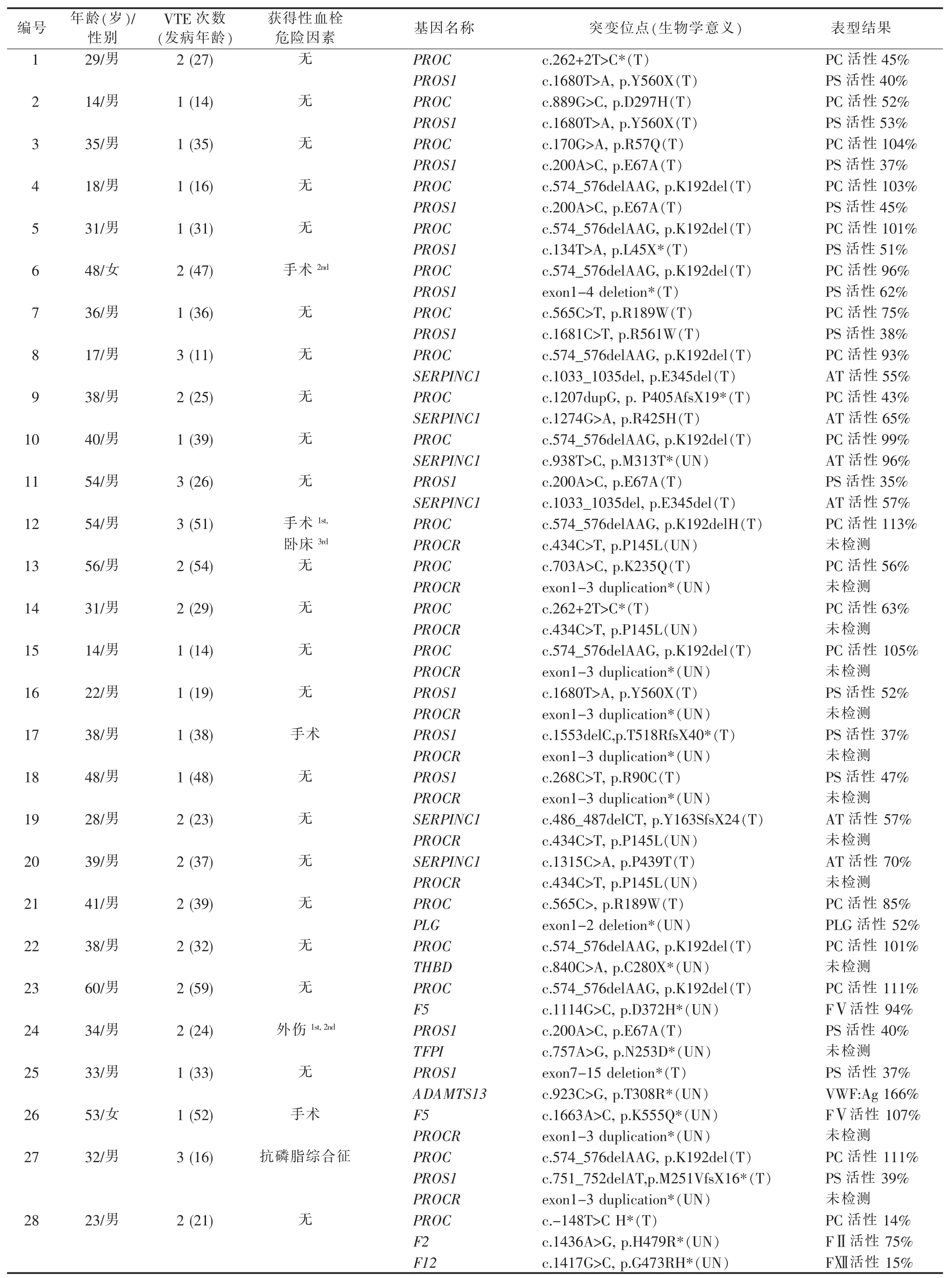
表4 携带多种基因突变患者的表型及基因检测结果
讨 论
一、易栓症的基因检测适用人群
易栓症的临床检测指南建议,易栓症的遗传性危险因素检测应在临床医师的建议下有选择性地进行,如当患者反复发生VTE、有VTE家族史或患者年龄较小且为无明显诱因下发生VTE才应进行遗传筛查;而对于有明显诱因或仅发生单次VTE的患者,可以不进行遗传筛查[20-21]。然而,本研究通过评估患者病史,筛选出年轻时发生VTE及反复VTE的患者进行遗传筛查,对是否合并诱发因素及家族史没有严格要求,而基因检测结果显示,在61例存在获得性血栓危险因素(抗磷脂综合征、手术或妊娠等)的患者中有40例患者携带遗传性血栓危险因素,提示对存在获得性危险因素的患者进行遗传分析也同样有必要的。严格的入组标准可以提高突变检出率,但也会造成部分患者漏诊,这应该引起临床医师及检验人员的高度重视,并在实践中进一步探讨基因诊断的筛选标准。
二、易栓症的测序检测
随着新一代测序技术的普及和测序成本的降低,部分实验室开始采用全基因组测序或全外显子测序进行易栓症基因检测,而这些测序方法会得到海量信息,对其分析的过程复杂而繁琐。本研究的易栓症基因检测Panel精选了18种与中国人群VTE发生相关的基因,检测针对性更强,准确率更高,成本更低。发现基因变异的患者,待其VTE急性期或治疗结束后1个月后进行表型检测,或者对其携带相同突变的家系成员进行表型检测以确定基因变异的致病性。易栓症的基因诊断结合表型诊断,为明确血栓病因提供了科学证据,也为临床制订个体化抗凝措施提供了理论依据,为先证者家族成员提供早期诊断和临床前预防依据。
本研究通过易栓症基因Panel检测对246例VTE患者进行筛查后发现,有31例患者携带抗凝蛋白以外的基因突变,19例患者携带易栓症基因的拷贝数变异,这些突变在传统的血栓筛查很难被检测出来。如有1例男性患者从25岁开始反复发生VTE,其家族史阳性,但易栓症表型检测及抗凝蛋白一代测序均未发现异常,经易栓症基因Panel检测,发现其携带F2基因Arg596Gln突变,该突变是VTE的严重危险因素[18-19]。另外,有28例患者被检出携带多个基因的突变,携带多个抗凝蛋白突变的患者一般比携带单个抗凝蛋白突变的患者的临床症状更为严重,而一些患者携带多个突变可能减轻血栓的严重程度。如本研究中有1例男性患者同时携带PROC纯合突变、F12纯合突变和F2杂合子突变。通常来说,纯合的PC缺陷很有可能是致命的,通常在新生儿期就会出现广泛的VTE或暴发性紫癜,然而该患者的PC活性虽然仅为15%,但其在23岁才第一次发生VTE,这可能是因为F12和F2的突变导致凝血因子Ⅻ和Ⅱ活性降低,削弱了患者的凝血功能,从而减弱了PC活性明显降低引起的血栓形成效应。以上结果表明,本研究建立的易栓症基因检测Panel对筛选VTE患者的遗传风险因素是灵敏且有效的,可使VTE的基因检测更加全面。
在87例未找到基因突变的患者中,有9例患者曾发生3次及3次以上VTE,有5例患者有VTE家族史,本研究仍怀疑这些患者是否有遗传性血栓危险因素。目前,本研究对易栓症基因检测Panel进行了补充,新增了17种基因,涉及纤维蛋白原异常、血管性血友病、骨髓增殖性疾病、血小板功能亢进等,将对未找到突变的患者进一步进行筛查。
总之,上海交通大学医学院附属瑞金医院开发的易栓症基因检测Panel可以更加快速、准确且有效地对遗传性血栓危险因素进行筛查。临床可根据基因检测结果,预判遗传风险的大小,为患者制定相应的预防治疗方案和疗程,预防血栓的发生或复发,减少血栓后综合征的发生,值得在临床上广泛推广及应用。

