大黄鱼鱼卵油溶剂提取法的比较及其品质分析
张 敏, 魏 微, 陆晓丹, 张玲云, 杜艳瑜, 李淑卿, 梁 鹏,2, 程文健,2, 陈丽娇,2
(1.福建农林大学食品科学学院;2.福建农林大学海洋研究院,福建 福州 350002)
大黄鱼(Pseudosciaenacrocea)又名黄鱼、大王鱼和黄瓜鱼,是我国近海的主要经济鱼类,因其肉质细嫩鲜美及较高的营养价值,深受消费者的喜爱.2017年中国渔业统计年鉴显示,养殖的大黄鱼产量达到16.5万t,仅福建省就高达14.6万t,占全国产量的88.53%[1].现阶段对大黄鱼加工利用的研究主要集中在冷冻及其干制品上,然而,在加工过程中会产生大量的鱼卵,目前对大黄鱼鱼卵资源高值化的利用水平仍然较低,甚至被当作废弃物丢弃,造成极大的资源浪费[2].
海水鱼鱼卵中富含的多种长链多不饱和脂肪酸(poly unsaturated fatty acids, PUFA)具有重要的生理活性功能,可以防治心血管疾病[3].本课题组前期研究表明,大黄鱼鱼卵含有丰富的脂质,总脂肪含量高达44%(以干基计),总脂质中的磷脂含量占总脂的比例为61.2%,且磷脂Sn-2位主要为n-3 PUFA,其二十碳五烯酸(eicosapentaenoic acid, EPA)含量和二十二碳六烯酸(docosahexaenoic acid, DHA)含量之和达到了25.5%[4],说明大黄鱼鱼卵资源可作为获得n-3 PUFA的重要来源.
目前,海洋鱼油的提取方法主要有蒸煮法[5]、酶解法[6]、超临界CO2流体法[7]和化学溶剂提取法[8]等.其中,化学溶剂法是传统的油脂提取方法,这是因为有机溶剂会破坏脂肪细胞和蛋白质结构以释放油脂.使用化学溶剂提取油脂时,要根据所提脂肪的极性大小选择合适的有机溶剂[9].氯仿—甲醇体系通过混合极性和非极性溶剂来提高油脂得率[10],此方法最早由Folch(1957)创建,经Blight和Dyer(1959)改进,简称B&D法[11],具有良好的提取效果.鱼油因富含n-3 PUFA,容易受氧气、光照、温度及金属离子等影响发生氧化反应致使鱼油品质发生劣变,产生不可接受的哈败味,影响鱼油的食用营养价值.通过检测过氧化值、游离脂肪酸含量、硫代巴比妥酸值及脂肪酸组成等指标可以评价油脂的品质特性[12-14].
截至目前,尚未见采用不同溶剂对大黄鱼鱼卵油提取效果的比较及其品质分析的相关报道.本试验结合前期相关的文献报道,选取6种溶剂(正己烷、环己烷、异丙醇、乙酸乙酯、95%乙醇、氯仿—甲醇)提取大黄鱼鱼卵油,探讨不同溶剂的提取效果,并通过检测鱼卵油的过氧化值、游离脂肪酸含量、硫代巴比妥酸值及脂肪酸组成等指标分析鱼卵油品质,旨在为大黄鱼鱼卵资源的高值化利用提供依据.
1 材料与方法
1.1 材料
1.1.1 原料与试剂 新鲜大黄鱼鱼卵由福建岳海水产食品有限公司馈赠;37种脂肪酸混合标准品购自美国Sigma公司;内标十九烷酸甲酯购自美国Sigma公司;正己烷、环己烷、异丙醇、乙酸乙酯、95%乙醇、氯仿和甲醇均为分析纯,购自国药集团上海化学试剂公司.
1.1.2 仪器与设备 仪器与设备有LGJ-12S真空冷冻干燥器(北京松源华兴科技发展有限公司)、SQP电子天平[赛多利斯科学仪器(北京)有限公司]、RE-52AA旋转蒸发器(上海亚荣生化仪器厂)、JJ-1精密增力电动搅拌器(常州普天仪器制造有限公司)、UV-1601紫外分光光度计(北京瑞利分析仪器有限公司)和Agilent 7890A气相色谱仪(美国Agilent公司)
1.2 试验设计
采用经典的B&D法作为溶剂法提取鱼油的参考标准[15-16],设置氯仿—甲醇混合溶剂中氯仿与甲醇的体积比为1∶1,按照1∶6的料液比对大黄鱼鱼卵油进行提取,其他溶剂法的料液比设置为1∶12[17].准确称取一定量的冻干大黄鱼鱼卵,加入相应溶剂,室温下高速搅拌2 h,过滤得到滤液,重复3次后合并上清液旋蒸除去溶剂,按下式计算脂质得率:脂质得率/%=提取得到的油脂质量(g)/称取的鱼卵质量(g)×100.
1.3 鱼卵油品质指标的测定
1.3.1 磷脂含量的测定 按照GB/T 5537—2008[18]的钼蓝比色法测定磷脂含量.
磷标准曲线的绘制:分别取磷标准溶液0、1、2、4、6、8 mL,依次加水10、9、8、6、4、2 mL,再加入8 mL 0.015%硫酸联氨、2 mL 2.5%钼酸钠,振摇混匀,沸水浴10 min后冷却至室温.用水稀释至刻度,摇匀,静置10 min,在650 nm波长处测定光密度(D).以测出的D对磷含量绘制标准曲线,得到回归方程:y=5.593 9x-0.012 7(r2=0.993 2).式中:y为D650 nm;x为含磷量(mg).
试液的制备:取油样3.0~3.2 g(精确至0.001 g),加0.5 g氧化锌,在电炉上炭化完毕后,送至马弗炉(550~600 ℃)中灼烧至完全灰化(白色),时间约2 h.取出冷却至室温,用10 mL盐酸(浓盐酸与水的体积比为1∶1)溶解灰分并加热至微沸,5 min后停止加热,待溶解液的温度降至室温,过滤注入100 mL容量瓶中,每次用大约5 mL的热水冲洗坩埚和滤纸,共3~4次,冷却到室温.用50%氢氧化钾中和至出现混浊,缓慢滴加盐酸(浓盐酸与水的体积比为1∶1)使氧化锌沉淀全部溶解,再滴加2滴,最后用水稀释定容至刻度,摇匀.同时制备一份空白样品.
样品测定:吸取10 mL上述试液,加入8 mL 0.015%硫酸联氨、2 mL 2.5%钼酸钠,加塞振摇混匀,沸水浴10 min后冷却至室温.加水稀释至刻度,摇匀,静置10 min,在650 nm波长处测定D.按下式计算磷脂含量:X=P/m×V1/V2×26.31.式中:X为磷脂含量(%);P为在标准曲线上查得的被测液的含磷量(mg);m为试样质量(g);V1为样品灰化后稀释的体积(mL);V2为测定时所取被测液的体积(mL);26.31为每毫克磷相当磷脂的毫克数.
1.3.2 过氧化值的测定 按照GB 5009.227—2016[19]的方法测定过氧化值.称取“1.3.1”中制备的油样2~3 g(精确至0.001 g),加入30 mL氯仿与冰乙酸的混合液,振摇使其溶解.加入1.00 mL饱和碘化钾,振摇0.5 min后在暗处放置3 min.加入100 mL水,摇匀后加入1.00 mL淀粉指示剂,再次摇匀后立即用0.01 mol·L-1硫代硫酸钠标准溶液滴定,滴定至溶液蓝色消失为终点.同时进行空白试验.按下式计算过氧化值:X=(V-V0)×c×1 000/2/m.式中:X为过氧化值(mmol·kg-1);V为试样消耗的硫代硫酸钠标准溶液体积(mL);V0为空白试验消耗的硫代硫酸钠标准溶液体积(mL);c为硫代硫酸钠标准溶液的浓度(mol·L-1);m为试样质量(g);1 000为换算系数.
1.3.3 游离脂肪酸含量的测定 按照GB 5009.229—2016[20]的方法测定游离脂肪酸含量.称取适量试样,加入50 mL乙醚与异丙醇的混合液及3滴酚酞指示剂,充分振摇溶解试样.用0.1 mol·L-1氢氧化钾标准滴定液滴定至微红色,30 s内不褪色为滴定终点.按下式计算游离脂肪酸含量:游离脂肪酸/%=(V-V0)×c×56.1/m/2.式中:V为试样测定所消耗的标准滴定液的体积(mL);V0为空白试验消耗的标准滴定液的体积(mL);c为标准滴定液的摩尔浓度(mol·L-1);m为试样质量(g);56.1为氢氧化钾的摩尔质量(g·mol-1).
1.3.4 硫代巴比妥酸值的测定 按照Sinnhuber et al[21]的方法(稍作修改)测定硫代巴比妥酸值.取2~3 g试样(精确至0.001 g),加入50 mL 7.5%三氯乙酸(含0.1% EDTA·Na2)振摇30 min,用双层滤纸过滤.取5 mL上清液加入5 mL 0.02 mol·L-1硫代巴比妥酸,90 ℃水浴保温40 min后取出冷却至室温,加入5 mL氯仿振摇,静置分层后取上清液,分别测定532和600 nm处的D,按下式计算硫代巴比妥酸值:硫代巴比妥酸值/(mg·kg-1)=(D532 nm-D600 nm)/155×1/10×72.6×10.
1.4 鱼卵油脂肪酸组成的测定
甲酯化:取样品加入到15 mL离心管中,加入2 mL 2%氢氧化钠甲醇溶液,水浴回流至油滴消失.加入3 mL 14%三氟化硼甲醇溶液,继续煮沸30 min.加入适量异辛烷,移去冷凝管,加入20 mL饱和氯化钠.吸取上层溶液1~2 mL,加入无水硫酸钠脱水,进样.
气相色谱条件:CNW CD-2560毛细管色谱柱(100 m×0.25 mm×0.20 μm),载气为氦气,载气流速0.5 mL·min-1,进样口温度250 ℃,检测器为FID,检测器温度260 ℃,进样量1 μL,分流比10∶1.柱温先在130 ℃下保持5 min,再以4 ℃·min-1由130 ℃上升到240 ℃,然后在240 ℃下保持30 min.利用内标物(十九烷酸甲酯)判断各峰对应的脂肪酸,结合峰面积归一化法计算其相对含量.
1.5 数据处理
所有指标均平行测定3次,采用SPSS 20.0软件对数据进行Duncan检验,多重比较得差异显著性分析结果(P<0.05).采用Excel软件作图,数据以“平均值±标准差”表示.
2 结果与分析
2.1 脂质得率
图1显示,6种溶剂对大黄鱼鱼卵油中脂肪酸的提取效果存在差异,各溶剂组的提取效果为:95%乙醇组(27.97%±0.40%)>异丙醇组(27.30%±0.16%)>乙酸乙酯组(25.67%±0.61%)>正己烷组(22.27%±1.35%)>氯仿—甲醇组(19.00%±0.57%)>环己烷组(12.27%±0.62%).其中,95%乙醇组、异丙醇组、乙酸乙酯组和正己烷组脂质得率均显著高于氯仿—甲醇组(P<0.05),只有环己烷组显著低于氯仿—甲醇组(P<0.05),而95%乙醇组与异丙醇组的差异不显著(P>0.05).在此结果中,采用乙醇醇提除了溶剂去除不完全可能引起提取率偏高外,还可能是因为醇提法有利于提取出更多磷脂,导致总油脂含量比较高(图2).孙艳宾等[22]研究不同溶剂对太平洋磷虾油提取效果的影响,结论与本试验结果有一定的差异,推测与原料有关.
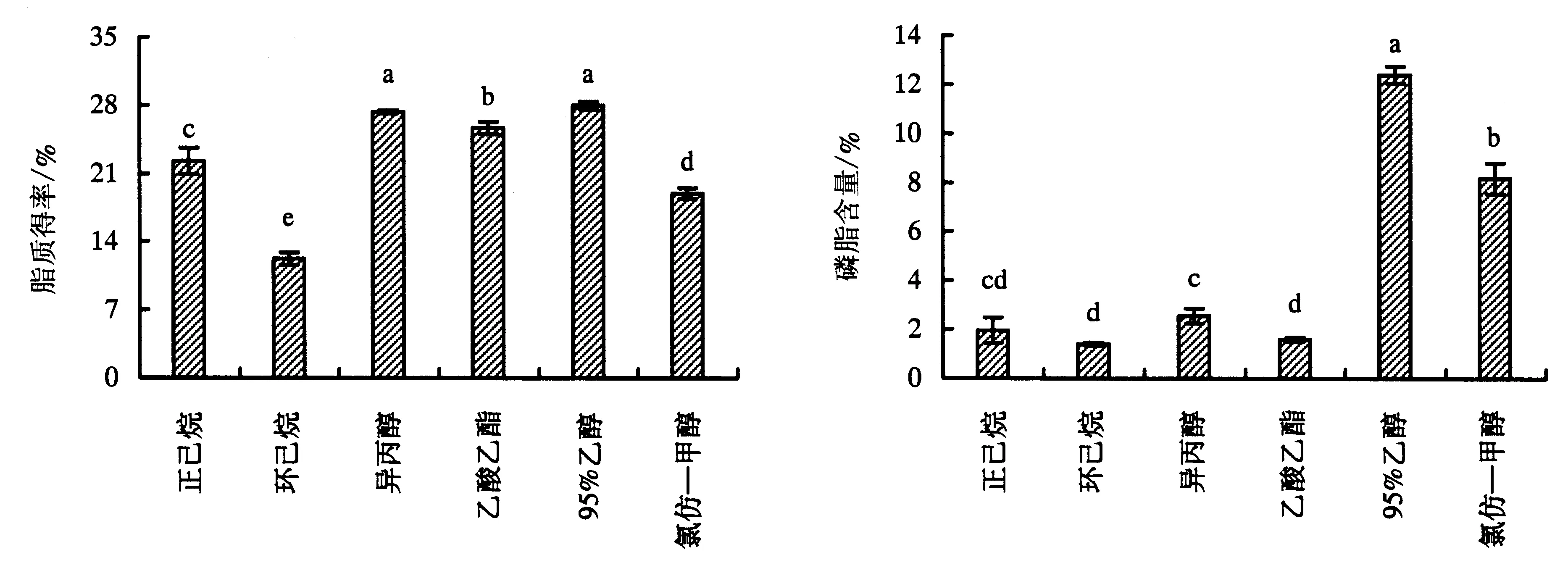
图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
图1 6种溶剂提取的大黄鱼鱼卵油的脂质得率
Fig.1 Extraction yield of large yellow croaker roe oil extracted with different solvents
图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
图2 6种溶剂提取的大黄鱼鱼卵油的磷脂含量
Fig.2 Comparison on phospholipids contents in large yellow croaker roe oil extracted with different solvents
2.2 磷脂含量
由图2可知,与氯仿—甲醇组(8.18%±0.62%)相比,95%乙醇组的磷脂含量更高(12.40%±0.35%),除正己烷组外,异丙醇组的磷脂含量(2.55%±0.31%)与其他4组均存在显著性差异(P<0.05).可能是因为磷脂是极性脂质成分,在极性不同的溶剂中其溶解性也不一样.根据溶剂的极性大小(甲醇>乙醇>异丙醇>氯仿>乙酸乙酯>正己烷>环己烷)和“相似相溶”的原理,95%乙醇和异丙醇对极性脂的提取率较高,乙酸乙酯、正己烷和环己烷对中性脂的提取率较高,而B&D法中的氯仿—甲醇对中性脂和极性脂的提取率均较高.此外,由于磷脂具有亲水亲油性,溶剂中存在适量的水分有利于磷脂的溶出,故采用95%乙醇提取的磷脂含量较高,这与陈文娟[4]的研究结果一致.
2.3 过氧化值
过氧化值是指油脂氧化过程中产生的过氧化物含量,用每千克油所含过氧化物的毫摩尔数表示.过氧化值是反映鱼油品质的一个重要指标,鱼油氧化程度越高,产生的游离脂肪酸越多,过氧化值就越高,但在氧化后期氢过氧化物的含量增加到一定值时,分解和聚合速度都会增大,因此,氧化后期过氧化值会呈一定的下降趋势,故深度酸败油脂的过氧化值反而变小[23-24].国家水产行业标准SC/T 3502—2016[25]规定,鱼油过氧化值的上限不能超过10 mmol·kg-1.由图3可知,6种溶剂提取的大黄鱼鱼卵油的过氧化值为1.33~6.81 mmol·kg-1,均在规定范围内,其中,95%乙醇组和氯仿—甲醇组的过氧化值显著低于其他溶剂组(P<0.05),异丙醇组的过氧化值显著高于其他溶剂组(P<0.05).可能原因是乙醇、异丙醇与水互溶,浓缩时所需温度较高,从而导致脂质氧化[26].氯仿—甲醇组的过氧化值为(2.22±0.32) mmol·kg-1,低于采用酶解法提取的过氧化值(4.62 mmol·kg-1)[6],说明采用溶剂法提取的鱼卵油相对于酶解法,其氧化程度更低.
2.4 游离脂肪酸含量
油脂水解生成游离脂肪酸,故游离脂肪酸含量在一定程度上能评定油脂品质.由图4可知,95%乙醇组的游离脂肪酸含量显著高于其他溶剂组(P<0.05),结合采用不同溶剂提取的鱼卵油过氧化值的差异,推测95%乙醇组游离脂肪酸含量高的原因可能是鱼卵油的初级氧化产物在95%乙醇体系中更不稳定,容易迅速分解生成短链脂肪酸等二级氧化产物造成的.孙甜甜等[27]采用不同方法提取南极磷虾脂质,发现采用95%乙醇提取时可能会发生甘油三酯的水解,造成游离脂肪酸偏高,而正己烷和氯仿是疏水性溶剂,水分对其提取的影响较小,游离脂肪酸含量相对较低.除95%乙醇组外,其他溶剂组提取的游离脂肪酸含量为2.72%~4.64%.刘国艳等[28]采用酶法提取小黄鱼内脏鱼油,其游离脂肪酸含量达到6.24%,说明采用溶剂法提取的鱼油,其水解程度较低.
图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
图3 6种溶剂提取的大黄鱼鱼卵油的过氧化值
Fig.3 Comparison of peroxide value of large yellow croaker roe oil extracted with different solvents
图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
图4 6种溶剂提取的大黄鱼鱼卵油的游离脂肪酸含量
Fig.4 Comparison on free fatty acids contents of large yellow croaker roe oil extracted with different solvents
2.5 硫代巴比妥酸值
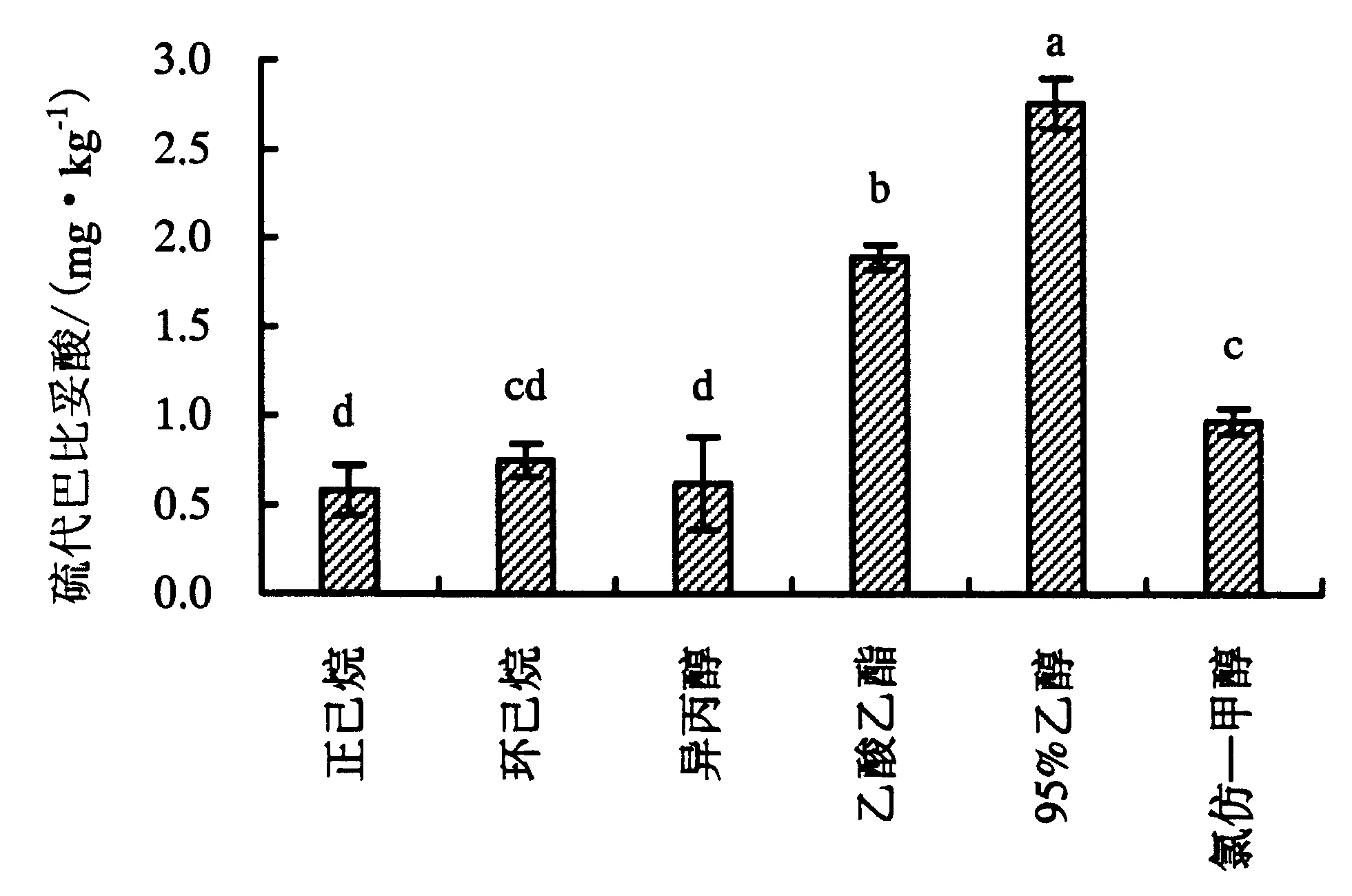
图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图5 6种溶剂提取的大黄鱼鱼卵油的硫代巴比妥酸值Fig.5 Comparison on thiobarbituric acid-reactive substances of large yellow croaker roe oil extracted with different solvents
丙二醛是脂质过氧化的二级产物,其含量可用来衡量脂质过氧化的程度[29].由图5可知:95%乙醇组和乙酸乙酯组的硫代巴比妥酸值显著高于其他溶剂组,分别为(2.76±0.14)和(1.89±0.07) mg·kg-1,氯仿—甲醇组的硫代巴比妥酸值次之(0.97 mg·kg-1±0.07 mg·kg-1);正己烷组、环己烷组、异丙醇组的硫代巴比妥酸值差异不显著(P>0.05).综合图3的过氧化值和图4的游离脂肪酸含量,可以验证采用95%乙醇提取的鱼卵油更容易形成二级氧化产物的推测.与其他溶剂相比,95%乙醇的挥发度相对较小,挥发速度相对较慢,在提取过程中,95%乙醇组旋蒸耗时较长,可能导致油脂过氧化程度高.
2.6 脂肪酸组成
由6种溶剂提取的大黄鱼鱼卵油的脂肪酸组成及相对含量(表1)可知,6种溶剂提取的鱼卵油的不饱和脂肪酸(单不饱和脂肪和PUFA)含量都在75%以上,PUFA含量达35.46%~44.65%,其中,n-3 PUFA(EPA+DHA)含量达31.06%~36.62%.正己烷组和环己烷组的PUFA种类均为7种,含量分别为(37.08±1.49)%和(42.39±0.95)%,(EPA+DHA)含量分别为(32.34±0.80)%和(36.56±0.80)%;异丙醇组的PUFA种类为5种,含量为(35.46±0.33)%,(EPA+DHA)含量为(31.06±0.20)%;乙酸乙酯组的PUFA种类有6种,含量为(44.65±0.57)%,(EPA+DHA)含量为(36.62±0.59)%;95%乙醇组和氯仿—甲醇组的PUFA种类均为5种,含量分别为(37.88±0.94)%和(40.33±1.19)%,(EPA+DHA)含量分别为(33.52±0.84)%和(36.19±1.06)%.研究表明,在采用超临界CO2流体萃取的大黄鱼鱼卵油中,(EPA+DHA)含量仅为19.4%,说明采用溶剂法提取大黄鱼鱼卵油,其EPA和DHA的含量更高[7].采用6种溶剂提取的大黄鱼鱼卵油n-3 PUFA(EPA+DHA)在其PUFA中的占比分别为89.73%(氯仿—甲醇组)、88.49%(95%乙醇组)、87.59%(异丙醇组)、87.21%(正己烷组)、86.25%(环己烷组)和82.02%(乙酸乙酯组).n-3 PUFA具有重要的营养功效,对心脑血管疾病的发生以及中枢神经系统的发育具有重要作用,因此通常将其含量的高低作为油脂品质优劣的重要指标之一[11].Shirai et al[30]分析了鲑鱼籽、鳕鱼籽、飞鱼籽、鲱鱼籽4种鱼籽的脂质组分和脂肪酸组成,发现其总脂质中也均富含DHA.
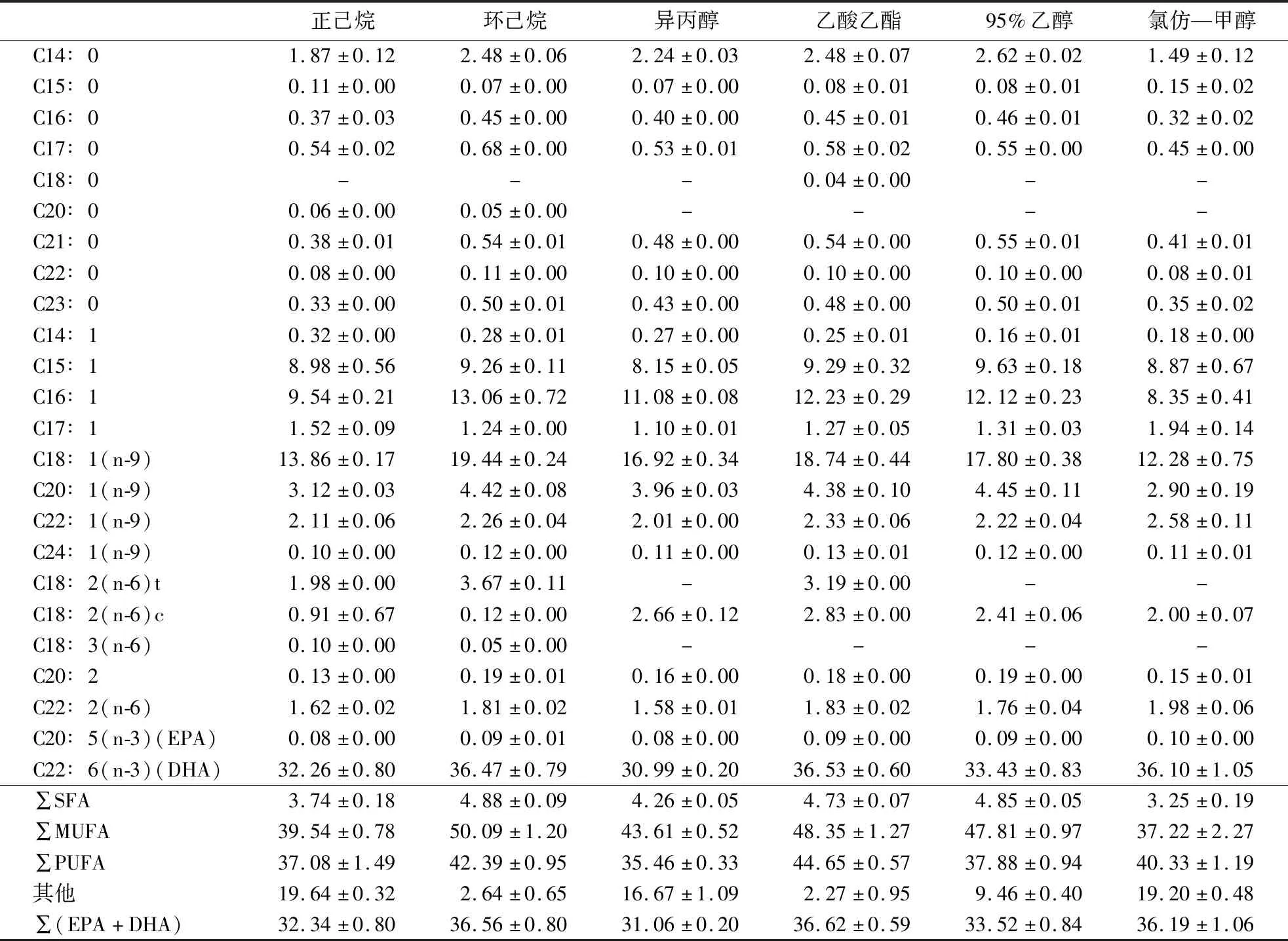
表1 6种溶剂提取的大黄鱼鱼卵油的脂肪酸组成及其相对含量1)Table 1 Fatty acid profile of large yellow croaker roe oil extracted with different solvents %
1)SFA—饱和脂肪酸,MUFA—单不饱和脂肪;-表示未检出.
合理的n-3 PUFA/n-6 PUFA比值对机体健康有益[31-32],如n-3 PUFA/n-6 PUFA比值较高的油脂可以起到增强免疫反应和非特异性抗性的作用.由表1可知,氯仿—甲醇组的n-3 PUFA/n-6 PUFA比值高达9.09,而正己烷组、环己烷组、异丙醇组、乙酸乙酯组和95%乙醇组的n-3 PUFA/n-6 PUFA比值分别为7.02、6.47、7.33、4.66和8.04.故从n-3 PUFA/n-6 PUFA比值考虑,认为采用B&D法获得的大黄鱼鱼卵油具有较高的营养价值.
3 结论
本试验以大黄鱼鱼卵为研究对象,率先采用6种溶剂提取大黄鱼鱼卵油,对所得鱼卵油的脂质得率和品质进行了分析.结果表明:95%乙醇对鱼卵油的提取效果最好,但其氧化程度较为严重;B&D法对鱼卵油的提取率低,但其氧化程度相对较低,品质较好.另外,对大黄鱼鱼卵油脂肪酸组成及其相对含量的分析可知,采用B&D法获得的鱼卵油品质最佳.然而,B&D法作为国际上经典的油脂提取方法,其所用溶剂氯仿和甲醇具有一定的安全性问题,长期接触会危害人体健康,该研究结果可为在实际生产过程中,采用其他试剂法提取大黄鱼鱼卵油提供参考.此外,采用乙醇溶剂法提取油脂具有安全无毒且成本较低的特点,较适合工业化生产,但本试验采用乙醇溶剂法获得的大黄鱼鱼卵油的氧化程度较高,具体抑制方法有待进一步深入研究.

