7例腕部自体动静脉内瘘术后急性血栓形成患者再次手术的临床疗效
徐 立 李文献 林小雷
福建医科大学附属漳州市医院血管外科,福建 漳州 363000
长期血液透析是终末期肾脏病患者的主要治疗方式,建立腕部自体动静脉内瘘是长期血液透析治疗的首选,建立内瘘的方式推荐桡动脉—头静脉端侧吻合[1]。当自身血管条件较好,即桡动脉和头静脉内径均≥2.0 mm时,内瘘通常能成功建立,然而内瘘早期失功能的主要原因是血栓形成[2]。本研究中当桡动脉和头静脉内径均≥2.0 mm的患者施行腕部自体动静脉内瘘手术后出现急性血栓形成时,经再次手术治疗,取得良好的临床效果,现总结报道如下。
1 资料与方法
1.1 一般资料
福建医科大学附属漳州市医院在2017年01月至2018年12月对血管内径≥2.0mm的患者实施腕部自体动静脉内瘘手术139例,7例出现术后形成急性血栓,一般资料见表1。7例患者最早在术后3 h,最晚在术后24 h查房时发现吻合口震颤消失,彩色多普勒超声检查提示吻合口血管内低回声组织、无血流信号。
1.2 方法
再次手术方式,经原切口显露吻合口,拆除吻合口缝线,通过Fogarty导管取栓成功,并在显微镜下(×10)重新吻合。
1%利多卡因局部麻醉,经原切口显露吻合口,游离出吻合口近远端血管,做好阻断的准备。经外周静脉推注肝素10~20 mg,小心拆除吻合口缝线,若见有部分血栓暴露在外,用镊子夹住暴露的血栓轻柔取出。应用3号的Fogarty取栓导管,沿着拆开的吻合口分别向动脉端及静脉端轻柔的送入Fogarty取栓导管,深度超过血栓段。通常取出的血栓末端呈鼠尾样(图1),必要时重复2~3次,直到动脉端喷血好,静脉端见回血,分别注入l0.1 mg/ml肝素水10 m后阻断。设计静脉大致呈30°夹角与动脉吻合。游离回流的头静脉4~5 cm,并分离皮瓣,使吻合口近心端的回流静脉走行尽量接近直线。无张力状态下拉直静脉靠近动脉,并避免静脉冗长、成角,在准备吻合处按30°角剪去多余静脉,使静脉吻合端呈斜面。同时避免吻合口过于接近静脉瓣膜,若难以避开,应切除该瓣膜。显微镜下重新修剪动脉端,做7 mm扁椭圆形切口。取栓后吻合口内膜处常附着有小颗粒样物,应祛除干净。吻合时应用2定点连续缝合,注意对位准确无扭转,针距0.5~0.6 mm,边距0.2~0.3 mm。最后打结时避免过度收紧缝线,松开血管夹,检查头静脉是否充盈良好,吻合口有无明显的震颤,检查回流静脉走行的顺畅性。术后每天予低分子肝素100 U/kg,抗凝治疗2~3 天。
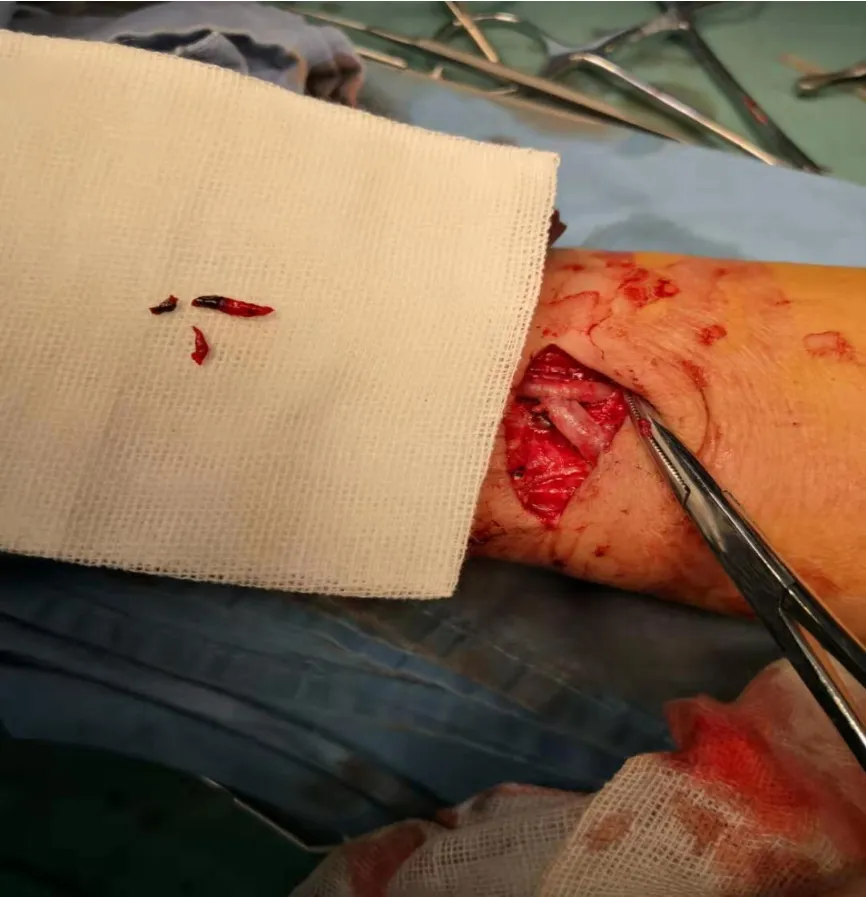
图1 取出的血栓末端呈“鼠尾”样

表1 7例腕部自体动静脉内瘘术后急性血栓形成患者一般临床资料
2 结果
2.1 7例患者再次术后情况
7例再次手术的患者术后吻合口均可触及明显震颤,无手术并发症,顺利出院。
2.2 随访
随访12~18月,均无肢体肿胀,无手指发绀等肢体缺血表现,无活动后气促等心功能不全表现,彩色多普勒超声提示血透通路通畅,流量320~380 ml/min,能满足日常血透需要。
3 讨论
随着终末期肾脏病患者的增加,需要长期行血液透析治疗的患者也日益增多。良好的血透通路是终末期肾脏病患者顺利进行血液透析治疗的保证,是血透患者的“生命线”[3]。自体动—静脉内瘘具有使用寿命较长、方便透析、并发症较少和费用低等优点,其中桡动脉—头静脉内瘘更具有肢体低通路相关缺血发生率低,可以充分保留穿刺血管等优点,是目前国内外指南均推荐的首选血透通路[1-3]。
自体动—静脉内瘘术的成功与否,与患者自身的血管条件密切相关。当桡动脉和头静脉内径均<1.6 mm时,内瘘失败率极高[3]。在近端使用止血带时,若桡动脉和头静脉内径均≥2.0 mm时,则内瘘通常能成功建立[2]。术前使用彩色多普勒超声对血管进行评估筛查,有助于选择更合适的手术部位及方式,提高手术成功率及瘘管成熟率。我院开展手术初期,为了提高成功率,选择桡动脉和头静脉内径均≥2.0mm的患者,手术成功率较高。
早期血栓形成的定义是术后30天内的血栓形成[4]。早期血栓形成的原因主要包括:技术原因、血管细小、动脉硬化、动脉壁分层、血管钙化、糖尿病肾病、高血压肾病、高龄、肥胖、低血压、血液高凝状态及内瘘受压[5-6]。目前,术后急性血栓形成尚未见相关的定义,通常在术后0~24 h内出现,是早期通路失败的主要原因。若术后急性血栓形成发生在术前评估血管条件较好的病例,极可能与手术操作有关。如静脉扭转、对合不良、吻合口内翻、瓣膜影响、补漏缝合或操作损伤血管壁。临床上发现动静脉吻合口震颤明显减弱甚至消失,应考虑血栓形成。超声检查可进一步证实,急性血栓为弱回声,陈旧性血栓有较强回声,超声检查还可明确血栓位置及累及范围。
内瘘血栓的处理方法主要包括,溶栓治疗、介入治疗和手术重建。但对于术后急性血栓,溶栓及介入治疗容易引起吻合口出血。本组1例尝试在血栓近心端静脉阻断下应用尿激酶20万U溶栓,治疗4 h后吻合口出血。手术重建,若高位重建内瘘,虽然是解决血管通路问题的一种方法,但增加手术创伤及难度,且会损失有限的血管资源,本研究中使用原位重建,取得的良好的效果。
一旦发现术后急性血栓形成,争取在72 h内取栓。通常情况下手术越早取栓效果越理想。本组2例在24 h时内取栓,4例在48 h时内取栓,1例在72小时内取栓,均获得成功。若超过7 d,则血栓通常已开始机化,手术成功率低[7]。对于术后急性血栓形成,经原吻合口Fogarty球囊导管取栓术,能很好的复通,目前该技术应用成熟,风险小,操作简单,取栓成功率高[8],本组7例患者均取栓顺利。术中应用10~20 mg肝素抗凝,减少再次血栓风险,本组1例初次手术时无应用肝素,且阻断时间较长,可能是诱发血栓形成的原因。修剪静脉时,按30°角与动脉吻合的方式剪裁,该方式吻合口湍流小,远期通畅率高[9],静脉应避免冗长,本组中2例发现因静脉冗长,导致吻合口远端3~4 cm处折角,可能是诱发血栓形成的原因,应避免吻合口过于接近静脉瓣膜,本组中1例吻合口过于接近静脉瓣膜1cm内,再次手术时切除该瓣膜。5 mm大小的吻合口内径是比较合适的[10],若直线切开动脉,需要切开7.5~8.0 mm,本研究中做一7 mm扁椭圆形切口,防止吻合口前后壁过于贴紧,本组2例再次手术发现动脉侧壁切开过小,可能是诱发血栓形成的原因。取栓后的血管条件变差,对吻合的要求更高,显微镜下吻合更有优势。取栓后吻合口处内膜常附着有小颗粒样物,应祛除干净,用较小的针距及边距缝合,多缝合内膜层使吻合后内膜外翻。吻合后注意检查头静脉是否充盈良好,吻合口有无明显的震颤,检查回流静脉走行的顺畅性,本组1例再次吻合后震颤微弱,仔细检查后发现近心端5~6cm处回流静脉较狭窄,松解外膜后静脉较前扩张,吻合口震颤满意。
关于内瘘成熟的标准,欧洲要求可用于透析的血流量应该达到至少300 ml/min[2],而日本仅为 200 ml/min[11]。本组6例患者术后随访12~18月,彩超提示血透通路通畅,流量320-380 ml/min,能满足国内血透常用的250~300 ml/min,提示内瘘成功建立。
综上所述,腕部自体动静脉内瘘术后急性血栓形成后72 h内再次再次行Fogarty导管取栓及显微镜下重新吻合效果良好。

