苯基噻吩-2-基甲酮类氯酚的合成及对蛋白酪氨酸激酶的抑制作用
冯秀娥,孔 亮,李青山
(山西医科大学药学院药物化学教研室,太原 030001;*通讯作者,E-mail:xiuefeng@163.com)
蛋白酪氨酸激酶(protein tyrosine kinase,PTK)是一类具有酪氨酸激酶活性的蛋白质,以其在信号转导中的重要地位被广泛作为抗肿瘤药物研究的靶点[1,2]。课题组前期以海洋来源的活性卤酚为先导化合物,通过系统的结构优化已经设计合成了二苯甲酮、二苯甲烷、苯基呋喃-2-甲酮等不同骨架结构的卤酚化合物,其中(5-溴呋喃-2-基)(3,4-二羟基苯基)甲酮(LFZ1)(见图1)对PTK的抑制活性最高,其IC50值为2.72 μmol/L[3,4]。噻吩环是许多酪氨酸激酶抑制剂的药效母核结构,噻吩衍生物在治疗肿瘤疾病等方面有重要的药理用途[5-7]。因此,本文以LFZ1为先导化合物,以噻吩环替代呋喃环,进行结构衍生,设计合成系列新型的苯基噻吩-2-基甲酮类氯酚,通过对PTK的抑制活性筛选,以期寻找潜在的抗肿瘤药物。
1 材料与方法
1.1 仪器及试剂

图1 先导化合物LFZ1的结构Figure 1 Structure of the lead compound LFZ1
DHJF-8002低温反应器(郑州长城仪器有限公司),X-4数字显示显微熔点测定仪(北京泰克仪器有限公司),AVANCE600MHZ超导核磁共振光谱仪(瑞士Bruker公司),API-QTRAP3200液相色谱质谱联用仪(美国Applied Biosystems公司),Allegra X-22R冷冻离心机(美国Beckman公司),Heal Force HP90二氧化碳培养箱(上海力申科学仪器有限公司),SpectraMax M5连续光谱酶标测试仪(美国Molecular Devices公司),玻璃匀浆器(欣维尔玻璃仪器有限公司)。
合成用主要原料2-甲氧基苯甲酰氯、3-甲氧基苯甲酰氯、4-甲氧基苯甲酰氯、3,4-二甲氧基苯甲酰氯、3,5-二甲氧基苯甲酰氯、2,3-二甲氧基苯甲酸、3,4,5-三甲氧基苯甲酸、2-甲氧基-5-氯苯甲酸、3,5-二氯苯甲醚、2-甲氧基苯甲醚、2-噻吩甲酰氯均购自百灵威科技有限公司;噻吩、2-氯噻吩、三溴化硼、磺酰氯和二氯亚砜均购自上海晶纯试剂有限公司;健康成年雄性Sprague-Dawley(SD)大鼠(180-210 g)购自中国食品药品检定研究院,poly-Glu-Tyr(PGT)底物、辣根过氧化物酶标记的小鼠抗磷酸化酪氨酸单克隆抗体购自美国Sigma公司,TMB显色剂购自北京四正柏生物科技有限公司,Bradford蛋白定量试剂购自北京普利莱生物技术有限公司。其他均为国产常规试剂。
1.2 合成路线
以不同位置取代的甲氧基苯甲酰氯,在三氯化铝(AlCl3)催化下,与2-氯噻吩经傅克酰化、三溴化硼(BBr3)脱甲基,合成了氯酚1c-5c(见图2)。

图2 目标化合物1c-5c的合成路线Figure 2 The synthetic route of the target compounds 1c-5c
以不同位置取代的甲氧基苯甲酸6a-7a与磺酰氯(SO2Cl2)在二氯甲烷(CH2Cl2)中回流,氯代制得6a’-7a’,在N,N-二甲基甲酰胺(DMF)催化下用无水二氯亚砜(SOCl2)酰氯化制得相应的酰氯,再在AlCl3催化下和噻吩或者2-氯噻吩傅克酰化、BBr3脱甲基合成了氯酚6c-8c(见图3)。

图3 目标化合物6c-8c的合成路线Figure 3 The synthetic route of target compounds 6c-8c
以不同基团取代的苯甲酸为原料,在DMF催化下用无水SOCl2制得相应的酰氯,然后在AlCl3催化下与2-氯噻吩经傅克酰化、BBr3脱甲基,制得氯酚9c-10c(见图4)。
以噻吩-2-甲酰氯为原料,在AlCl3催化下与氯或甲氧基取代的苯甲醚进行傅克酰化、BBr3脱去甲基,制得氯酚11c-12c(见图5)。

图4 目标化合物9c-10c的合成路线Figure 4 The synthetic route of the target compounds 9c-10c
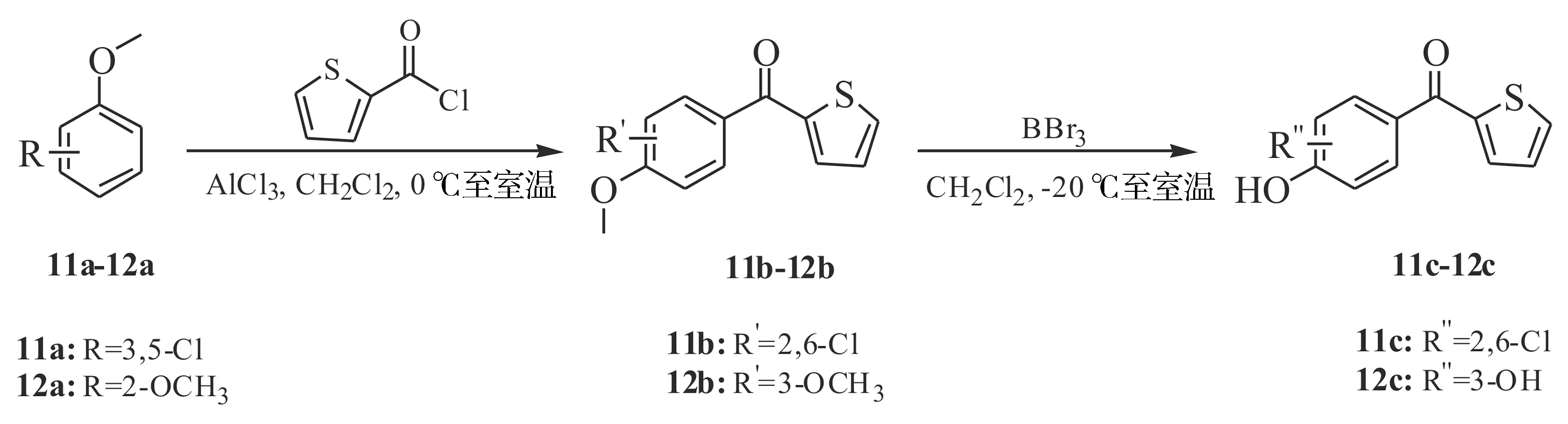
图5 目标化合物11c-12c的合成路线Figure 5 The synthetic route of the target compounds 11c-12c
1.3 合成方法
(2-甲氧基苯基)(5-氯噻吩-2-基)甲酮(1b)的合成:将0.71 g(6.0 mmol)2-氯噻吩溶于20 ml无水CH2Cl2,再加入0.85 g(5.0 mmol)2-甲氧基苯甲酰氯,冰浴下分3次加入0.65 g(4.9 mmol)无水AlCl3。缓慢升至室温,搅拌,反应2 h后,薄层色谱(TLC)监测反应完全。加入适量冰水终止反应。体系分层,分液后以20 ml的CH2Cl2萃取水层两次,合并有机相,无水硫酸钠(Na2SO4)干燥过夜,减压蒸除溶剂,经柱层析(V石油醚∶V乙酸乙酯=15 ∶1)分离得到化合物1b,黄色油状液体0.27 g。化合物2b-5b按照此法合成。
(2,3-二甲氧基-4,5-二氯苯基)(噻吩-2-基)甲酮(6b)的合成:将5.0 g(28 mmol)2,3-二甲氧基苯甲酸加至10 ml的SO2Cl2中,缓慢升至75 ℃,回流反应4 h,减压蒸除溶剂,得到2,3-二甲氧基-4,5-二氯苯甲酸(6a′)。将1.2 g(4.7 mmol)化合物6a′溶于5.0 ml新蒸的SOCl2中,加入2滴DMF,加热至85 ℃,回流反应4 h。减压除去SOCl2,得到2,3-二甲氧基-4,5-二氯苯甲酰氯(6a″),直接加入20 ml无水CH2Cl2和0.87 g(10 mmol)噻吩,冰浴下分3次加入1.6 g(12 mmol)无水AlCl3,撤去冰浴,缓慢升至室温,反应2 h,TLC监测反应完全,加入适量冰水终止反应,体系分层,分液后以20 ml的CH2Cl2萃取水层两次,合并有机相,无水Na2SO4干燥过夜。减压蒸除溶剂,经柱层析(V石油醚∶V乙酸乙酯=15 ∶1)分离得到化合物6b,黄色油状液体0.58 g。化合物7b-8b按照此法合成。
(3,4,5-三甲氧基苯基)(5-氯噻吩-2-基)甲酮(9b)的合成:将1.0 g(4.9 mmol)3,4,5-三甲氧基苯甲酸加入10 ml新蒸SOCl2溶液中,加入2滴DMF,在85 ℃回流反应4 h,减压去除SOCl2,得到3,4,5-三甲氧基苯甲酰氯(9a′),直接溶于20 ml无水CH2Cl2,加入0.70 g(5.9 mmol)2-氯噻吩,冰浴下分3次加入0.66 g(4.9 mmol)无水AlCl3,撤去冰浴,缓慢升至室温,反应2 h,TLC监测反应完全,加入适量冰水终止反应,体系分层,分液后以20 ml CH2Cl2萃取水层两次,合并有机相,无水Na2SO4干燥过夜。减压蒸除溶剂,经柱层析(V石油醚∶V乙酸乙酯=15 ∶1)分离得到得化合物9b,黄色固体0.15 g。化合物10b按照此法合成。
(4-甲氧基-2,6-二氯苯基)(噻吩-2-基)甲酮(11b)的合成:将0.21 g(1.2 mmol)3,5-二氯苯甲醚溶于10 ml无水CH2Cl2,冰浴下加入0.15 g(1.0 mmol)噻吩-2-甲酰氯,分3次加入无水AlCl30.15 g(1.1 mmol),缓慢升至室温,反应2 h,TLC监测反应完全,加入适量冰水终止反应,体系分层,分液后以20 ml的CH2Cl2萃取两次,合并有机相,无水Na2SO4干燥过夜,减压蒸除溶剂,经柱层析(V石油醚∶V乙酸乙酯=15 ∶1)分离得到得化合物11b,浅黄色液体0.09 g。化合物12b按照此法合成。
初中物理实际上是物理学科的基础,主要目的是为了能够提高学生学习兴趣,引导学生进入该学科.而高中物理则有着极大的不同,其作为高中向大学过渡的重要学科,有很多物理中基础性的知识和定律需要学生在高中掌握,并且还需要在高中就锻炼出学生的物理素养,能够通过物理思维进行问题的解决.
(2-羟基苯基)(5-氯噻吩-2-基)甲酮(1c)的合成:将中间体1b溶于适量无水CH2Cl2,置于低温反应器中,在-20 ℃下,30 min内滴加5 ml(BBr3和CH2Cl2体积比1 ∶9)BBr3的无水CH2Cl2溶液,滴毕升至室温反应4 h,加入适量冰水终止反应,抽滤,取滤饼,干燥,得墨绿色固体335 mg。目标化合物2c-12c按照此法合成。
1.4 生物活性评价
大鼠脑组织中PTK的提取:将大鼠大脑取出,剔除脑膜、称重,加入冷匀浆液。冰浴中用玻璃匀浆器高速间断匀浆,经梯度离心获得胞浆型酪氨酸激酶。
酶标板包被:底物稀释液加入96孔酶标板中,37 ℃孵育12 h。移除板中过量底物液,PBST(含0.1%Tween 20的PBS溶液)洗涤1次,于37 ℃干燥2 h。4 ℃保存备用。
PTK抑制剂筛选:先将化合物10 μl和激酶缓冲液稀释的PTK粗提物50 μl依次加入酶标板,每个化合物设6个复孔,37 ℃孵育10 min;加入80 μl激酶缓冲液稀释的ATP,37 ℃孵育40 min;移除板中反应液,PBST洗涤5次;加入抗体复合物100 μl,37 ℃孵育40 min;移除板中抗体复合物,PBST洗涤5次;加入TMB显色液100 μl,室温避光反应10 min;加入终止液100 μl,于450 nm测吸光度值。设置空白对照和正常对照,以不加激酶组织提取液为空白对照,以生理盐水代替受试物为正常对照。抑制率(%)=(正常对照吸光度-样品吸光度)/(正常对照吸光度-空白对照吸光度)×100%[8]。
采用酶联免疫吸附法测定样品对PTK的抑制作用[8]。
2 结果
本研究设计合成了12个苯基噻吩-2-基甲酮类氯酚,其中9个未见文献报道,通过ESI-MS,1H-NMR和13C-NMR对其进行了结构确证,其物理性质和谱图数据见表1和表2。
表3结果显示,已测试的目标化合物中,化合物7c显示出良好的抑制活性,IC50值为2.39 μmol/L,其他化合物在10 μmol/L时均未表现出明显活性。
表1 目标化合物的理化性质和质谱数据
Table 1 The physicochemical properties and ESI-MS data of target compounds
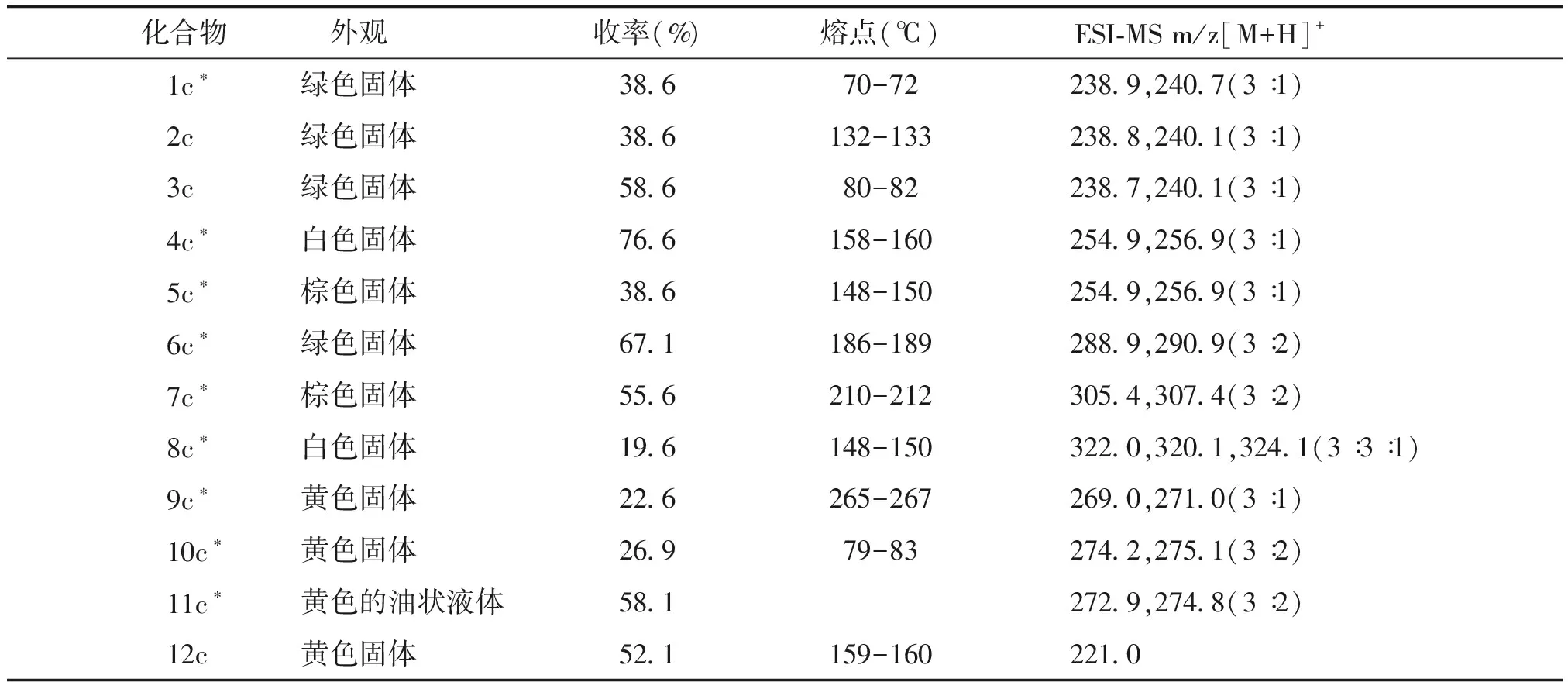
化合物 外观收率(%)熔点(℃)ESI-MS m/z[M+H]+ 1c∗绿色固体38.670-72238.9,240.7(3∶1)2c绿色固体38.6132-133238.8,240.1(3∶1)3c绿色固体58.680-82238.7,240.1(3∶1)4c∗白色固体76.6158-160254.9,256.9(3∶1)5c∗棕色固体38.6148-150254.9,256.9(3∶1)6c∗绿色固体67.1186-189288.9,290.9(3∶2)7c∗棕色固体55.6210-212305.4,307.4(3∶2)8c∗白色固体19.6148-150322.0,320.1,324.1(3∶3∶1)9c∗黄色固体22.6265-267269.0,271.0(3∶1)10c∗黄色固体26.979-83274.2,275.1(3∶2)11c∗黄色的油状液体58.1272.9,274.8(3∶2)12c黄色固体52.1159-160221.0
*未见文献报道的新化合物
表2 目标化合物的氢谱和碳谱数据
Table 2 The1H-NMR and13C-NMR data of target compounds

化合物1H-NMR(600 MHz, CDCl3)δ ppm13C-NMR(150 MHz,DMSO)δ ppm1c11.4 (s, 1H, OH), 7.89 (dd, J=1.8, 7.8 Hz, 1H Ar-H), 7.55 (d, J=3.6 Hz, 1H, thiophene-H), 7.51 (t, 1H, Ar-H), 7.08 (d, J=8.4 Hz, 1H, Ar-H), 7.03 (d, J=3.6 Hz, 1H, thiophene-H), 6.95 (t, 1H, Ar-H)187.3, 155.7, 142.5, 137.8, 135.3, 132.8, 129.4, 128.9, 124.5, 118.9, 116.72c7.47 (d, J=4.2 Hz, 1H, thiophene-H), 7.37 (m, 2H, Ar-H), 7.31 (s, 1H, Ar-H), 7.09 (m, 1H, Ar-H), 6.99 (d, J=4.2 Hz, 1H, thi-ophene-H), 5.62 (brs, 1H, OH)186.2, 157.5, 141.7, 138.0, 137.6, 135.4, 129.9, 128.9, 119.9, 119.6, 115.1,3c7.86 (d, J=9.0 Hz, 2H, Ar-H), 7.43 (d, J=4.2 Hz, 1H, thiophene-H), 6.98-6.99 (m, 3H, Ar-H, thiophene-H), 3.89 (s, 1H, OH)184.8, 163.0, 142.1, 137.2, 134.7, 131.3×2, 128.8, 114.1×24c7.60 (d, J=4.2 Hz, 1H, Ar-H), 7.29-7.30 (m, 2H, Ar-H, thio-phene-H), 7.28 (d, J=2.4 Hz, 1H, Ar-H), 6.89 (d, J=8.4 Hz, 1H, thiophene-H), 3.88 (s, 1H, OH), 3.84 (s, 1H, OH)187.8, 154.3, 148.8, 145.8, 140.0, 137.4, 131.9, 131.0, 125.8, 119.5, 118.65c9.73 (brs, 2H, OH), 7.61 (d, J=3.6 Hz, 1H, thiophene-H), 7.33 (d, J=3.6 Hz, 1H, thiophene-H), 6.66 (s, 1H, Ar-H), 6.65 (s, 1H, Ar-H), 6.51 (t, 1H, Ar-H)189.5, 162.0×2, 145.1, 141.6, 141.2, 138.4, 110.2, 132.2×2, 110.16c10.54 (brs, 1H, OH), 9.62 (brs, 1H, OH), 8.13 (d, J=7.2 Hz, 1H, thiophene-H), 7.48 (d, J=7.2 Hz, 1H, thiophene-H), 7.22 (t, 1H, thiophene-H), 7.07 (s, 1H, Ar-H)184.5, 145.6, 143.1, 142.8, 136.5, 135.6, 129.0, 127.8, 120.7, 116.6, 116.47c6.62 (brs, 3H, OH), 8.13 (d, J=4.8 Hz, 1H, thiophene-H), 7.46 (d, J=3.6 Hz, 1H, thiophene-H), 7.23 (t, 1H, thiophene-H)187.8, 146.2, 145.3×2, 140.4, 140.2, 140.0, 132.5×2, 131.1, 112.38c10.48 (brs, 1H, OH), 9.85 (brs, 1H, OH), 7.38 (d, J=3.6 Hz, 1H, thiophene-H), 7.27 (d, J=4.2 Hz, 1H, thiophene-H), 7.07 (s, 1H, Ar-H)187.3, 149.2, 146.7, 144.9, 142.3, 139.1, 132.7, 130.0, 124.3, 120.2, 120.09c9.39 (brs, 3H, OH), 7.60 (d, J=6 Hz, 1H, thiophene-H), 7.32 (d, J=6 Hz, 1H, thiophene-H), 6.89 (s, 2H, Ar-H)184.6, 145.7, 142.3, 138.9, 136.5, 133.9, 128.4, 126.3, 108.710c10.40 (brs, 1H, OH), 7.44 (d, J=6 Hz, 1H, thiophene-H), 7.42(s, 1H, Ar-H), 7.39 (d, J=3.6 Hz, 1H, Ar-H), 7.28 (d, J=6 Hz, 1H, thiophene-H), 7.01 (d, J=13.2 Hz, 1H, Ar-H)185.6, 154.0, 142.1, 138.3, 135.8, 131.9, 129.6, 128.3, 126.5, 122.5, 118.311c10.90 (brs, 1H, OH), 8.17 (dd, J=5.4, 13.2 Hz, 1H, thiophene-H), 7.51 (d, J=5.4 Hz, 1H, thiophene-H), 7.24 (t, 1H, thiophene-H), 6.97 (s, 2H, Ar-H)114.7×2, 119.3, 125.3, 129.3, 131.2, 137.4×2, 143.0, 159.3, 184.612c9.93 (brs, 1H, OH), 9.50 (brs, 1H, OH), 8.04 (d, J=6 Hz, 1H, thiophene-H), 7.72 (d, J=6 Hz, 1H, thiophene-H), 7.26-7.33 (m, 3H, Ar-H, thiophene-H), 6.90 (d, J=12.6 Hz, 1H, Ar-H)185.5, 150.4, 145.2, 143.2, 134.1, 134.0, 128.6, 128.3, 122.3, 116.2, 115.1
表3 目标化合物对PTK的抑制活性
Table 3 Inhibitory activity of the target compounds on PTK

化合物抑制率(%)IC50(μmol/L)化合物抑制率(%)IC50(μmol/L)1c0.4NA7c90.1 2.392c10.5NA8c8.1NA3c0.5NA9c32.1NA4c-1.5NA10c2.1NA5c10.1NA11c1.1NA6c5.1NA12c5.5NA金雀异黄素- 13.6
NA表示在10 μmol/L时,PTK没有抑制活性
3 讨论
通过采用傅克酰基化、脱甲基反应共合成了12个苯基噻吩-2-基甲酮类氯酚,其中,9个目标化合物为新化合物。
在目标化合物6c-8c的制备过程中,氯代反应是关键步骤,一方面氯代个数不确定,可能会发生多氯代反应;另一方面由于反应底物结构不对称,所以氯代位置不确定,存在区域选择性问题。本文通过调节反应物摩尔比和分步反应得到了纯度较高的化合物。采用磺酰氯作为氯代试剂,常温下,3,4,5-三甲氧基苯甲酸氯代时得到一氯代产物,而在75 ℃下回流得到二氯代产物。在75 ℃下,2,3-二甲氧基苯甲酸氯代得到二氯代产物,在羧基的邻位上较难发生氯代反应,可能是由于甲氧基的定位效应为邻、对位以及羧基的空间位阻效应。最终通过光谱分析确定了氯代产物的结构。首先,根据ESI-MS确定氯原子个数,氯的同位素峰具有其特征质谱峰形;其次,1H-NMR能清晰显示出化合物的氢信号,可以验证苯环氢之间耦合情况与氯原子取代位置是否相符;最后,结合13C-NMR可确定目标化合物的结构。
化合物7c的结构中苯环上的3位,4位和5位连有羟基,2位和6位连有氯原子,表现出最好的PTK抑制活性;而化合物6c的苯环上2位和3位连有羟基,4位和5位连有氯原子,化合物8c与6c相比,苯环上的取代基和位置相同,仅是噻吩环的2位有氯原子,但是6c和8c均没有活性;化合物9c的苯环上连有3个羟基,位置与7c相同,但是苯环上没有氯原子,噻吩环的2位被氯取代,也没有表现出活性。初步构效关系表明,噻吩环上2位被氯原子取代不利于活性,苯环上的所有氢原子均被羟基或氯原子取代则有利于活性。

