脑梗死患者血浆致动脉硬化指数与颈动脉粥样硬化的相关性研究
文 芮,王誉霖,孟 可,闵连秋
颈动脉是联系心脏与大脑间血供的重要动脉,是动脉粥样硬化早期最常累及的部位之一,可作为评估动脉粥样硬化发生与发展的窗口[1]。颈动脉内膜中层厚度(carotid artery intima-media thickness,CIMT)是反映早期动脉粥样硬化的重要指标[2],其在临床上的运用价值较单纯观察斑块要更大[3]。血脂代谢紊乱是动脉硬化的一个重要发病机制,血浆致动脉硬化指数(atherogenic index of plasma,AIP)是甘油三酯(triglycerides,TG)与高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)比值的对数转换值,即AIP=lg(TG/HDL-C)[4],可间接反应低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)颗粒的大小,且AIP的大小与动脉硬化的程度密切相关[5]。CIMT和AIP两者对脑梗死患者颈动脉粥样硬化的预测作用尚缺乏大量的循证医学证据。本研究是从CIMT和管腔内斑块稳定性两个方面去探讨AIP对评价脑梗死患者颈动脉粥样硬化的应用价值。
1 资料与方法
1.1 研究对象及分组 收集2016年1月-2018年12月在我院神经内科住院确诊为急性脑梗死的患者为研究组,诊断符合《中国急性缺血性脑卒中诊治指南2014版》[6],所有患者均经头部CT和/或MRI检查证实;选取同期我院体检中心的健康体检者为对照组,入选标准无脑血管病、脑血管病家族史及其他动脉粥样硬化相关疾病,其年龄和性别与研究组相匹配。根据CIMT情况[7]将两组分别分为CIMT正常和CIMT增厚两个亚组。研究组根据颈动脉内斑块回声性质[8],分为无斑块组、稳定斑块组(扁平斑和硬斑)和不稳定斑块组(软斑和溃疡性混合斑)3个亚组。
1.2 一般临床资料的采集 对所有的入选对象详细询问一般情况、生活方式、脑血管病危险因素及既往史,记录入选对象的年龄、性别及吸烟饮酒史,既往有无糖尿病及高血压病,根据公式BMI=体质量/身高2(kg/m2),计算体质量指数(body mass index,BMI)。
1.3 方法 (1)所有入组对象均在本院进行颈动脉超声检查;(2)研究组患者均需在前一夜22时后禁食水,次日凌晨6时采取静脉血,对照组于体检当日采血,血标本送我院检验科,准确记录血清甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C);(3)根据公式lg(TG/HDL-C)计算AIP值[4],AIP的统计多采用先乘以100后取对数,既可使最终的数据服从正态分布,还可避免出现负值[9]。
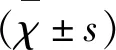
2 结 果
2.1 研究组与对照组之间一般资料和CIMT增厚率的比较 两组在性别(χ2=0.05,P=0.487)、年龄(t=0.39,P=0.70)方面的比较均无显著性差异,研究组中CIMT正常者52例(47.27%),CIMT增厚者58例(52.73%),对照组中CIMT正常者29例(72.50%),CIMT增厚者11例(27.50%);研究组中CIMT增厚率明显高于对照组,具有显著性差异(χ2=7.515,P<0.01)。
2.2 研究组中CIMT正常与CIMT增厚者间一般资料和AIP的比较 研究组中CIMT正常与增厚者间在性别、高血压、糖尿病的患病率、年龄、吸烟饮酒的年限、BMI方面的比较均无统计学差异(P>0.05),而在TC、TG、LDL-C和HDL-C方面的比较有统计学意义(P<0.05);研究组中CIMT增厚者的AIP均明显高于CIMT正常者(P<0.05)(见表1)。
2.3 研究组CIMT与AIP等因素的单因素相关分析 CIMT与AIP(r=0.603,P<0.05)、TG(r=0.216,P<0.05)、TC(r=0.339,P<0.05)和LDL-C(r=0.406,P<0.05)均呈正相关关系,而与HDL-C(r=0.388,P<0.05)呈负相关,差异均有统计学意义。
2.4 研究组CIMT与AIP等因素的多元逐步回归分析 通过多元逐步回归模型分析发现,CIMT与AIP和LDL-C呈正相关,且有统计学差异(P<0.05)(见表2)。
2.5 研究组颈动脉斑块的稳定性与AIP的关系 不稳定斑块组的AIP值高于稳定斑块组和无斑块组;稳定斑块组的AIP值高于无斑块组,差异均有统计学意义(P<0.05)(见表3)。
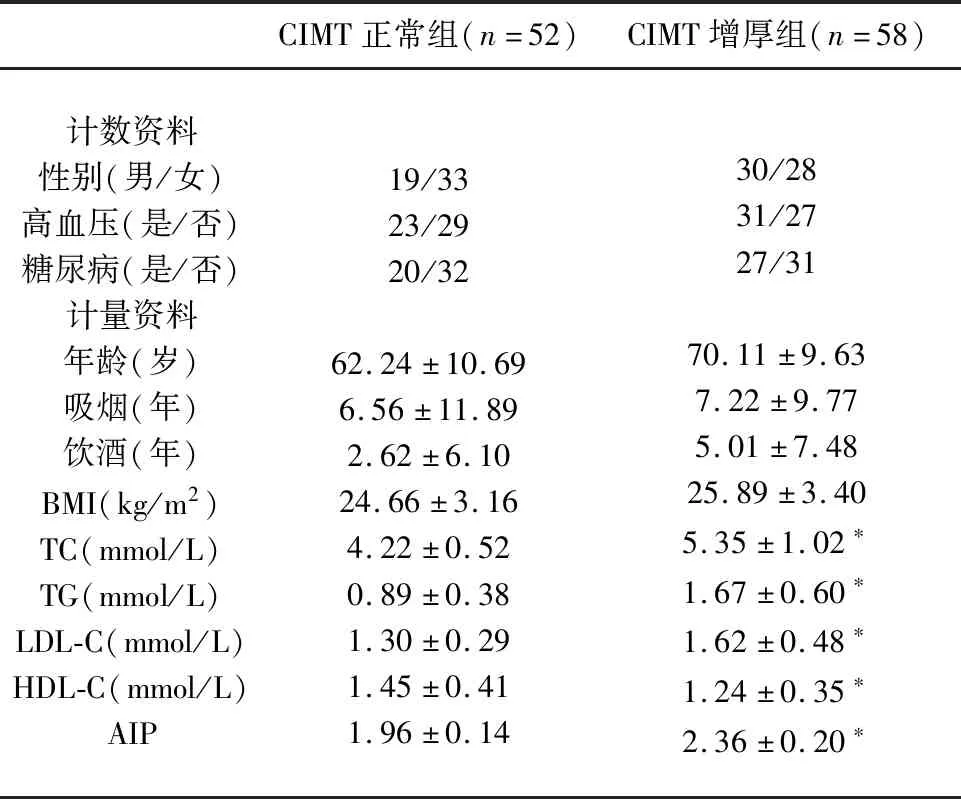
表1 研究组中CIMT正常与CIMT增厚者间一般资料和AIP的比较
与CIMT正常组相比*P<0.05

表2 研究组CIMT与多因素逐步回归分析

表3 研究组AIP与颈动脉斑块稳定性的关系
与无斑块组比较*P<0.05;与稳定斑块组比较#P<0.05
3 讨 论
动脉粥样硬化的特点是受累动脉病变从内膜开始,一般先有脂质和复合糖类积聚、出血及血栓形成,进而纤维组织增生及钙质沉着,并有动脉中层的逐渐蜕变和钙化,导致动脉壁增厚变硬、血管腔狭窄[10]。颈动脉粥样硬化是一种以血管内皮细胞损伤及其介导的炎症反应为核心的病理改变过程,是动脉硬化中最常见的类型,也是全身动脉硬化的一个缩影[11]。CIMT是动脉粥样硬化进程的早期标志[2]。中国老年高血压管理指南标明CIMT≥0.9 mm为CIMT增厚[7],本研究亦根据此标准进行分组。本研究结果证实,脑梗死患者的CIMT增厚率明显高于健康对照组(P<0.05),脑梗死患者中AIP与CIMT呈正相关(P<0.05),提示AIP是动脉硬化的病理生理基础。
斑块的稳定性与临床事件的发生与否密切相关[12],不稳定性斑块破裂是颈动脉粥样硬化性卒中发生的一个重要机制[13]。不稳定斑块多为软斑块,在表面溃疡形成后可继发炎性反应,而且易在血流剪切作用力的影响下破裂形成栓子阻塞远端血管,而稳定性斑块多有脂核及较厚的纤维帽,可牢固地固定在管腔内,造成急性缺血事件的风险相对较小[14]。随着颈动脉粥样硬化的发展,CIMT会随之增厚,其合并不稳定斑块的可能性随之增加。本研究结果显示不稳定斑块组中AIP值显著高于稳定斑块组和无斑块组(P<0.05),提示AIP与颈动脉内斑块的稳定性也存在着一定的相关性(P<0.05)。
脂代谢紊乱伴随动脉粥样硬化发生发展全程[11]。研究表明小而密LDL-C (small,low-density lipoprotein cholesterol,sdLDL-C)有更显著的致动脉硬化作用[15]。研究显示,LDL-C颗粒大小可作为预测缺血性心脑血管病危险性的最佳指标[16],但目前临床上直接检测LDL-C颗粒大小的技术复杂且价格昂贵,AIP是TG与HDL-C比值的对数,与LDL-C颗粒大小呈明显负相关,AIP升高即意味着LDL-C颗粒直径变小,那么sdLDL-C所占的比例则增高,测定AIP可间接反映LDL-C颗粒直径大小与sdLDL-C的比例,作为从血脂代谢方面来反映动脉粥样硬化的一项新指标。
本研究对AIP与传统血脂参数(TG、TC、LDL-C和HDL-C)与CIMT进行了单因素的相关性分析,CIMT除与HDL-C呈负相关外,与其他参数指标均呈正相关(P<0.05)。但在随后的多元回归分析发现仅AIP和LDL-C与CIMT的相关性存在统计学意义(P<0.05),提示AIP是CIMT的独立影响因素。
综上所述,AIP既可综合反映血脂水平、间接测量LDL-C直径又可评估CIMT以及动脉内斑块的稳定性,AIP值的大小可影响颈动脉粥样硬化的发生、发展,是评价脑梗死患者颈动脉粥样硬化更全面、简易的血脂指标。

