魔芋胶对咸蛋清蛋白热诱导凝胶特性的影响
谭芦兰 唐宏刚 杨慧娟 肖朝耿 孟祥河* 陈黎洪*任发政 郭慧媛 任大喜 程雅锦
(1 浙江工业大学海洋学院 杭州310014 2 浙江省农业科学院食品科学研究所 杭州310021 3 中国农业大学食品科学与营养工程学院 北京100038 4 浙江大学动物科学学院 杭州310029 5 浙江田歌实业股份有限公司 浙江金华321200)
我国90%的鸭蛋以咸鸭蛋制品消费,咸蛋清作为咸蛋黄生产的副产品,占咸鸭蛋中质量分数54.73%;在腌制过程中其蛋白质组成成分未发生变化,然而因含盐量高达7%~12%,而未能合理利用[1]。除了部分作为饲料及焙烤配料外,大部分的咸蛋清被当作废弃物处置,这不仅造成优质蛋白质资源的浪费,其发酵分解产物还会造成环境和水资源的污染[2]。
咸蛋清蛋白具有凝胶性、持水性、起泡性和乳化性等多种功能特性,其凝胶特性在食品工业中有着广泛应用[3]。咸蛋清蛋白在腌渍过程中受到大量NaCl 的影响,功能特性发生变化,如何进一步改善咸蛋清蛋白的功能特性是国内外研究的热点[4]。蛋白质改性主要是改变蛋白质氨基酸残基和多肽链结构,引起蛋白质大分子的空间结构变化,导致其理化性质改变,从而获得更好的功能特性[5]。目前常用的方法包括物理法、化学法和生物酶法等[6]。
魔芋胶(konjac gum,KGM)也称魔芋葡甘聚糖,是一种应用广泛且经济的多糖。因其具有优良而独特的胶凝性能,可在一定条件下形成热可逆凝胶和热不可逆凝胶[7],在酸奶、果汁、果冻食品以及肉制品的加工与生产中,魔芋胶应用广泛。刘虎成等[8]研究表明复配魔芋胶可以提高肉制品水分含量、嫩度,以及改善肉制品的质构。魔芋胶在人体中可被水解为低聚糖,而低聚糖具有预防血糖值上升,降低胆固醇等功效[9-10]。食品是由多种成分构成的复杂体系,在一定的条件下 (温度、pH值、离子强度等),蛋白质和多糖等大分子聚合物上的部分基团可能发生某些作用,从而赋予聚合物一些独特的功能,这不仅影响食品的营养特性,也影响食品的感官性状和理化特性[11-12]。
本试验探讨魔芋胶和咸蛋清相互作用,改善咸蛋清蛋白的凝胶特性,为咸蛋清蛋白的进一步利用提供思路与方法。
1 材料与方法
1.1 材料与试剂
咸鸭蛋蛋清,绍兴百顺科技有限公司;魔芋胶,上海源叶生物科技有限公司;磷酸二氢钠、十二水合磷酸氢二钠、无水乙醇等试剂(均为分析纯级),国药集团化学试剂有限公司。
1.2 仪器与设备
TA.XT.plus 物性测定质构仪,英国Stable Micro System 公司;SC-1 智能式测色色差计(D65 光源,Φ=2 cm),温州仪器仪表公司;Spectrumlab54紫外-可见分光光度计,上海棱光技术有限公司;UV-1800 紫外-可见分光光度计,上海精密仪器仪表有限公司;Scientz-18N 冷冻干燥机,宁波新芝冻干设备股份有限公司。
1.3 方法
1.3.1 样品处理 通过Biuret 方法[13]测定样品蛋白质质量分数约为12%,NaCl 质量分数8.04%。
将50 g 液体咸蛋清分别与0.00,0.01,0.02,0.03,0.04,0.05 g 的魔芋胶混合在100 mL烧杯中,搅拌均匀,制备0.0%,0.2%,0.4%,0.6%,0.8%,1.0%的咸蛋清蛋白-魔芋胶混合体系。将混合好的溶液在25 ℃磁力搅拌30 min,反应完毕后,将改性后的蛋清蛋白溶液置于4 ℃冰箱中冷藏备用。
1.3.2 凝胶制备 分别取20 mL 魔芋胶添加各组 咸蛋清蛋白-魔芋胶混合体系,加入30 mL 培养皿中,保鲜膜封口,于90 ℃水浴锅中恒温水浴30 min,取出后放入冰水中冷却至常温,4 ℃冰箱冷藏过夜,测定各指标。
1.3.3 凝胶质构(TPA)分析 样品凝胶质构分析参照Li[14]的方法并稍作修改。将各组样品制备的凝胶切成10 mm×10 mm×10 mm 大小,使用装有扁平柱塞(型号SMS-P/35)的TA.XT.plus 质构分析仪进行质地分布分析。设置参数为:2 mm/s 的速度压缩样品至原始高度的50%,触发点负载为5 g,两个压缩循环间隔5 s。在Texture Expert 软件上由力-时间变形曲线计算硬度、黏性、咀嚼性、弹性、内聚性和弹性等参数。
1.3.4 凝胶持水力的测定 样品凝胶持水性测定参照迟玉杰[15]的方法并适当修改。取一定质量(M1)的凝胶放入50 mL 的离心管中,在4 ℃下以8 000 r/min 转速离心20 min,取出后用滤纸吸干凝胶表面水分,测定离心后的质量(M2)。每组样品做3 次平行试验,结果取平均值。以样品凝胶离心前、后的质量分数表示。计算公式:
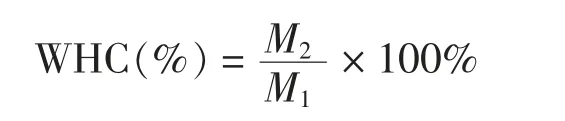
1.3.5 色度分析 用色差仪测定咸蛋清凝胶样品色度,每3 d 测1 次,每个样品取3 个部位测定,取平均值。分析样品前,用标准白板校正色差计,测定样品b*值(黄度值,正数代表黄色,负数代表蓝色)、a*值(红度值,反映样品的红色程度,正数代表红色,负数代表绿色)、L*值(亮度值,反映色泽的亮度)。
1.3.6 凝胶电镜扫描 凝胶微观结构分析参照Salvador 等[16]的方法并稍作改动。将制备好的各组凝胶样品中心部位切成2 mm×2 mm×2 mm 的方块,用2.5%的戊二醛溶液浸泡固定,4 ℃条件下放置12 h。固定好的样品在室温条件下用0.02 mol/L磷酸盐缓冲液(pH 7.4)漂洗3 次,每次5 min,然后依次用体积分数50%,60%,70%,80%,90%及100%的乙醇溶液分别浸泡10 min,逐级脱水,之后用叔丁醇浸泡3 次,每次5 min,然后将处理好的样品冷冻干燥。干燥后的样品用导电双面胶固定到样品台上,经溅射仪喷金,置于扫描电镜下观察样品的表观形貌。
1.3.7 表面疏水性 参照Nakai 等[17]方法并稍作修改,测定样品表面疏水性。用0.02 mol/L 磷酸盐缓冲液 (pH 7.4) 将样品分别配制成1,2,3,4,5 mg/mL 的蛋白溶液。取不同质量浓度的样品各4 mL,加入20 mL 8-苯胺萘磺-1-酸盐(ANS)溶液作为荧光探针并于室温条件下保持1 h。设置激发波长370 nm,发射波长470 nm,用荧光光谱仪测定样品的荧光强度,以未加8-苯氨基-1-萘磺酸的蛋白溶液的荧光强度为空白。用相对荧光强度对蛋白质浓度作图,采用最小二乘法进行曲线拟合,直线斜率即蛋白质的表面疏水性。
1.3.8 巯基含量测定 参照迟玉杰等[18]的方法测定样品中的巯基含量变化。取4 mL 0.1 mol/L Tris-甘氨酸缓冲液(pH 8.0),其中含0.01 mol/L 的乙二胺四乙酸(EDTA),加到1 mL 4 g/100 mL 蛋白质溶液中,40 ℃保温30 min,加入125 μL 的5,5-二巯基-2,2-二硝基苯甲酸(DTNB)试剂(20mg DTNB 溶于5 mL pH 8.0 的0.1 mol/L Tris-甘氨酸缓冲液),25 ℃显色10 min,测定波长412 nm 处的吸光度,以1.36×104L/(mol·cm)消光系数计算表面巯基含量。
测定总游离巯基含量时,在Tris-甘氨酸缓冲液中添加0.25 g/100 mL SDS,蛋白质含量为0.4 g/100 mL,其它操作条件与测定表面巯基含量一致。
1.3.9 数据处理 采用SPSS 20.0 统计软件进行相关性分析和方差分析,Duncan 法进行多重比较(P<0.05,差异显著),采用Origin 9.1 软件绘图。
2 结果与分析
2.1 咸蛋清蛋白凝胶质构的变化
由图1可得,随着魔芋胶添加量的增加(0.0%~1.0%),咸蛋清蛋白凝胶的硬度、胶着性、咀嚼性、弹性、内聚性及回复力不断升高,且魔芋胶添加量越多,增加效果越明显。当魔芋胶添加量为0.6%,08%和1.0%时,咸蛋清蛋白凝胶硬度间不存在显著性差异(P>0.05)且咸凝胶硬度显著高于其余3组,比对照组提高了16.42%。与对照相比,最佳胶着性增加113.33%,咀嚼性增加168.18%,弹性增加26.08%,内聚性增加81.25%,回复力增加21.43%,与凝胶硬度呈现相似的变化趋势。
蛋白聚集是凝胶形成过程中重要的一步,其受到温度、金属离子及蛋白浓度等的影响。在加热过程中,蛋清蛋白约在60 ℃时失去流动性,继而形成具有独特纹理的凝胶。另有研究表明,高浓度的NaCl 不利于蛋清的热聚集和凝固型凝胶的形成[19]。本文中,在温度与NaCl 含量一定的情况下,魔芋胶改变咸蛋清凝胶性能是由于魔芋胶结构中的葡甘露聚糖与咸蛋清中的卵白蛋白产生交联反应,促进了蛋清蛋白凝胶网络的形成,最终使咸蛋清蛋白凝胶网络更加致密与稳定[20]。已有研究发现魔芋葡甘聚糖分子中含有大量羟基、羰基等亲水性基团,使其具有较强的亲水能力,而咸蛋清蛋白质兼具亲水亲油性,魔芋葡聚糖的亲水基团能与蛋白质的亲油基团发生氢键作用形成紧密的结构[21]。当魔芋胶添加量0.8%~1.0%时,凝胶硬度、咀嚼性及胶着性上升缓慢,推测此时魔芋胶与蛋清蛋白的结合趋于饱和。
2.2 咸蛋清蛋白凝胶持水能力变化
水是重要的食物组分,对食物的货架稳定性、结构特点、品质属性和加工工艺等均有十分重要的影响[22-23]。从图2可知,随着魔芋胶添加量的增加,咸蛋清蛋白凝胶的持水力出现先逐渐升高继而缓和的迹象。当魔芋胶添加量为0.8%时,与对照组相比,持水力增加26.13%,在一定程度上蛋清凝胶的持水性说明蛋白质结合水分的能力[24]。这是由于魔芋胶中的魔芋葡甘聚糖中含有大量的亲水基团,它能结合大量水分,通过氢键、分子偶极、诱导偶极、瞬间偶极等作用力与水分子结合形成难于自由运动的巨大分子,促使魔芋葡甘聚糖大分子建立网络结构,从而增加其保水性[25]。另外,魔芋胶形成的多孔凝胶结构也增加了对水分的束缚作用。
2.3 咸蛋清蛋白凝胶物理外观变化
由表1可以看出,咸蛋清蛋白凝胶的色差亮度值(L*)在魔芋胶添加量0.8%与1.0%时与其它添加量时差异显著(P<0.05)。当魔芋胶添加量为1.0%时,与对照组相比,凝胶色差亮度值(L*)增加2.41%。亮度值(L*)的增加是由于在加热过程中咸蛋清蛋白凝胶网络的形成与魔芋胶添加量有关,魔芋胶添加量增加提高了咸蛋清凝胶的保水性和凝胶质构的紧密程度,从而使得凝胶色差的亮度值(L*)有所增加。色差的红度值(a*)与黄度值(b*)与亮度值(L*)的变化相反,呈现略微下降的趋势。其中凝胶色差红度值(a*)下降1.76%,黄度值(b*)下降6.38%,这主要是由于魔芋胶使蛋清蛋白凝胶的保水性能增加,所以导致凝胶透明性增加,红度值(a*)与黄度值(b*)相对偏低。
2.4 咸蛋清蛋白凝胶微观结构变化
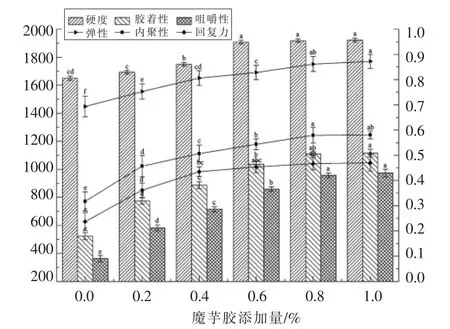
图1 不同魔芋胶添加量时咸蛋清蛋白的凝胶质构变化Fig.1 Texture changes of white protein gel from salted duck egg at different amounts of konjac gum

图2 不同魔芋胶添加量时咸蛋清蛋白的凝胶持水力变化Fig.2 Changes in gel Water Holding Capacity of white protein from salted duck egg at different amounts of konjac gum

表1 不同魔芋胶添加量时咸蛋清蛋白凝胶色度变化Table 1 Variation in chroma of white protein gel from salted duck egg at different amounts of konjac gum
在加热过程中,蛋白质结构逐步展开,随后聚集,最终产生更加紧致的网络结构,蛋白质分子变性后迅速聚集并形成有序的蛋白质网络结构的过程称为胶凝作用[26]。通过扫描电镜可以观察到蛋白质聚集体的形状、排列及孔隙大小,是从微观结构上观察凝胶网络结构的一种有效方法[27]。如图3所示,随着魔芋胶浓度的增大,复合凝胶体系的表观结构逐渐由疏松多孔转向紧密平滑。在100 倍电镜下,未添加魔芋胶的样品A0,凝胶表面的微观结构疏松且有较多空隙,随着魔芋胶添加量的增加,A1 至A5 样品凝胶逐渐变得光滑、均匀。在500 倍电镜下,未加入魔芋胶的B0 凝胶表面很不平整并有明显的孔洞。值得注意的是:当魔芋胶质量分数0.6%~1.0%时,样品B3、B4、B5 的凝胶表面逐渐平整与紧密,此时咸蛋清蛋白的凝胶强度和持水性也是最大的。
2.5 咸蛋清蛋白表面疏水性变化
由图4可知,魔芋胶添加量增加,咸蛋清蛋白质的疏水性也增加,当魔芋胶添加量为1.0%时,与对照组相比,表面疏水性增加111.11%。蛋清蛋白质表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量,由于疏水性能够反映蛋白质结构的微妙变化,因此它是评价蛋白质理化和功能性质的一个重要参数[28]。对于凝胶形成而言,疏水作用是维持凝胶结构的重要作用力,而蛋白质的表面疏水性与分子间疏水作用紧密相关,蛋白质高级结构展开后疏水性脂肪族与芳香族氨基酸侧链基团的暴露会导致蛋白质疏水性的变化,因此,表面疏水性可反映蛋白质解折叠的程度[29]。有研究证实,在6%NaCl 条件下蛋清蛋白表面疏水性低速增长,当加热温度80~90 ℃时,表面疏水性恒定或显著降低[30]。本试验中,随着魔芋胶添加量的增加,样品蛋白质表面疏水性增加,这是由于蛋白质的分子链伸展以及分子内部的疏水基团不断暴露所致[31]。蛋白质的表面疏水性在凝胶形成的初期,对立体网状结构的形成起着非常重要的作用[32]。

图3 不同魔芋胶添加量时咸蛋清蛋白凝胶微观结构变化Fig.3 Microstructure changes of white protein gel from salted duck egg at different amounts of konjac gum
2.6 咸蛋清蛋白中巯基含量变化
如图5所示,随着魔芋胶添加量的增加,咸蛋清蛋白中总巯基含量从129.69%降到72.50%,而表面巯基的含量从11.34%增到62.64%。这可能是由于咸蛋清蛋白与魔芋胶在相互作用过程中,蛋白质的构象发生变化。在热力作用下,加入魔芋胶后的咸蛋清蛋白质分子结构展开,使分子内部包埋的巯基不断暴露出来,导致表面巯基含量的增加。随着暴露于表面的巯基数的增多,分子间的相互作用也增强,蛋清蛋白的凝胶性能因此提高。另外,由于蛋白质分子内部或分子间的巯基氧化反应或巯基与二硫键交换反应形成更多二硫键,最终导致总巯基含量下降[33]。
分子间二硫键是维持凝胶结构的重要作用力。通过分析糖基化蛋白表面游离巯基与总游离巯基含量的变化,可以研究糖基化反应过程中蛋白质分子的空间伸展状况。有研究表明,蛋白的总巯基数和表面巯基数对蛋白质的凝胶性能起明显的作用,而巯基和二硫键是蛋白质分子中稳定蛋白质构象的重要化学键,会影响蛋白质凝胶性、持水性等功能特性[34]。
3 结论

图4 不同魔芋胶添加量时咸蛋清蛋白表面疏水性变化Fig.4 Changes in surface hydrophobicity of white protein from salted duck egg at different amounts of konjac gum

图5 不同魔芋胶添加量时咸蛋清蛋白巯基含量变化Fig.5 Variation of sulfhydryl content of white protein from salted duck egg at different amounts of konjac gum
添加魔芋胶可以改善咸蛋清蛋白凝胶的硬度,当其添加量0.6%~1.0%时,各组样品数据间没有显著性差异(P>0.05),与对照组相比凝胶硬度提高了16.42%;在魔芋胶添加量为0.8%时样品的持水力最佳,比对照组增加26.13%;随着魔芋胶的添加量增加,样品凝胶表面微观结构由疏松多孔逐渐转为平滑均匀。这些变化与添加魔芋胶后咸蛋清的表面疏水性及巯基含量的变化相关。随着魔芋胶添加量的增加,咸蛋清的表面疏水性增加。表面疏水性在蛋清蛋白凝胶网络形成初期,对立体网络结构的形成有重要作用。另外,咸蛋清的表面巯基在魔芋胶的作用下不断增加,总巯基含量减少,分子间的相互作用增强,使咸蛋清蛋白的凝胶性能提高。
本文中,通过直接添加魔芋胶,显著改善鸡蛋清凝胶的凝胶强度、凝胶持水力、色度值及表面微观结构。通过对咸蛋清的表面疏水性与巯基含量变化的分析,进一步阐释魔芋胶改善咸蛋清凝胶特性的机理。然而,咸蛋清本身含有大量的NaCl,凝胶性能在金属离子的作用下有所改变。关于金属离子、蛋白质和多糖3 种物质间的相互作用,以及直接添加多糖提高蛋白质凝胶凝胶强度的研究还比较有限,值得进一步探究。

