miR-378对异体移植过程中骨髓间充质干细胞存活的影响①
叶 勖 陈明伟 高 宇 李梦洁 王 彤 邢珊珊 黄 畅 沈益民
(浙江医院血液科,杭州 310030)
1 材料与方法
1.1材料
1.1.1试剂 DMEM/F12培养基购自美国Invitrogen公司;抗体CD29-PE、CD44-FITC、CD105-FITC、CD45-PE、CD34-FITC、IgG1-FITC和IgG2a-PE均购自美国Becton Dickinson公司;一抗anti-caspase-3和anti-GAPDH 购自美国Cell signaling technology公司;二抗HRP AffiniPure Goat Anti-Rabbit 购自武汉三鹰生物技术有限公司;Annexin-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;噻唑蓝(MTT)、二甲亚砜(DMSO)购自美国Sigma公司;Europium标记试剂盒购自美国Abnova公司;Lipofectamine®RNAiMAX转染试剂购自美国Thermo Fisher Scientific公司;miR-378 mimic、inhibitor及阴性对照由上海吉玛制药技术有限公司提供。
1.1.2实验动物 SPF级健康雄性SD大鼠20只,鼠龄4~5周,体质量100~150 g,购自湖南斯莱克景达实验动物有限公司,合格证号:SCXK (湘)2013-0004,同一条件下标准饲养。
1.2方法
1.2.1rBMSCs的分离与培养 采用10%水合氯醛(500 mg/kg)腹腔注射麻醉大鼠,无菌条件下暴露大鼠双侧股骨,使用20 ml注射器针头在股骨两端钻直径约1.5 mm的小孔,使用规格为5 ml的注射器吸取5 ml含10%FBS的DMEM/F12(1∶1)完全培养基,从股骨一端缓慢冲洗骨髓腔,另一端收集细胞悬液,缝合大鼠皮肤,术后肌肉注射庆大霉素抗菌。采用200目筛网对收集的细胞悬液进行过滤,1 500 r/min 离心5 min,吸取乳白色、云雾状液体层,PBS重悬后再次离心,1 400 r/min离心4 min,弃上清,重复操作2次。采用DMEM/F12完全培养液重悬细胞,并接种到细胞培养瓶中,置于37℃、5% CO2的培养箱中培养,48 h后半量换液,随后2~3 d换液1次,待细胞达到90 %的密度时进行传代。
1.2.2rBMSCs的鉴定 取第3代生长状态良好的rBMSCs,制成细胞悬液(1×105个/ml),分别加入异硫氰酸荧光素(FITC)或藻红蛋白(PE)荧光标记的CD29-PE、CD44-FITC、CD105-FITC、CD45-PE、CD34-FITC和同型阴性对照IgG1-FITC和IgG2a-PE,避光冰上孵育45 min,PBS洗涤细胞3次,流式细胞仪检测rBMSCs表面抗原CD29、CD44、CD105、CD45和CD34的表达情况。另取第3代生长状态良好的rBMSCs,接种于6孔板中培养,待生长达到60%融合后,在各种诱导孔中加入成骨诱导培养基2 ml(内含诱导剂1 mmol/L地塞米松、1 mol/L β-甘油磷酸钠和50 mmol/L抗坏血酸)。每隔3 d更换一次成骨诱导培养基,诱导21 d后,经4%多聚甲醛固定,对诱导分化的成骨细胞进行茜素红和碱性磷酸酶染色观察。
1.2.3细胞转染及miR-378 检测取第3代生长状态良好的rBMSCs接种于6孔板,按照Lipofectamine®RNAiMAX转染试剂说明书分别转染miR-378 mimic、miR-378 inhibitor以及阴性对照(NC),终浓度为10 μmol/L。37℃培养4~6 h后更换完全培养基继续培养,细胞转染24 h后进行后续实验。按照Trizol试剂盒说明书提取各转染后细胞总RNA,按照逆转录试剂盒说明书进行逆转录反应(16℃,30 min;42℃,40 min;85℃,5 min)合成cDNA,并配置PCR反应体系进行PCR扩增,PCR反应条件:95℃,30 s;95℃ 5 s,60℃ 30 s,40个PCR循环。以U6作为内参,采用2-ΔΔCt法计算miR-378相对表达量。引物序列,miR-378-RT:5′-GTCGTAATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGAT-ACGACGCCTTCT-3′;miR-378-F:5′-GGGACTGGAC TTGGAGTCA-3′;miR-378-R:5′-GTGCGTGTCGTGG-ACTCG-3′。
1.2.4血清制备及分组处理 大鼠颈静脉取血3 ml,加入0.2 ml抗凝剂EDTA·Na2混匀,静置30 min,4℃,3 500 r/min,离心15 min,取上层血清,-20℃保存备用。按照后续实验需要分组如下:①空白对照组(Control):rBMSCs不与大鼠异体血清(Allogeneic rat serum,ARS)共孵育;②异体血清组(ARS):rBMSCs与10%的ARS共孵育;③miR-378 inhibitor+ARS组(inhibitor+ARS):转染miR-378 inhibitor后的rBMSCs与10%的ARS共孵育;④miR-378 mimic+ARS组(mimic+ARS):转染miR-378 mimic后的rBMSCs与10%的ARS共孵育;⑤阴性对照+ARS组(NC+ARS):转染miR-378 阴性对照后的rBMSCs与10%的ARS共孵育。
党的十八大以来,习近平总书记鲜明提出了新时代好干部标准和忠诚干净担当、“三严三实”、“四有”、“四个铁一般”等要求,特别是在2018年全国组织工作会上,他进一步指出,选干部就是要坚持好干部标准,把政治标准放在第一位。政治标准是硬杠杠,如果政治标准不合格,能耐再大也不能用。习近平总书记这些选人用人思想,归结起来就是干部首先要在政治上达标,选人用人首先要看政治素质。
1.2.5MTT检测 取对数生长期的各组细胞,以1×103个/孔接种于96孔板中,待生长达到90%融合后分组处理,37℃共孵育2 h。弃培养基,每孔加入20 μl MTT (5 mg/ml),避光孵育4 h,弃上清再加入100 μl DMSO,轻轻振荡10 min,待紫色甲瓒颗粒完全溶解后,使用酶标仪在波长为570 nm处测量OD值,取均值计算细胞存活率。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
1.2.6流式细胞术检测细胞凋亡 取对数生长期的各组细胞,以3×105个/孔接种于6孔板中,待生长达到90%融合后分组处理,37℃共孵育2 h。按照细胞凋亡检测试剂盒说明书,0.25%胰酶消化收集细胞,制备细胞悬液,调整细胞浓度为1×105个/ml,经离心、洗涤后加入500 μl incubation buffer悬细胞,再分别加入5 μl Annexin-FITC和5 μl PI充分混匀,避光孵育15 min,上流式细胞仪进行检测。
1.2.7Western blot检测caspase-3蛋白的表达 取各组细胞种植于培养皿中,待生长达到90%融合后分组处理,37℃共孵育2 h。收集细胞沉淀,加入适量RIPA全蛋白裂解液,冰上充分裂解30 min后,4℃,12 000 r/min离心20 min,收集上清,采用Bradford法进行蛋白定量。取25 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,将蛋白转移至PVDF膜上后,使用5%脱脂牛奶室温孵育1 h,根据蛋白marker显示的位置进行裁膜,分别加入一抗 anti-caspase-3(1∶1 000)和anti-GAPDH(1∶1 000),4℃孵育过夜。TBS洗涤3次,加入二抗HRP AffiniPure Goat Anti-Rabbit IgG(1∶10 000)室温孵育1 h,TBS洗涤3次,ECL发光显色,采用全自动数码凝胶图像分析系统自动显影与数据分析。
1.2.8BMSCs活体移植的杀伤检测 取生长状态良好的rBMSCs以及转染miR-378 inhibitor、mimic和 NC后的rBMSCs进行培养,0.25%胰酶消化,4℃,1 500 r/min 离心5 min,制备成3×106个/ml的细胞悬液,分别加入10 μmol/L的Europium,37℃共孵育30 min。被Europium标记的各组细胞,取0.5 ml 细胞悬液(5×105个)通过尾静脉移植到异体大鼠体内,每组3只大鼠。分别于注射后20、40、60和80 min眼眶静脉取血,分离血清。按照1∶50比例使用PBS稀释血清,荧光分光光度计在激发波长650 nm和发射波长660 nm处检测rBMSCs破损后泄露到大鼠体内的Europium浓度,以泄露到血清中Europium浓度的高低间接评估rBMSCs异体移植到活体内的存活率。计算活体移植细胞杀伤率,其计算公式如下:杀伤率=(A-B)/(C-B)×100%,其中A为释放的平均量,B为最低释放量,C为最大释放量。
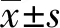
2 结果
2.1rBMSCs的鉴定 由图1可见,第3代rBMSCs细胞表面CD29、CD44和CD105呈阳性表达,阳性表达率依次为(83.4±4.3)%、(93.1±3.9)%和(75.9±2.3)%;而CD45和CD34呈阴性表达,表达率仅为(3.0±0.9)%和(4.6±1.1)%。rBMSCs体外成骨诱导21 d后,茜素红染色结果显示rBMSCs矿化能力显著增强,存在大量红色阳性克隆的钙化结节;碱性磷酸酶染色结果显示rBMSCs出现较多蓝黑色颗粒和块状深染颗粒,部分细胞膜呈现黑色线状,如图2所示。
2.2rBMSCs中miR-378表达 如图3所示,miR-378 mimic及inhibitor转染rBMSCs后,与Control组比较,miR-378 mimic可显著提高rBMSCs中miR-378的表达(P<0.05)。同时,与Control组比较,miR-378 inhibitor也可显著抑制rBMSCs中miR-378的表达(P<0.05)。NC组rBMSCs中miR-378与Control组比较差异无统计学意义(P>0.05)。
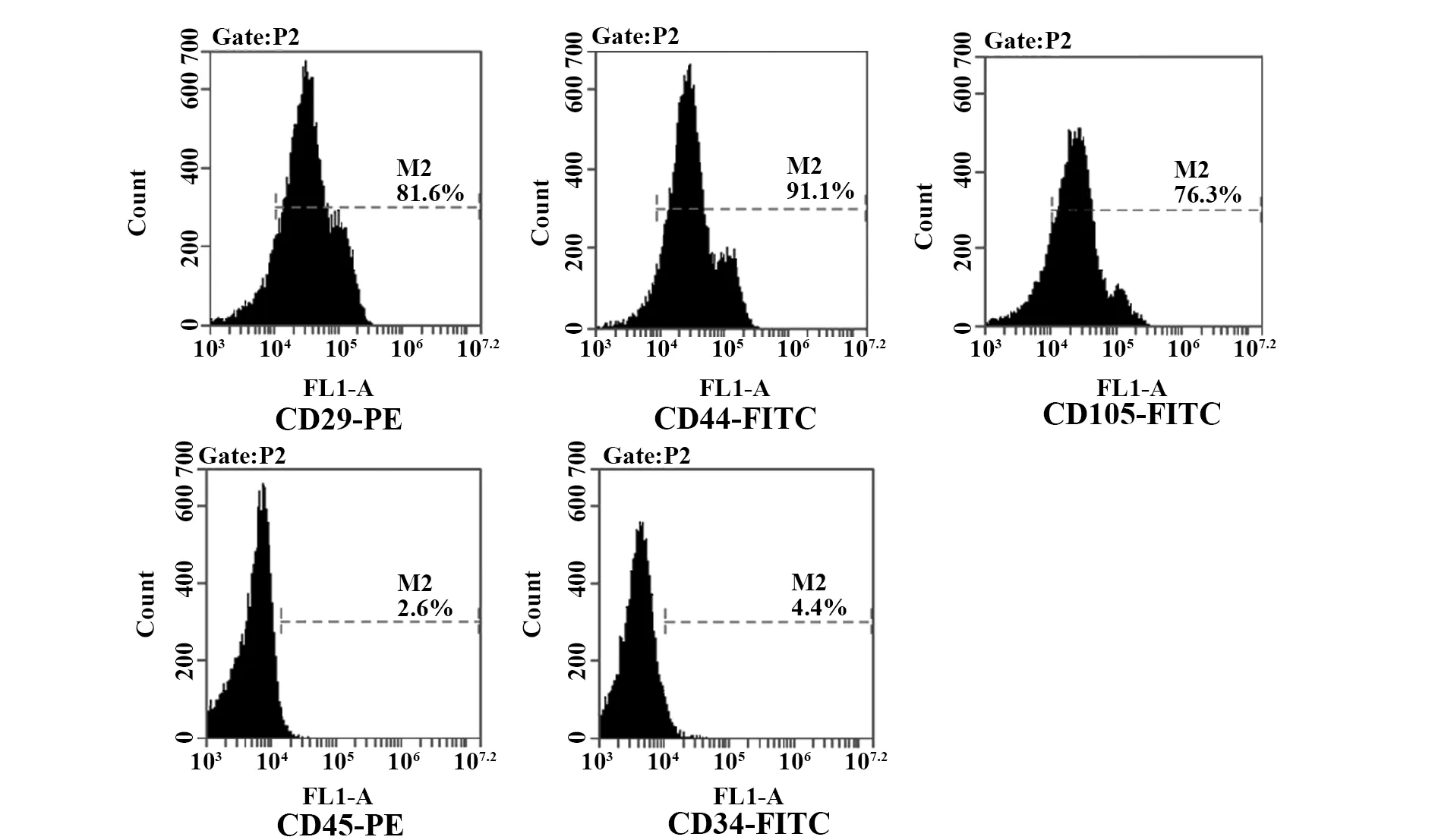
图1 流式细胞术检测rBMSCs细胞表面标志物的表达Fig.1 Detected expression of surface markers of rBMSCs by flow cytometry
2.3miR-378对异体血清干预下rBMSCs存活率的影响 如图4所示,与Control组比较,ARS组细胞存活率显著降低(P<0.05)。与ARS组比较,inhibi-tor+ARS组存活率显著降低(P<0.05)。另外,mim-ic+ARS组细胞存活率显著高于ARS组(P<0.05)。NC+ARS组细胞存活率与ARS组比较差异无统计学意义(P>0.05)。
2.4miR-378对异体血清干预下rBMSCs凋亡的影响 如图5所示,与Control组凋亡率(10.1±1.4)%比较,ARS组凋亡率(30.7±3.3)%显著增高(P<0.05)。与ARS组比较,inhibitor+ARS组凋亡率(39.1±4.7)%显著升高(P<0.05);另外mimic+ARS组凋亡率(18.7±1.9)%与ARS组比较则显著降低(P<0.05)。Western blot结果显示,与Control组比较,ARS组Caspase-3蛋白切割激活显著增高(P<0.05);与ARS组比较,mimic+ARS组Caspase-3蛋白切割激活则又显著下调。另外,inhibitor+ARS组Caspase-3切割蛋白表达相较于ARS组则又显著上调(P<0.05),如图6。
2.5miR-378对活体移植中rBMSCs存活的影响
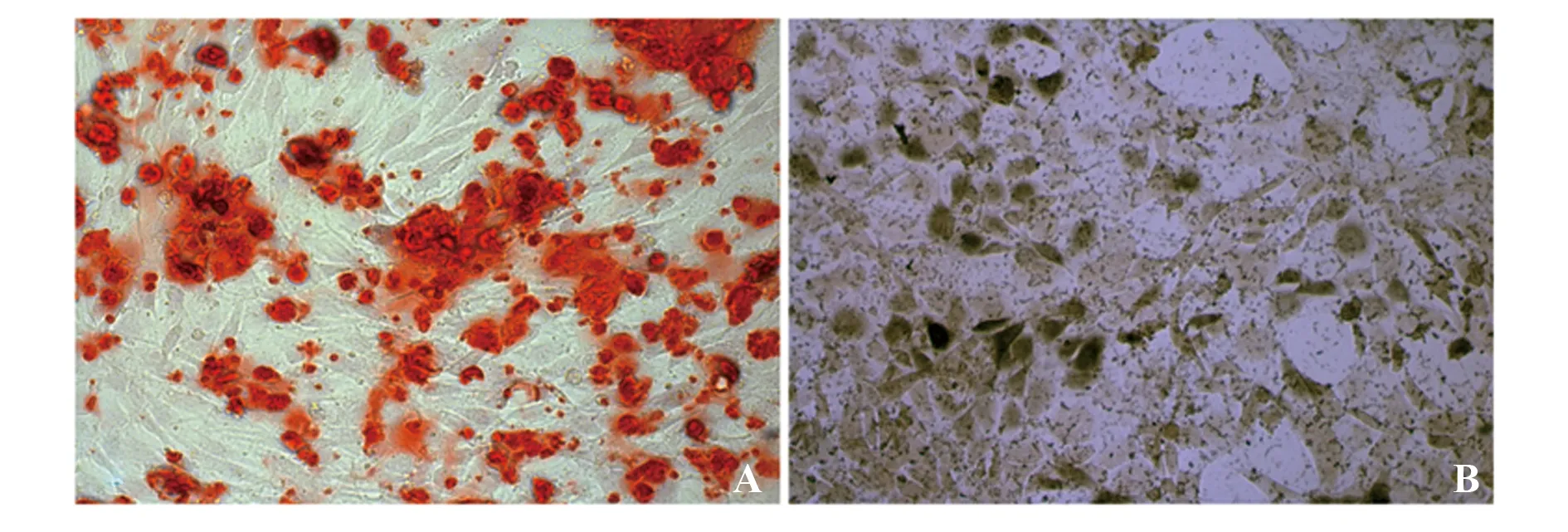
图2 rBMSCs成骨分化诱导21 d后染色观察(×200)Fig.2 Osteoblasts induction of rBMSCs at 21 d (×200)Note: A.Alizarin red staining;B.Alkaline phosphatase staining.
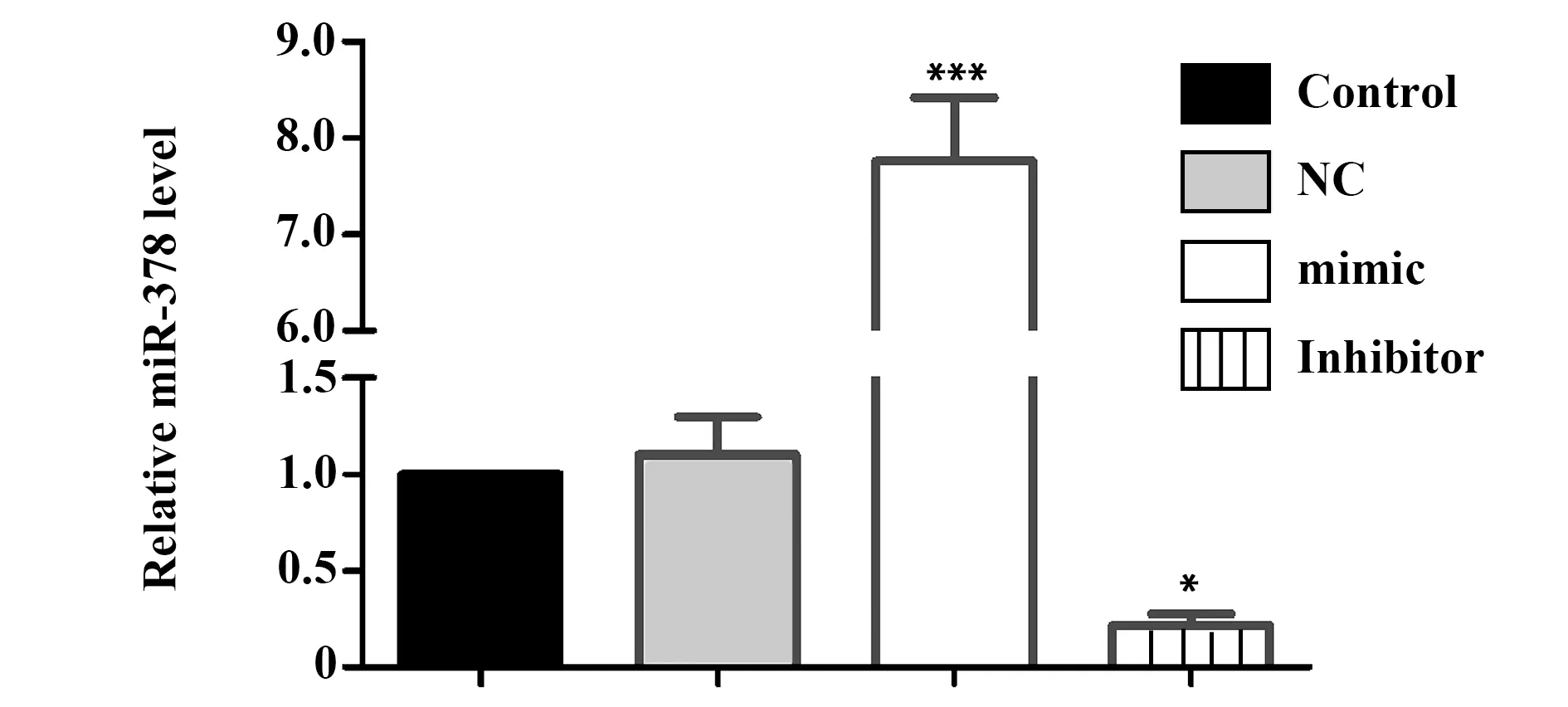
图3 RT-PCR检测转染后rBMSCs中miR-378的表达Fig.3 Detected expression of miR-378 in transfected rBMSCs by RT-PCRNote:
如图7所示,各组rBMSCs活体移植后,随着时间的延长,各组rBMSCs在大鼠体内损伤情况呈上升趋势。在活体内miR-378 mimic转染的rBMSCs所受到的杀伤率在各时间点都要低于Control组,且在活体移植后的80 min时显著低于Control组(P<0.05)。miR-378 inhibitor转染的rBMSCs所受到的杀伤率在各时间点都要高于Control组,且在移植后60 min时,其所受杀伤率显著高于Control组(P<0.05)。而NC组与Control组比较差异无统计学意义(P>0.05)。
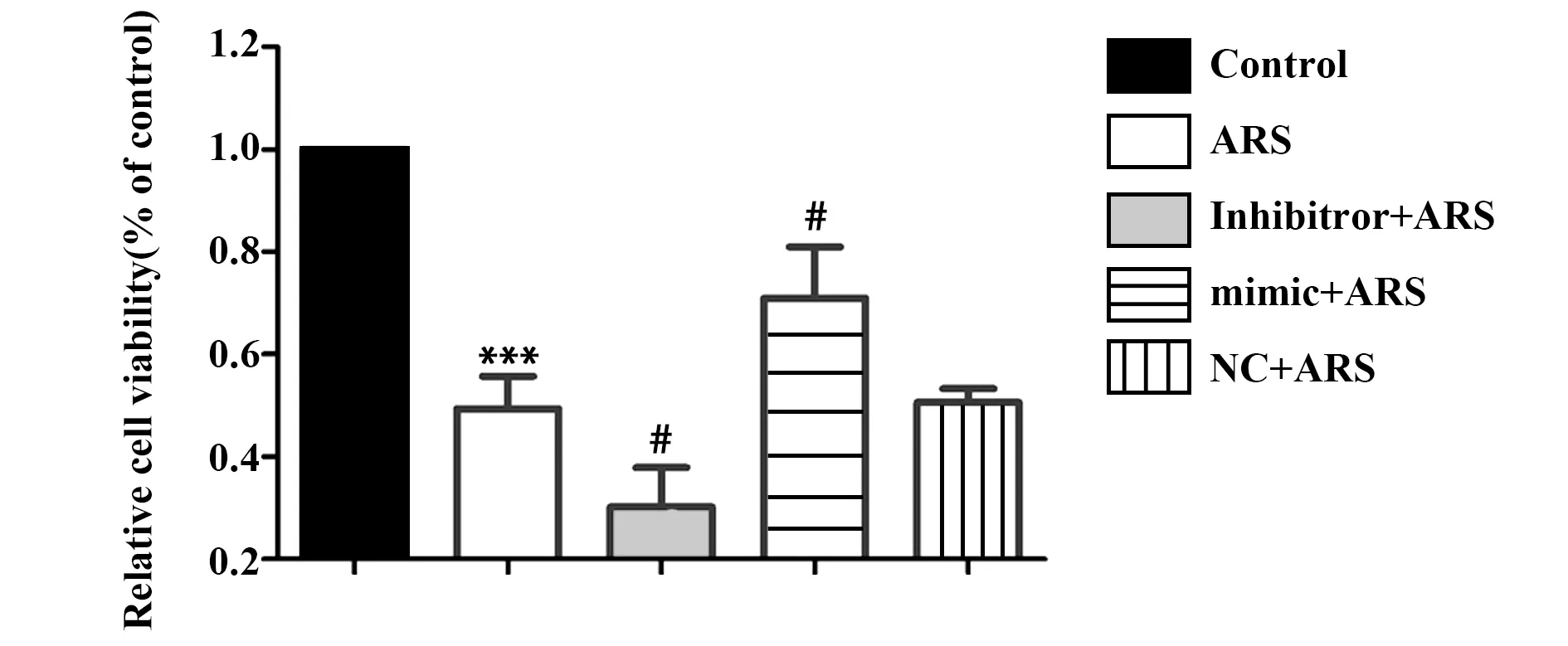
图4 异体血清对各组rBMSCs存活率的影响Fig.4 Effect of allogeneic serum on survival rate of rBMSCsNote: vs control group;#.P<0.05 vs ARS group.
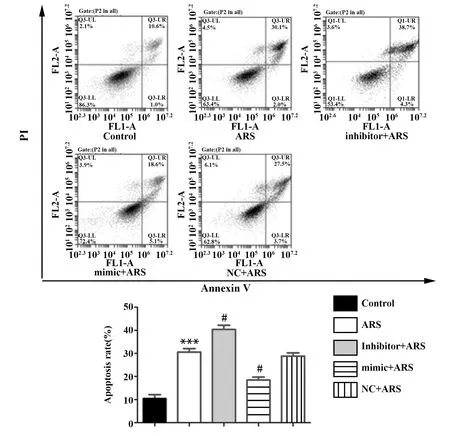
图5 流式细胞术检测异体血清对rBMSCs凋亡的影响Fig.5 Detected effect of allogeneic serum on apoptosis of rBMSCs by flow cytometryNote: vs control group;#.P<0.05 vs ARS group.
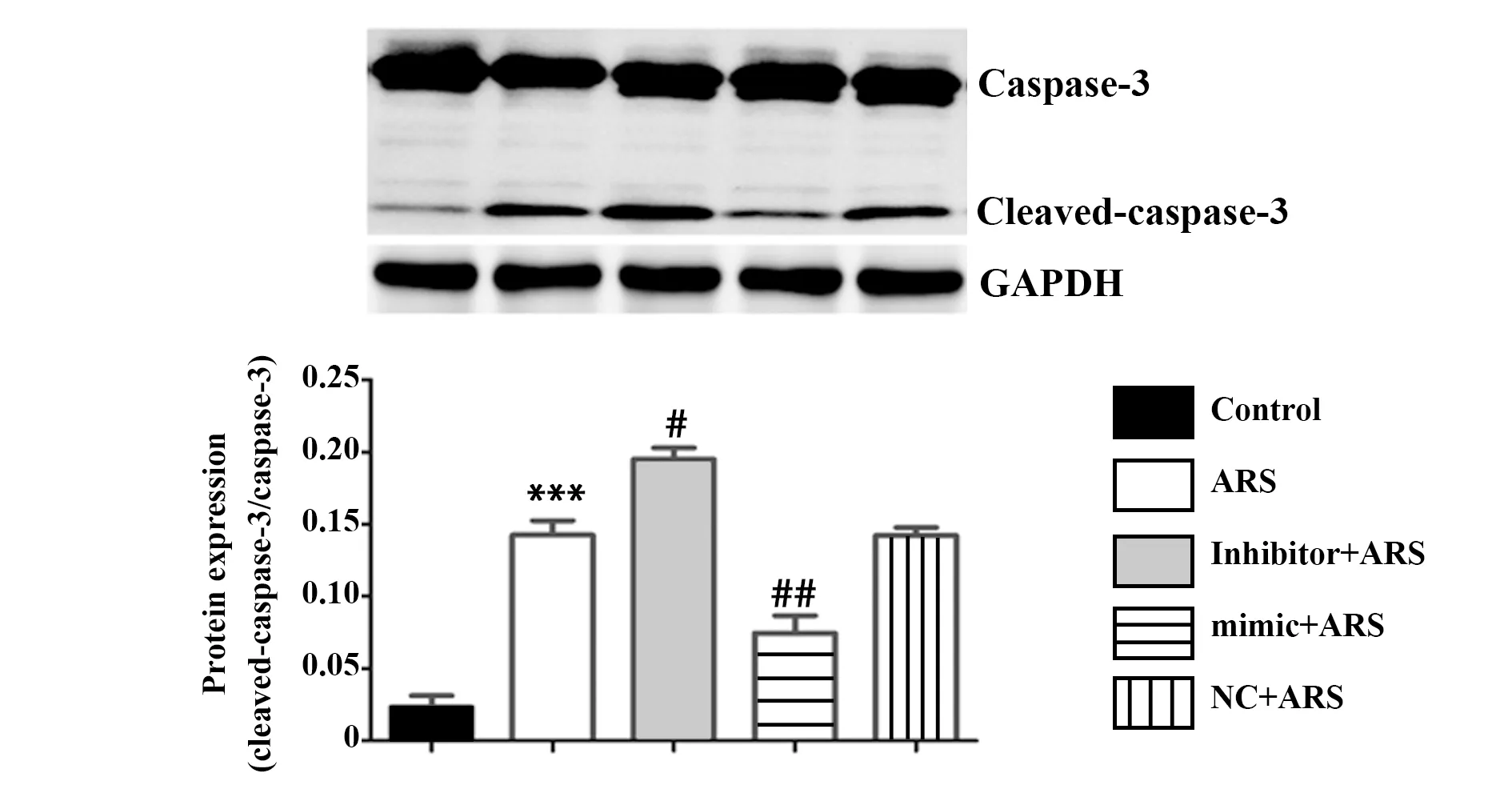
图6 Western blot检测异体血清对rBMSCs中凋亡蛋白Caspase-3表达的影响Fig.6 Evaluated effect of allogeneic serum on protein expression of Caspase-3 of rBMSCs by Western blotNote: vs control group;#.P<0.05,##.P<0.01 vs ARS group.
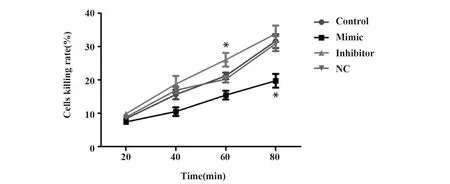
图7 rBMSCs异体活体移植后受机体杀伤情况Fig.7 Survival condition of rBMSCs in vivo after xenoge-nous transplantationNote:
3 讨论
BMSCs是细胞治疗中运用最为广泛的一类干细胞,具有易取材、易扩增、低免疫源性等优点,在再生医学领域具有广阔的应用前景,有望成为骨缺损修复、心肌梗死、自身免疫性疾病、慢性顽固性心绞痛等疾病的首选方法[10]。但是BMSCs移植治疗的效果并不理想,有证据表明BMSCs移植后在机体内存活率较低是限制其治疗效果的重要因素。例如,Amsalem等[11]采用氧化铁标记的MRI技术监测移植BMSCs的存活情况,发现心机梗死区移植后24 h存活的BMSCs明显减少,下降近50%,一个月后基本检测不到BMSCs的存活。王月秋等[12]采用绿色荧光蛋白标记BMSCs移植注射至兔椎间盘,发现移植后6、8周髓核内的荧光细胞数量明显少于移植后1、2、4周,也证实BMSCs移植后在机体内存活率随时间的延长而逐渐降低。因此,如何提高BMSCs移植后存活率成为干细胞临床转化面临的首要问题。
miRNAs是一类生物进化过程中高度保守的内源表达的小分子非编码RNA,广泛参与多种生理病理过程,其中miR-378在调控细胞增殖、凋亡、肿瘤侵袭与转移等方面具有重要的作用。Li等[13]研究显示,过表达miR-378可促进非小细胞肺癌的增殖。Fang等[14]研究发现,过表达miR-378可增强大鼠心肌细胞对缺血缺氧环境的难受性,而若抑制miR-378则可加重心肌细胞损伤和凋亡。因此,miR-378可能对细胞存活具有促进作用。然而,目前有关miR-378对干细胞的调控影响的研究报道甚少。本研究通过过表达或抑制miR-378表达的方式改造BMSCs,发现miR-378过表达可提高BMSCs异体移植的存活率,本研究结果可能为克服BMSCs移植存活率低的问题提供了新的解决途径。
本研究采用密度梯度离心法分离大鼠BMSCs,通过流式细胞术检测rBMSCs表面标志物及细胞成骨诱导实验证实本实验中所分离的细胞为BMSCs。随后采用miR-378 mimic及inhibitor转染rBMSCs,RT-PCR实验证实miR-378 mimic转染后可显著提高rBMSCs中miR-378的表达,miR-378 inhibitor转染则可显著抑制rBMSCs中miR-378的表达,说明成功干预rBMSCs中miR-378的表达。免疫系统的排斥作用是导致异体移植疗效不理想的直接原因,正常人与动物血清中含有一组经活化后具有酶活性的蛋白质可以攻击外源移植干细胞产生防御作用,直接导致移植干细胞损伤或死亡[15],因此本研究采用大鼠血清与rBMSCs共培养体外模拟异体移植过程。MTT实验结果显示,rBMSCs与异体大鼠血清共培养2 h后,rBMSCs存活率显著下降;流式细胞术检测细胞凋亡结果显示,与异体大鼠血清共培养的rBMSCs凋亡率显著高于Control组,且Western blot结果也显示与异体大鼠血清共培养的rBMSCs中Caspase-3切割激活显著高于Control组。说明,异体大鼠血清对rBMSCs的杀伤作用较大。郑盛等[16]也证实正常人血清对rBMSCs具有较高的杀伤作用。
随后通过过表达或抑制rBMSCs中miR-378,观察其对异体大鼠血清孵育条件下rBMSCs存活的影响。MTT结果显示,与异体大鼠血清共培养的rBMSCs相比较,过表达miR-378可提高同条件下rBMSCs的存活率,抑制miR-378表达则可继续降低rBMSCs的存活率。说明,miR-378对异体大鼠血清共孵育条件下rBMSCs的存活具有促进作用。流式细胞术检测细胞凋亡结果显示,过表达miR-378可抑制异体大鼠血清共孵育条件下rBMSCs的凋亡,抑制miR-378则促进rBMSCs的凋亡。Western blot结果显示,异体大鼠血清共孵育条件下,过表达miR-378可抑制rBMSCs中Caspase-3的切割激活,抑制miR-378则促进rBMSCs中Caspase-3的切割激活。说明,miR-378可抑制异体大鼠血清共孵育条件下rBMSCs的凋亡。郭天柱等[17]研究也显示,过表达miR-378可显著促进缺氧条件下rBMSCs的生长增殖,并抑制细胞凋亡。另外,为了进一步验证,我们采用Europium标记rBMSCs进行活体移植。结果显示,转染miR-378 mimic的rBMSCs在大鼠体内各时间段存活率均显著高于Contorl组和转染miR-378 inhibitor组。体内体外实验说明,miR-378可以促进异体移植过程中BMSCs的存活。针对miR-378提高异体移植过程中BMSCs存活率的具体机制,可能与体液免疫中补体系统活化有关。有研究表明,在异体移植过程中补体系统被激活后,形成攻膜复合物,可裂解外源细胞,导致移植干细胞的存活率较低[18]。因此,miR-378是否是通过靶向抑制补体活化而发挥作用将成为我们下一步研究重点。
综上所述,异体移植过程中因机体免疫反应可导致BMSCs存活率较低,而过表达miR-378则可提高异体移植过程中BMSCs的存活率,并抑制BMSCs凋亡,本研究结果可为解决BMSCs移植存活率低的问题提供新的思路。

