DENV-2作用于HUVECs和人巨噬细胞对黏附分子表达的影响①
罗 玉 左 丽 来 涛 张 妮 周恩正 陈俊豪
(贵州医科大学免疫学教研室,贵阳 550025)
登革病毒(Dengue virus,DENV)直径40~60 nm,是单股正链RNA病毒,长度约11 kb,属于黄病毒科黄病毒属,是一种在热带和亚热带地区由埃及伊蚊和白纹伊蚊传播的常见的虫媒病毒[1-3]。在过去二十年间,全球每年大约有39亿人感染DENV,其中大约10亿人产生症状,DENV感染可引起自限性的登革热(Dengue fever,DF)、重症登革热出血(Dengue hemorrhagic fever,DHF)和登革休克综合征(Dengue shock syndrome,DSS),重症DF疾病的典型临床表现为血管渗漏、血小板减少症和轻度至中度的肝损伤,体液流失过多导致血液浓缩和低血压,进而引起死亡[4]。DENV感染所导致的死亡率、发病率和经济负担已经成为全球公共卫生的重要威胁,重要的是这些症状的出现与血管内皮细胞的功能紊乱有一定关系[5]。
根据已知报道,DENV有4种血清型(DENV-1~4)。DENV基因可编码3种结构蛋白(E、PrM、C)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5),其中NS1是一种48 kD的糖蛋白,表达在细胞表面并且可以分泌进入DF患者血液[6,7]。另外,DENV NS1蛋白也涉及增加血管内皮细胞的渗透[8]。而与血管内皮细胞功能障碍相关的免疫应答不适引起的血浆渗漏是重症DF的病理生理特征,并且内皮细胞的激活、炎性介质释放对血管的渗透和细胞与细胞、细胞与基质间的黏附有一定关系[9]。
DENV主要是在人固有免疫细胞中复制,巨噬细胞是DENV致病机制中的重要靶细胞[6],其释放趋化因子和细胞因子,并认为可激活内皮细胞诱导血管通透性,并且巨噬细胞在病毒继发感染期间起着重要作用[10]。
细胞黏附分子在免疫调节和炎性反应中起着重要的作用,黏附分子主要涉及白细胞的转运并与其内皮细胞上的受体相互作用,在免疫系统中促进细胞黏附[11]。一般认为细胞间黏附分子(Intercellular adhesion molecule,ICAM)-1、血管黏附分子(Vascular adhesion molecule,VCAM)-1、内皮选择素(Endothelium selectin,E-selectin)在慢性炎症中起着重要作用,并认为是内皮细胞紊乱的标志[12]。本研究通过建立DENV-2感染HUVECs和人巨噬细胞的共培养体系,来探究其对黏附分子表达的影响。
1 材料与方法
1.1材料
1.1.1细胞株 DENV-2标准株(NGC株)由本课题组保存。白纹伊蚊细胞C6/36细胞株购自中科院昆明细胞库。人脐静脉内皮细胞(Primary human umbilical vein endothelial cells,HUVECs)购自美国Sciencell公司。
1.1.2浓缩白细胞滤盘血 经贵州省卫生和计划生育委员会和贵州医科大学伦理委员会同意,由贵州省血液中心提供。
1.1.3试剂和仪器 ECM培养基(含ECGs)(美国Sciencell公司);人淋巴细胞分离液和红细胞裂解液(北京Solarbio公司);RPMI1640 培养基(美国Hyclone公司);0.25%胰蛋白酶(含0.02%EDTA)(BI公司);巨噬细胞集落刺激因子(Macrophage colony-stimulating factor,M-CSF)(美国PeproTech公司);EasyPure RNA 提取试剂盒(北京全式金公司);Anti-Human CD11b APC(Invitrogen公司);Anti-human CD14 FITC(美国BD公司);Human sICAM-1、sVCAM-1和sE-selectin Platinum ELISA试剂盒(Invitrogen公司);倒置显微镜(Nikon);RT system (Bio-Rad,CFX96);实时荧光定量PCR仪(ABI-STEPONE PLUS)。
1.1.4基因引物序列 各基因碱基序列由上海生工合成,见表1。
1.2方法
1.2.1细胞培养 C6/36细胞用RPMI1640 培养基(含10%FBS),于28℃、5%CO2恒温培养箱中培养,细胞生长融合至90%时用胰酶消化传代;HUVECs细胞用ECM培养基(含10%FBS、1%ECGS)于37℃、5%CO2恒温培养箱中培养,细胞生长融合至约90%时用胰酶消化传代。
1.2.2DENV-2的鉴定与毒力检测 用稀释度10-8~10-1的DENV-2病毒液感染C6/36细胞2 h,PBS润洗3次,用RPMI1640(含2%FBS)继续培养3~6 d,观察细胞病变效应(Cytopathic effect,CPE)计算DENV-2对C6/36 细胞的组织培养半数感染量(50% tissue culture infective dose,TCID50)。C6/36细胞生长至90%时,用103TCID50 DENV-2病毒液感染细胞2 h后,PBS润洗3次,换RPMI1640(含2%FBS)继续培养2~3 d,待细胞出现病变,收集细胞提取RNA,PCR扩增NS1部分序列,1.5%琼脂糖凝胶电泳鉴定目标条带。
表1 相关基因引物序列
Tab.1 Primer sequence of related gene

GenePrimer(5′ to 3′)Length(bp)NS1F:AACCTATTGATGGTCCCGAAA413R:CCAAGATGGATTTGATTTCTGCTTANS1(q-PCR)F:AACAACTACTGCCTCTGGAAAACTC90R:CATCCGTCCTCACCTCTGTATCTICAM-1F:CAGTGA CCATCTACA GCTTTCCGG119R:GCTGCTACCACAGTGATGACAAVCAM-1F:GATACAACCGTCTTGGTCAGCCC89R:CGCATCCTTCAACTGGGCCTTE-selectinF:TGGAACACAACCTGTACATTTG85R:AATTCCCAGATGAGGTACACTGβ-actinF:GCATGGGTCAGAAGGATTCCT106R:TCGTCCCAGTTGGTGACGAT
1.2.3单核细胞(Peripheral blood mononuclear cell,PBMC)的提取与转化 将用生理盐水稀释的浓缩白细胞滤盘血液缓慢加至淋巴细胞分离液表面,通过水平密度梯度离心(2 000 r/min,20 min,室温)分离提取白膜层,红细胞裂解液处理5~7 min后,用含2%FBS的PBS润洗3次,离心(1 500 r/min,7 min,室温)弃液后所得细胞沉淀即为PBMC,用RPMI1640培养基(含1%FBS)重悬后贴壁2 h,弃去上清,换含10%FBS 的RPMI1640培养基,加终浓度为1 ng/ml M-CSF,培养5~7 d。
1.2.4巨噬细胞的鉴定 弃上清,PBS润洗3次,胰酶消化细胞后转移至流式管中,300 μl PBS重悬细胞,加20 μl anti-human CD14 FITC和5 μl anti-human CD11b APC,室温避光染色1 h上机。
1.2.5共培养体系的建立 取对数期生长的细胞HUVECs接种于Transwell 6孔板的下室,3×105个/孔,培养48 h;将巨噬细胞接种于上室,3×106个/孔,用 RPMI1640培养基(含1%FBS)贴壁2 h;加入103TCID50 DENV-2的病毒液为实验组,无病毒液为对照组,孵育2 h,PBS润洗3次,换含10%FBS培养基继续培养。
1.2.6qRT-PCR 分别于4、8、12、24、48、72 h时间点收集细胞,EasyPure RNA Kit试剂盒提取细胞RNA,检测RNA纯度和浓度后逆转录成cDNA,β-actin作内参,通过SYBR Green染料法检测目的基因DENV-2 NS1、ICAM-1、VCAM-1、E-selectin的相对表达量。
1.2.7双抗体夹心ELISA法检测培养上清液中ICAM-1、VCAM-1、E-selectin的动态变化 分别收集各时间点各组培养上清液,并将空白组和等比稀释的标准品移至ELISA板,100 μl/孔,加入Conjugate液,50 μl/孔,室温避光1~2 h,弃液拍干,Wash Buffer润洗3次后弃液拍干,加入100 μl/孔TMB底物显色液,室温避光15 min,迅速加入100 μl/孔终止液于450 nm波长检测吸光度。
1.3统计学处理 用GraphPad Prism7.0软件进行数据处理与分析,统计方法采用两因素方差分析和独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1DENV-2的鉴定与毒力检测 DENV-2感染C6/36细胞3~6 d内,细胞出现肿胀、融合、空泡、网络状的典型细胞病变。通过RT-PCR扩增DENV-2 NS1部分基因序列,经1.5%琼脂糖凝胶电泳于 250~500 bp之间出现一明亮条带(图1),与预期相符,证实为DENV-2。记录细胞病变孔数,根据Reed-Muench法计算DENV-2的滴度为10-5.5/0.1 ml。
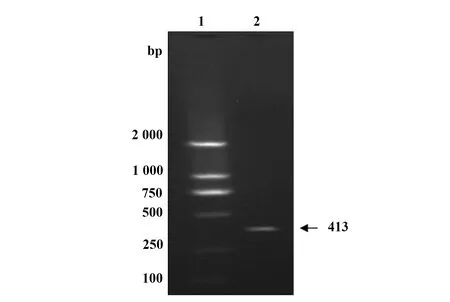
图1 DENV-2部分序列扩增Fig.1 Partial sequence amplification of NS1Note: 1.Marker;2.PCR production of DENV-2.
2.2巨噬细胞的鉴定 提取并分离PBMC,核细胞经刺激因子衍生为巨噬细胞,经流式细胞仪鉴定纯度为(92.15±1.24)%(图2)。
2.3qRT-PCR检测不同时间点HUVECs和巨噬细胞及共培养后HUVECs 中病毒载量 DENV-2感染HUVECs后,NS1 mRNA相对表达量呈先增加后降低趋势(图3A),24 h(1.25±0.16)达峰值且比4 h感染组增加了(1.44±0.17)倍(P<0.05)。DENV-2感染巨噬细胞后,NS1 mRNA相对表达量呈先递减后增加趋势(图3B)。感染的HUVECs与感染的巨噬细胞共培养,其HUVECs的NS1 mRNA相对表达量均高于相应时间点HUVECs单独感染组,在24 h(19.78±2.63,P<0.000 1)、48 h(10.67±0.65,P<0.000 1)显著上调(图4)。
2.4qRT-PCR 检测不同时间点DENV-2感染的巨噬细胞中ICAM-1、VCAM-1和E-selectin mRNA相对表达量 DENV-2感染巨噬细胞后,ICAM-1 mRNA相对表达量于4 h(2.09±0.01,P<0.000 1)、8 h(2.04±0.01,P<0.000 1)高于巨噬细胞未感染组,12 h(0.92±0.03)、24 h(1.03±0.01)、48 h(0.97±0.04)、72 h(0.84±0.06)相对表达水平与未感染组相比差异无统计学意义(图5A),E-selectin mRNA相对表达量于4 h(5.65±1.51,P<0.000 1)明显高于未感染组,8 h(1.45±0.21)与未感染组相比表达量相比差异无统计学意义,12 h(0.15±0.03)、24 h(0.14±0.04)、48 h(0.19±0.06)、72 h(0.24±0.09)与未感染组相比表达量下调(图5B),但未检测到VCAM-1 mRNA的表达。
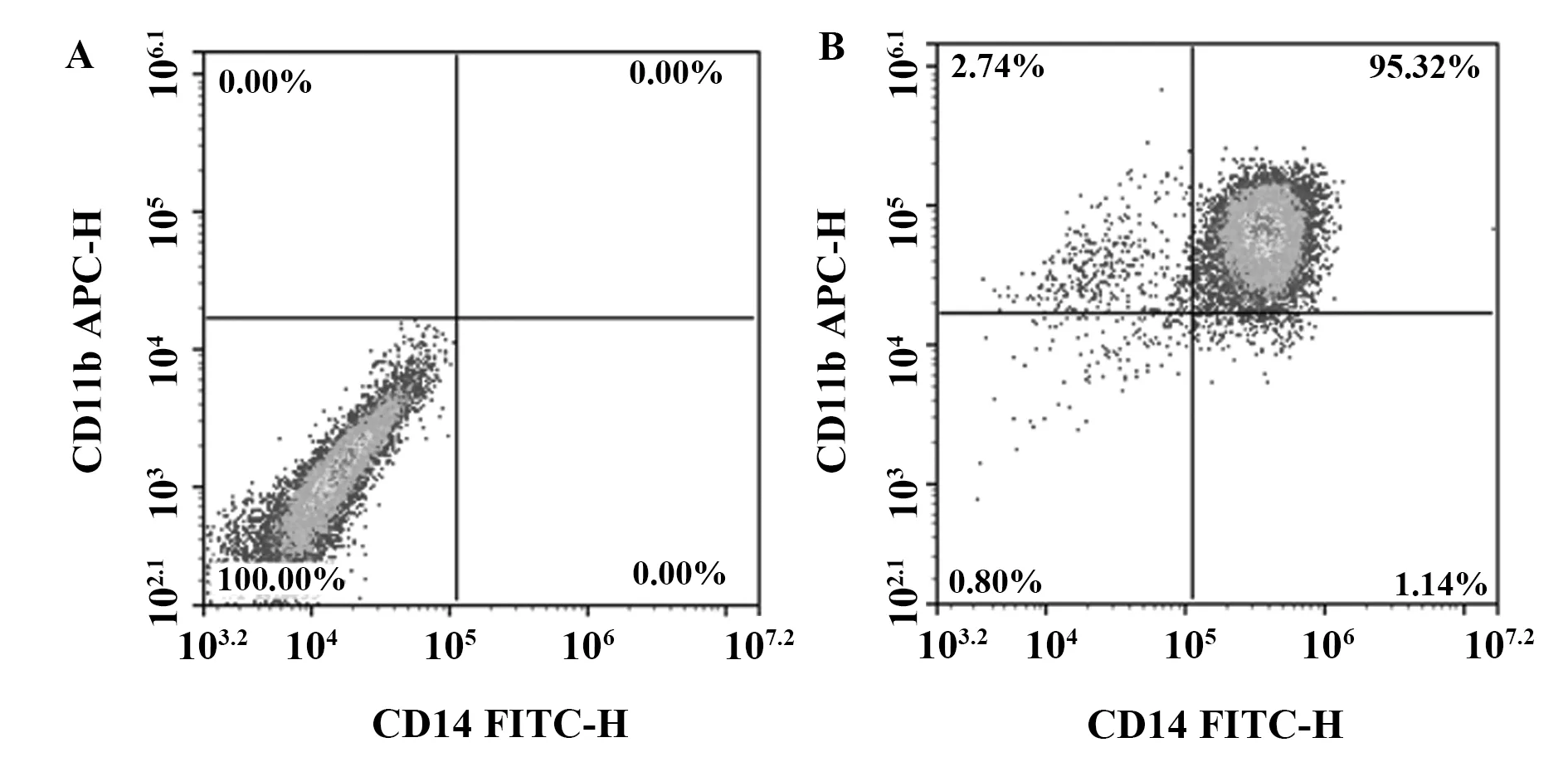
图2 流式细胞术检测M-CSF刺激后巨噬细胞的比例Fig.2 Flow cytometry to detect proportion of macroph-ages induced by M-CSFNote: A.Unstained cells;B.Stained cells.

图3 NS1 mRNA不同时间点相对表达量Fig.3 NS1 mRNA relative expression in HUVECs and macrophages at different timeNote: A.NS1 mRNA in HUVECs;B.NS1 mRNA in macrophages.Compared with uninfected group at the corresponding time,#.P<0.05,##.P<0.01,###.P<0.001,####.P<0.000 1;compared with infected group of 4 h,**.P<0.01,****.P<0.001.
2.5qRT-PCR 检测不同时间点HUVECs中ICAM-1、VCAM-1和E-selectin mRNA相对表达量 DENV-2感染HUVECs后,各时间点ICAM-1、VCAM-1 mRNA均有表达,共培养组在8 h后表达量相比HUVECs单独感染组上调,且均在24 h达峰值,分别为(6.60±0.20,P<0.000 1,图6A)、(2.48±0.18,P<0.000 1,图6B)。DENV-2感染HUVECs后, 4 h(1.20±0.08)E-selectin mRNA表达量最高,共培养组呈先增加后递减趋势且表达均上调(图6C)。
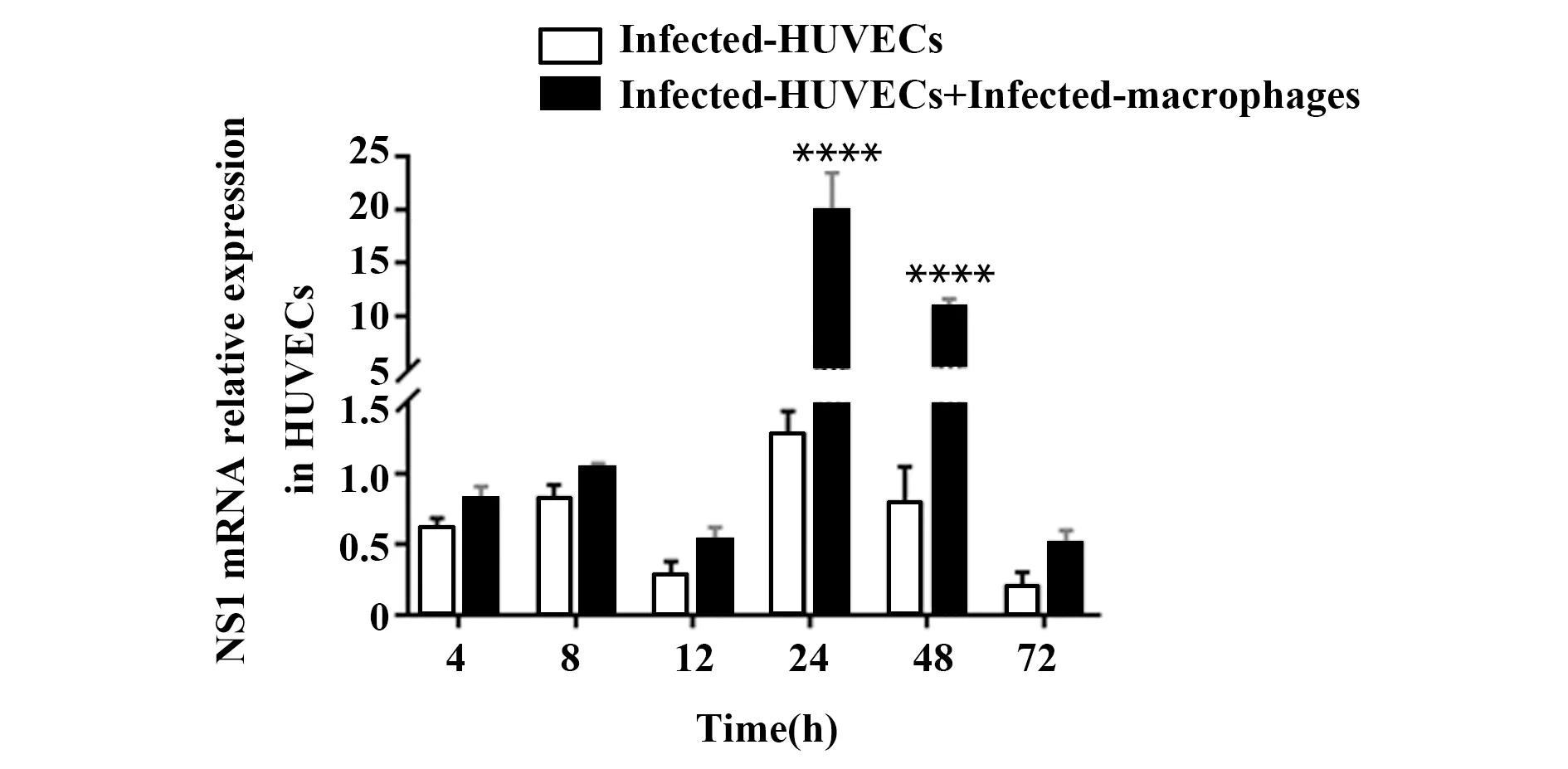
图4 HUVECs中DENV-2 NS1 mRNA不同时间点相对表达量Fig.4 DENV-2 NS1 mRNA relative expression in HUVECsNote: Compared with infected-HUVECs at the corresponding time,****.P<0.000 1.
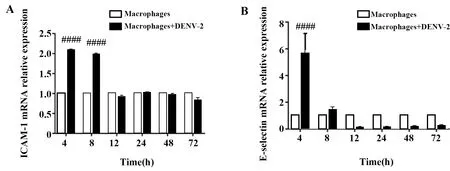
图5 DENV-2感染的巨噬细胞中ICAM-1和E-selectin mRNA相对表达量Fig.5 ICAM-1 and E-selectin mRNA relative expression in DENV-2-infected macrophagesNote: A.ICAM-1 mRNA in macrophages,B.E-selectin mRNA in macrophages.Compared with uninfected group at the corresponding time,####.P<0.000 1.
2.6双抗体夹心ELISA法检测HUVECs中黏附分子ICAM-1、VCAM-1和E-selectin 在不同时间点的动态变化 DENV-2感染的HUVECs与未感染的HUVECs组相比,在相同时间点表达的ICAM-1水平均无明显变化,共培养组中感染DENV-2的HUVECS表达ICAM-1水平在8 h(91.63±0.57)最高,未被感染的HUVECs表达ICAM-1水平呈先增加后减少趋势,在24 h(92.85±0.24)达峰值(图7A)。DENV-2感染的HUVECs组,其表达E-selectin水平随时间呈逐渐递增,且在72 h(6.07±0.39,P<0.000 1)表达量最高;共培养组中感染DENV-2的HUVECs,其表达E-selectin水平随时间呈先递增后降低趋势,且在24 h(6.12±1.03,P<0.000 1)表达量达峰值(图7B)。但未检测到各组培养上清液中VCAM-1分子的表达。
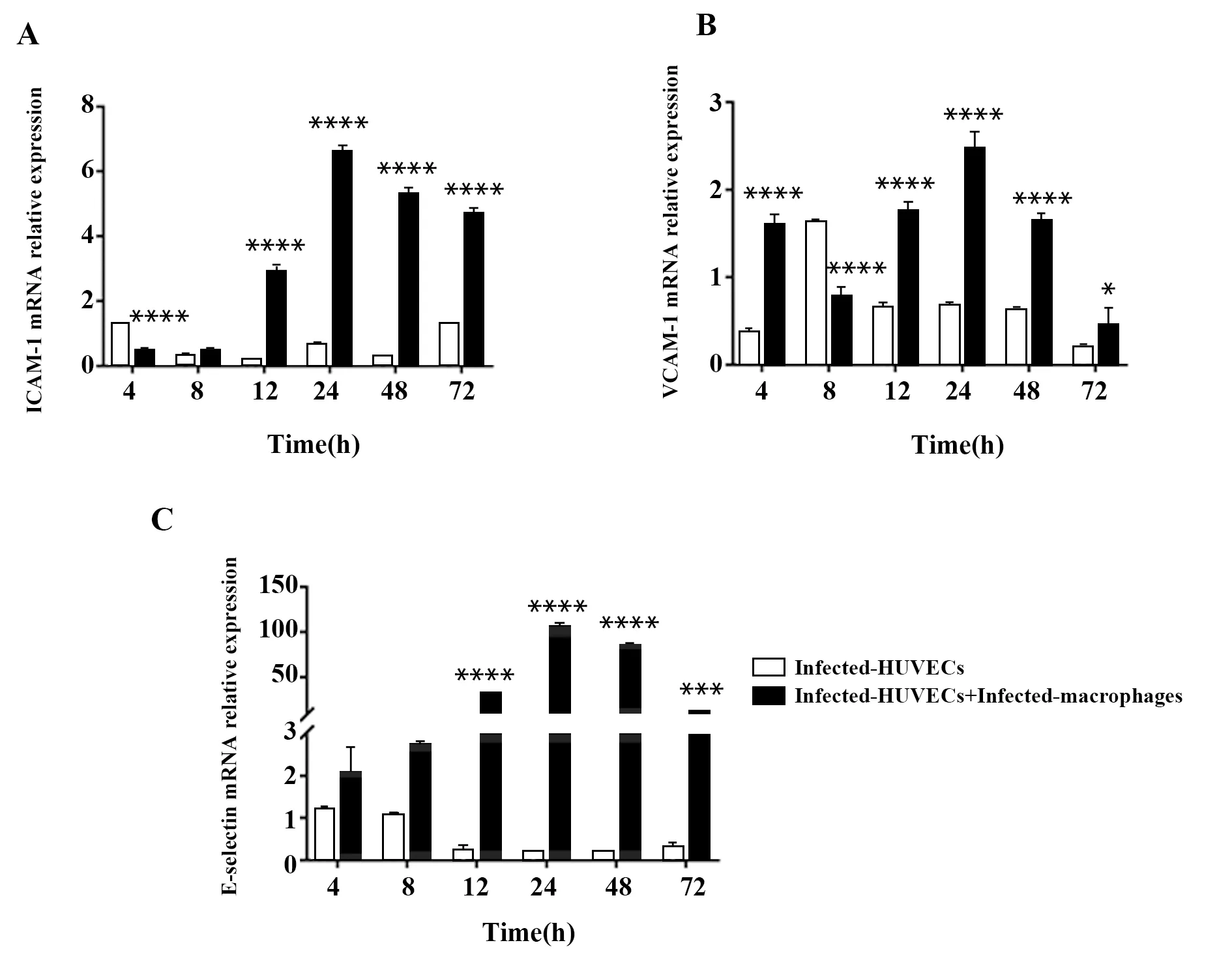
图6 HUVECs中ICAM-1、VCAM-1和E-selectin mRNA不同时间点相对表达量Fig.6 ICAM-1,VCAM-1 and E-selectin mRNA relative expression in HUVECsNote: Compared with infected-HUVECs at the corresponding time,*.P<0.05,***.P<0.001,****.P<0.000 1.
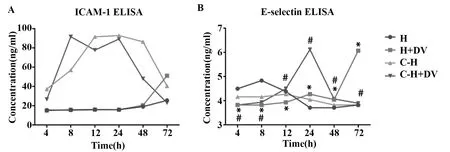
图7 双抗体夹心ELISA法检测HUVECs表达ICAM-1和E-selectin的动态变化Fig.7 ELISA to detect expression of ICAM-1 and E-selectin in HUVECsNote: H.HUVECs;DV.DENV-2;C-H.co-cultured HUVECs;DV-infected HUVECs compared with uninfected HUVECs,*.P<0.000 1;DV-infected HUVECs compared with uninfected HUVECs in co-cultured group.#.P<0.000 1.
3 讨论
DENV感染后引起DHF和DSS的病理机制尚不完全清楚,但内皮细胞通常作为研究DENV致病机制的重要细胞。DHF的典型症状表现为血管渗透,有研究表明许多炎症因子和血管生成介质增加血管蛋白对小静脉和毛细血管内皮的渗透作用[13]。据报道,细胞因子在DHF的发病机制中起重要作用,其患者的血管渗透与血浆中各种细胞因子的水平升高有关[8]。然而,一般而言,组织的损伤程度与病情严重程度并不十分一致[14],另外,短暂性的血浆渗漏和DSS儿童患者的快速恢复都表明渗透性的改变受可溶性介质的影响[15]。
在PBMC的存在下,内皮细胞的渗透性增加,其渗透性增加可能部分原因是由于DENV感染PBMC时产生细胞因子[16],DENV可在单核细胞衍生的巨噬细胞和单核细胞样细胞系中复制并诱导细胞因子和细胞毒性因子。有研究报道,在体外,DENV感染的PBMC能激活内皮细胞并介导黏附分子的释放,导致内皮细胞的渗透性增加[17]。在本次实验中,DENV-2感染HUVECs和人巨噬细胞,在不同时间点均能检测到NS1 mRNA表达,在24 h其相对表达量达峰值,差异有统计学意义,且被DENV-2感染的HUVECs在各时间点均有黏附分子ICAM-1、VCAM-1和E-selectin mRNA的表达。而细胞黏附因子是一类能够介导免疫细胞和细胞因子与血管内皮细胞等相互作用的糖蛋白,作为黏附分子家族成员之一的E-selectin可以介导白细胞向内皮细胞的滚动和黏附,而牢固的黏附和向内皮下组织的迁移由免疫球蛋白超家族成员,包括ICAM-1和VCAM-1的参与[18]。本研究中,DENV-2感染的巨噬细胞,在4、8 h 其ICAM-1和E-selectin mRNA相对表达量明显高于未感染组,但未检测到VCAM-1 的表达,说明DENV-2能够激活巨噬细胞,但不能有效地刺激VCAM-1的表达。另外,将感染DENV-2的巨噬细胞添加到感染DENV-2的HUVECs中,内皮细胞中病毒RNA拷贝数在24 h和48 h明显增加,这可能与DENV-2感染活化的巨噬细胞促炎作用有关,这些巨噬细胞是由单核细胞衍生而来。且在共培养组中检测到12 h后,DENV-2感染的HUVECs中ICAM-1、VCAM-1和E-selectin mRNA相对表达量均明显高于单独感染的HUVECs,在各时间点均能检测到培养上清液中可溶性分子ICAM-1和E-selectin的表达,说明DENV-2感染的巨噬细胞可能增强DENV-2感染的HUVECs的细胞活化,使内皮细胞表达的黏附分子维持在较高水平,从而引起白细胞与血管内皮细胞间黏附的改变,促进血管内皮细胞局部炎症的发生,导致血管的屏障功能受损,从而促进血管渗漏的发生。
本次研究证明在DENV-2感染的巨噬细胞与HUVECs的共培养体系下,活化的巨噬细胞在一定时效内能增强DENV-2在内皮细胞中的复制作用并促进细胞黏附分子的表达。部分报道认为是单核细胞能导致DENV感染的内皮细胞钙黏蛋白表达减少,黏附分子表达增加,细胞间出现多个间隙,导致渗漏增加[19,20],但目前对于DENV-2感染后,内皮细胞与巨噬细胞相互作用对黏附分子的影响了解更少,本研究为今后继续探讨DENV感染的免疫病理机制提供一定的基础。

