甘露糖和葡萄糖醛酸组合促进CIK细胞体外扩增
卢 意 蔡海波 谭文松
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
细胞因子诱导杀伤细胞(Cytokine-induced killer,CIK)治疗的原理是通过回输自体肿瘤特异性T细胞,使T细胞特异性识别并清除患者体内的靶细胞,从而起到抗癌的作用[1,2]。CIK细胞是一类异质型细胞群,其中主要效应细胞为CD3+CD56+细胞,而CD8+细胞可辅助CD3+CD56+细胞杀伤肿瘤细胞[3-5]。CIK细胞可通过穿孔素和颗粒酶B的释放来发挥其生物学毒性[6,7]。治疗用CIK细胞通常来源于患者外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs),但是外周血中杀伤细胞数量有限,无法满足临床输注要求[8-10],必须通过体外扩增才能解决解决这一问题。
作为一类生物大分子,多糖广泛存在于自然界的高等和低等生物中。研究表明很多多糖具有促进免疫细胞体外增殖的生物活性,如人参多糖、麦麸多糖、金耳多糖等[11-13]。Leung等[14]发现随着甘露糖含量的增加,芦荟多糖的免疫调节活性增强。Inngjerdingen等[15]发现改变单糖组成、降低分子量会削弱果胶的生物活性。可见,多糖的生物活性与其单糖组成相关。黄原胶是一类由植物致病菌产生的胞外杂多糖,由葡萄糖(Glc)、甘露糖(Man)和葡萄糖醛酸(GlcA)以2∶2∶1的比例组成,它广泛应用于食品和制药行业中的增稠剂和稳定剂[16,17]。课题组前期工作发现在无血清培养基中添加黄原胶有利于CIK细胞在高密度条件下的扩增[18]。然而,黄原胶即使在低浓度条件下仍具有较高的黏度,且加热也无法改变其黏度[19,20],因此,难以应用于培养基的制备。为此,本文基于黄原胶的单糖组成,研究葡萄糖、甘露糖、葡萄糖醛酸三种单糖对CIK细胞体外扩增的影响,以期为适用于CIK细胞扩增的无血清培养基的研制提供依据。
本文首先利用正交实验确定最适合CIK细胞扩增的单糖组合和添加剂量,并以总细胞扩增倍数、培养物种效应细胞比例和扩增倍数、效应细胞中表达颗粒酶B和穿孔素的细胞比例、CIK细胞对K562细胞的杀伤活性为指标,应用细胞培养袋在无血清培养体系中考察该组合对CIK细胞体外扩增及功能的影响,为CIK细胞体外扩增技术的优化提供技术支持。
1 材料与方法
1.1实验材料、试剂 RMPI1640培养基购于美国Thermo公司;胎牛血清购于上海BioSun公司;无血清培养基购于上海Bioengine公司;重组人γ干扰素(rIFN-γ)、重组人白细胞介素2(rIL-2)、重组人白细胞介素1α(rIL-1α)均购于美国Peprotech公司;鼠抗人CD3单克隆抗体(OKT-3)购于美国eBioscience公司;植物血凝素(PHA)购于Sigma-Aldrich公司;FITC标记的鼠抗人CD3抗体、PE标记的鼠抗人CD56抗体、PerCP-Cy5.5标记的鼠抗人CD8抗体、V450标记的鼠抗人颗粒酶B抗体、BV421标记的鼠抗人穿孔素抗体均购于美国BD公司;D-葡萄糖、D-甘露糖、D-葡萄糖醛酸分别购于美国Amresco公司、上海笛柏生物科技有限公司、上海Macklin公司;Cultilife215细胞培养袋购于日本TaKaRa公司。
1.2实验方法
1.2.1CIK细胞培养 将新鲜分离的PBMC置于37℃、5%CO2的培养环境中,第0天加入IFN-γ,终浓度为1 000 U/ml,24 h 后补加IL-2、OKT3、IL-1α、PHA,终浓度分别为500 U/ml、50 ng/ml、100 U/ml和500 ng/ml,细胞生长的同时补入新鲜培养基和IL-2(500 U/ml)。每天取样,采用台盼蓝染色计数得到活细胞密度。
1.2.2细胞表型分析 收取(5~10)×105个细胞,分别采用FITC-CD3、PE-CD56、PerCP-CD8流式抗体标记细胞,4℃孵育30 min后应用FACS Aria流式细胞仪(美国BD公司)对细胞进行表型检测,最后用FlowJo 7.6.1软件进行数据处理及分析。
1.2.3表达颗粒酶B、穿孔素的效应细胞比例分析 收集4×106个培养后的CIK细胞,分成4组,一组作为对照组,一组标记FITC-CD3、PE-CD56、PerCP-CD8抗体,另外两组除标记以上三种流式抗体外分别标记V450-颗粒酶B和BV421-穿孔素流式抗体。标记细胞表面抗原CD3、CD56和CD8后分别用固定液和破膜液处理细胞,添加V450-颗粒酶B和BV421-穿孔素抗体,最后结合流式细胞仪和FlowJo软件对细胞进行检测分析。
1.2.4CIK细胞杀伤活性检测 将CIK细胞作为效应细胞(E),K562细胞作为靶细胞(T),将1×105个CIK细胞和1×104个K562细胞按照效靶比10∶1(E∶T=10∶1)接种于100 μl 含10% 胎牛血清的RPMI1640培养基中,并置于37℃,5%CO2的培养箱中孵育24 h。之后每孔加入10 μl CCK-8试剂,继续孵育2~4 h,最后用酶标仪测出各孔培养液在450 nm处的OD值。此外设置空白对照组,在不含细胞的培养基中添加CCK-8试剂,排除培养基对检测结果的干扰。CIK细胞、K562细胞单独培养和两者共培养后检测得到的OD值均减去空白对照组的OD值,最后分别用ODE、ODT、ODET表示,杀伤活性(Cytotoxicity)由下式计算:Cytotoxicity=[1-(ODET-ODE)/ODT]×100%。
1.2.5DOE软件实验设计 本文采用的DOE软件是minitab17,基于此软件进行田口设计,即正交实验设计,正交实验方法参照文献[21,22]。
2 结果
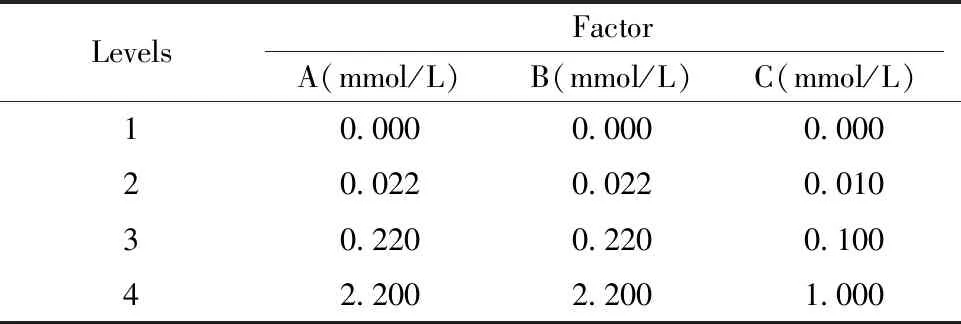
2.1最优单糖组合和添加剂量的确定 在无血清培养基体系中考察单糖种类和添加剂量对CIK细胞扩增的影响。针对葡萄糖、甘露糖和葡萄糖醛酸三种单糖,利用minitab17软件设计一个三因子四水平正交实验,其中三因子A、B、C分别代表葡萄糖、甘露糖和葡萄糖醛酸,每种单糖设4个添加剂量,葡萄糖和甘露糖的4个添加剂量均为0.000、0.022、0.220、2.200 mmol/L,而葡萄糖醛酸的添加剂量为0.000、0.010、0.100、1.000 mmol/L(见表1)。根据软件选取L16(45)安排实验,不考虑交互作用,总共设计16个正交实验组,每组实验重复3次。
对16组实验数据分别进行直观分析,结果如表2和图1所示。首先将表2中3次实验中第14天的总细胞扩增倍数X1~X3求和得到Y值,进一步求出各因子对应于不同水平的Y值的平均值,即K1~K4,从而得出均值主效应图(图1)。将表2中3次重复实验的数据堆叠,进行方差分析,结果如表3所示。结合直观分析和方差分析的结果可知,在所选择的添加剂量范围内,最优点为A4B4C3,即葡萄糖、甘露糖、葡萄糖醛酸的添加剂量分别为2.200、2.200、0.100 mmol/L,其中甘露糖、葡萄糖醛酸对总细胞扩增倍数的影响显著(P<0.05)。
表1 三因子四水平正交设计
Tab.1 Three-factor four-level orthogonal design
LevelsFactorA(mmol/L)B(mmol/L)C(mmol/L)10.0000.0000.00020.0220.0220.01030.2200.2200.10042.2002.2001.000
表2 三因子四水平正交实验中培养14 d的总细胞扩增倍数的直观分析
Tab.2 Visual analysis of expansion fold of total cells for 14 d cell culture in three-factor four-level orthogonal test
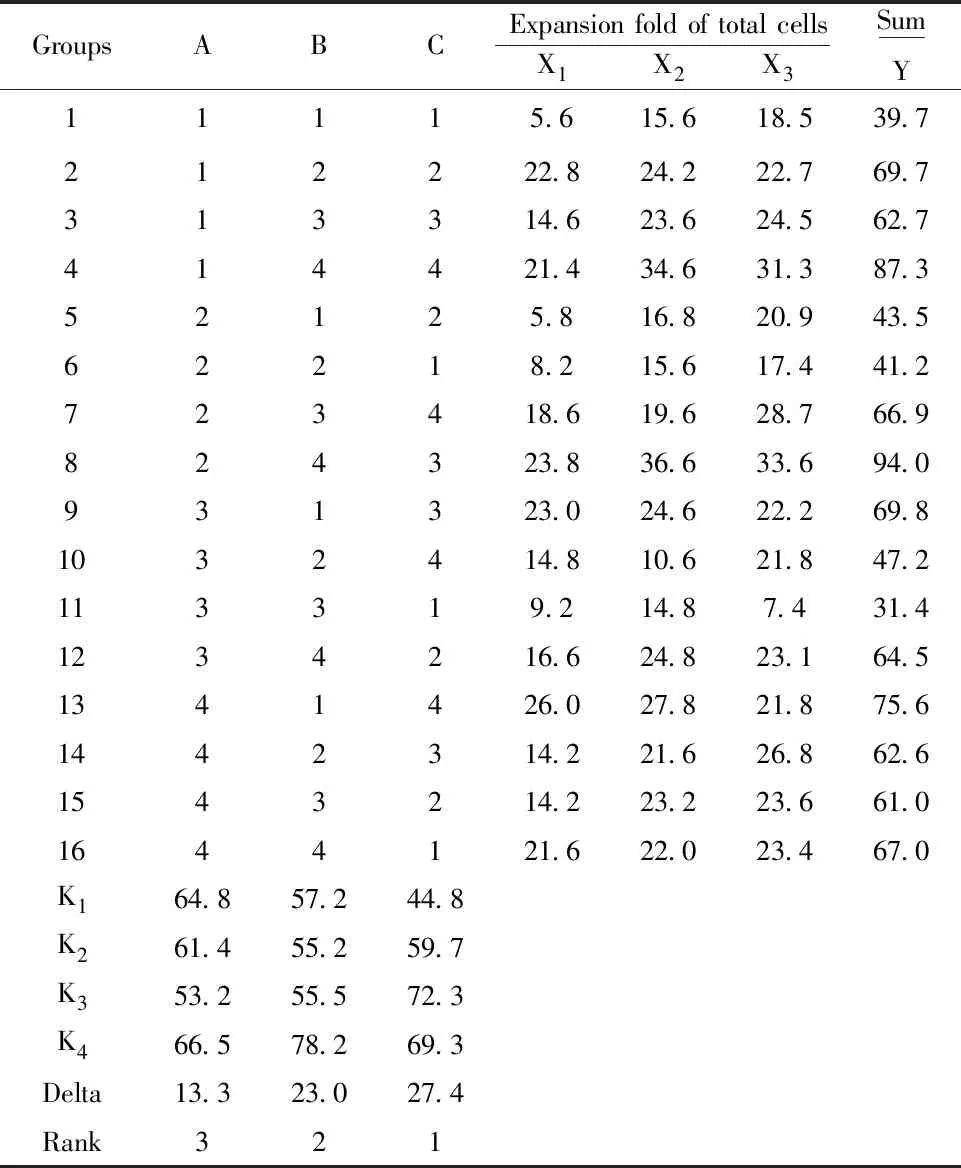
GroupsABCExpansion fold of total cellsX1X2X3SumY11115.615.618.539.7212222.824.222.769.7313314.623.624.562.7414421.434.631.387.352125.816.820.943.562218.215.617.441.2723418.619.628.766.9824323.836.633.694.0931323.024.622.269.81032414.810.621.847.2113319.214.87.431.41234216.624.823.164.51341426.027.821.875.61442314.221.626.862.61543214.223.223.661.01644121.622.023.467.0K164.857.244.8K261.455.259.7K353.255.572.3K466.578.269.3Delta13.323.027.4Rank321
然而,上述正交实验中的最优点处于三种单糖添加剂量范围的边界上,无法确定三者的最适添加剂量。因此,进一步调整三种单糖的添加剂量范围,设计了三因子三水平的正交实验(表4),其中葡萄糖和甘露糖的添加剂量均选取0.22、2.20、22.00 mmol/L,葡萄糖醛酸的添加剂量则选取0.10、1.00、10.00 mmol/L。根据软件选取L9(34)共9个实验组,每组实验重复3次,直观分析结果如表5和图2所示。由图2可以看出,在所选择的添加剂量范围内,最优点为A1B2C1,即当葡萄糖、甘露糖、葡萄糖醛酸的添加剂量分别为0.22、2.20、0.10 mmol/L时总细胞的扩增倍数最高。
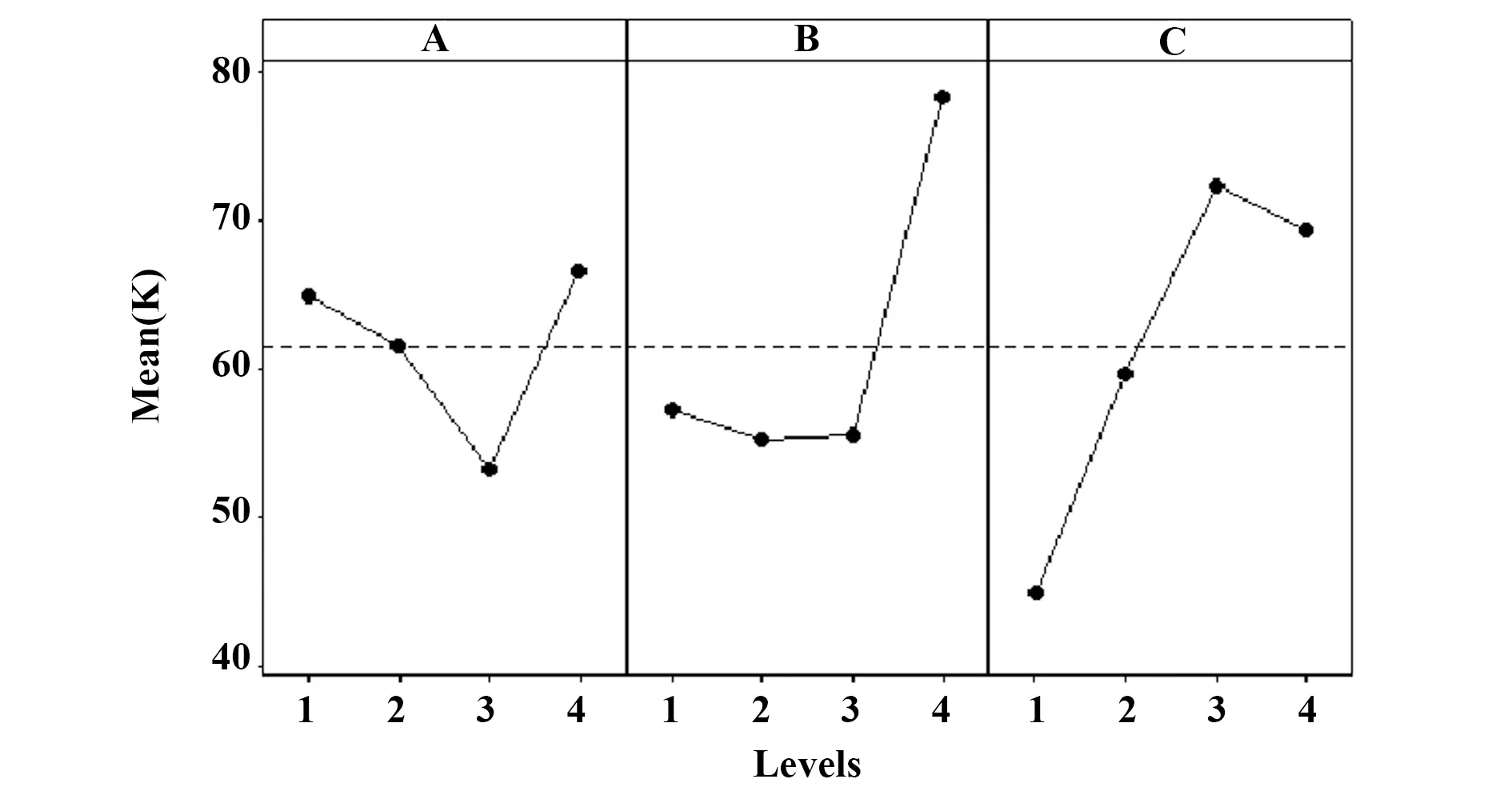
图1 三因子四水平正交实验的均值主效应图(n=3)Fig.1 Main effect map of mean of three-factor four-level orthogonal test(n=3)
表3 三因子四水平正交实验中培养14 d后的总细胞扩增倍数的方差分析
Tab.3 Variance analysis of expansion fold of total cells for 14 d cell culture in three-factor four-level orthogonal test
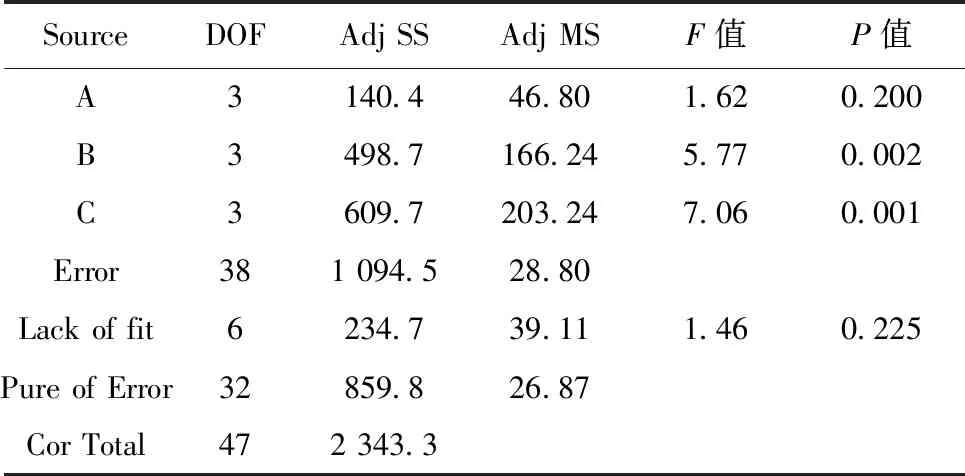
SourceDOFAdj SSAdj MSF值P值A3140.446.801.620.200B3498.7166.245.770.002C3609.7203.247.060.001Error381 094.528.80Lack of fit6234.739.111.460.225Pure of Error32859.826.87Cor Total472 343.3
表4 三因子三水平正交设计
Tab.4 Three-factor three-level orthogonal design
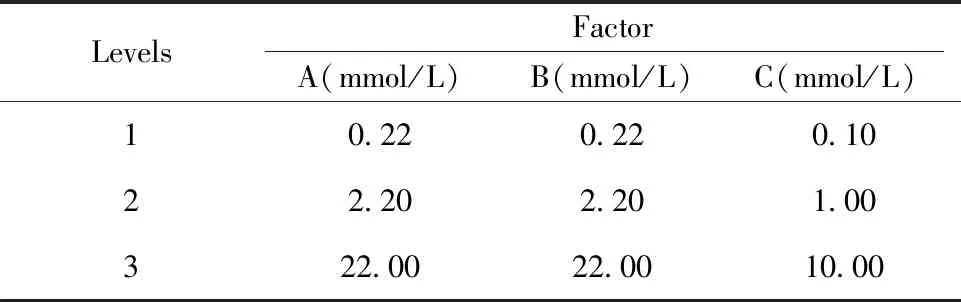
LevelsFactorA(mmol/L)B(mmol/L)C(mmol/L)10.220.220.1022.202.201.00322.0022.0010.00
考虑到无血清培养基中葡萄糖含量在10 mmol/L以上,葡萄糖的添加对于实验结果的影响可以忽略不计。因此,确定2.20 mmol/L 甘露糖和 0.10 mmol/L葡萄糖醛酸为最优单糖组合以及添加剂量。
2.2甘露糖和葡萄糖醛酸组合应用对CIK细胞体外扩增及其细胞功能的影响 在无血清培养基体系中考察添加2.20 mmol/L甘露糖和0.10 mmol/L葡萄糖醛酸对CIK细胞体外扩增以及功能的影响。
表5 三因子三水平正交实验中培养14 d后的总细胞扩增倍数的直观分析
Tab.5 Visual analysis of expansion fold of total cells for 14 d cell culture in three-factor three-level orthog-onal test
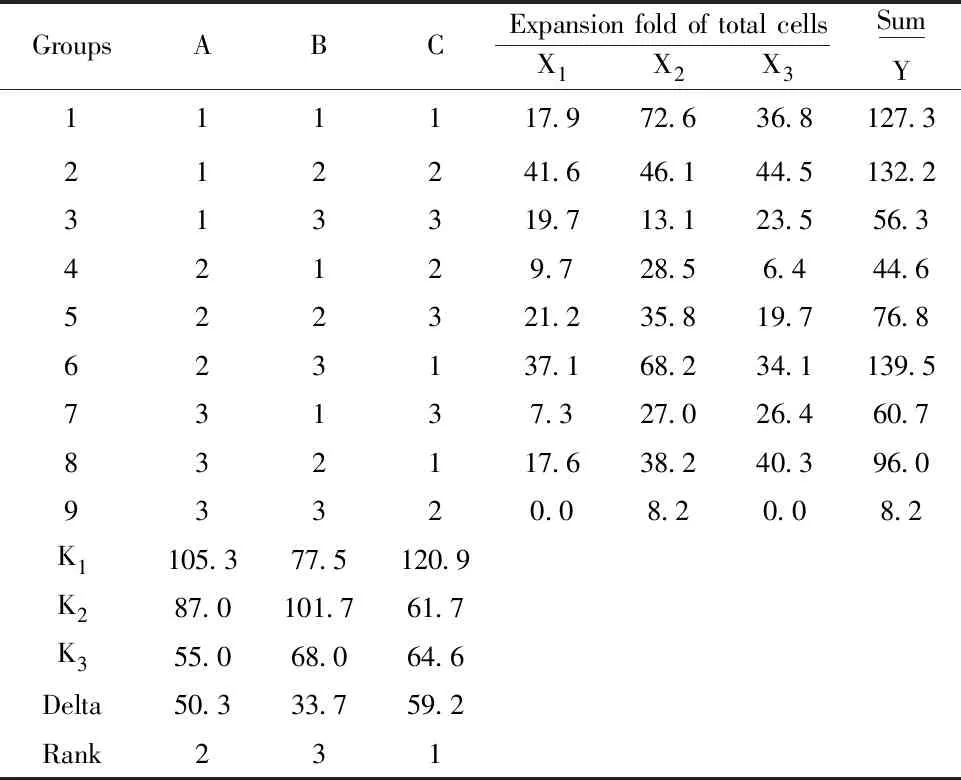
GroupsABCExpansion fold of total cellsX1X2X3SumY111117.972.636.8127.3212241.646.144.5132.2313319.713.123.556.342129.728.56.444.6522321.235.819.776.8623137.168.234.1139.573137.327.026.460.7832117.638.240.396.093320.08.20.08.2K1105.377.5120.9K287.0101.761.7K355.068.064.6Delta50.333.759.2Rank231
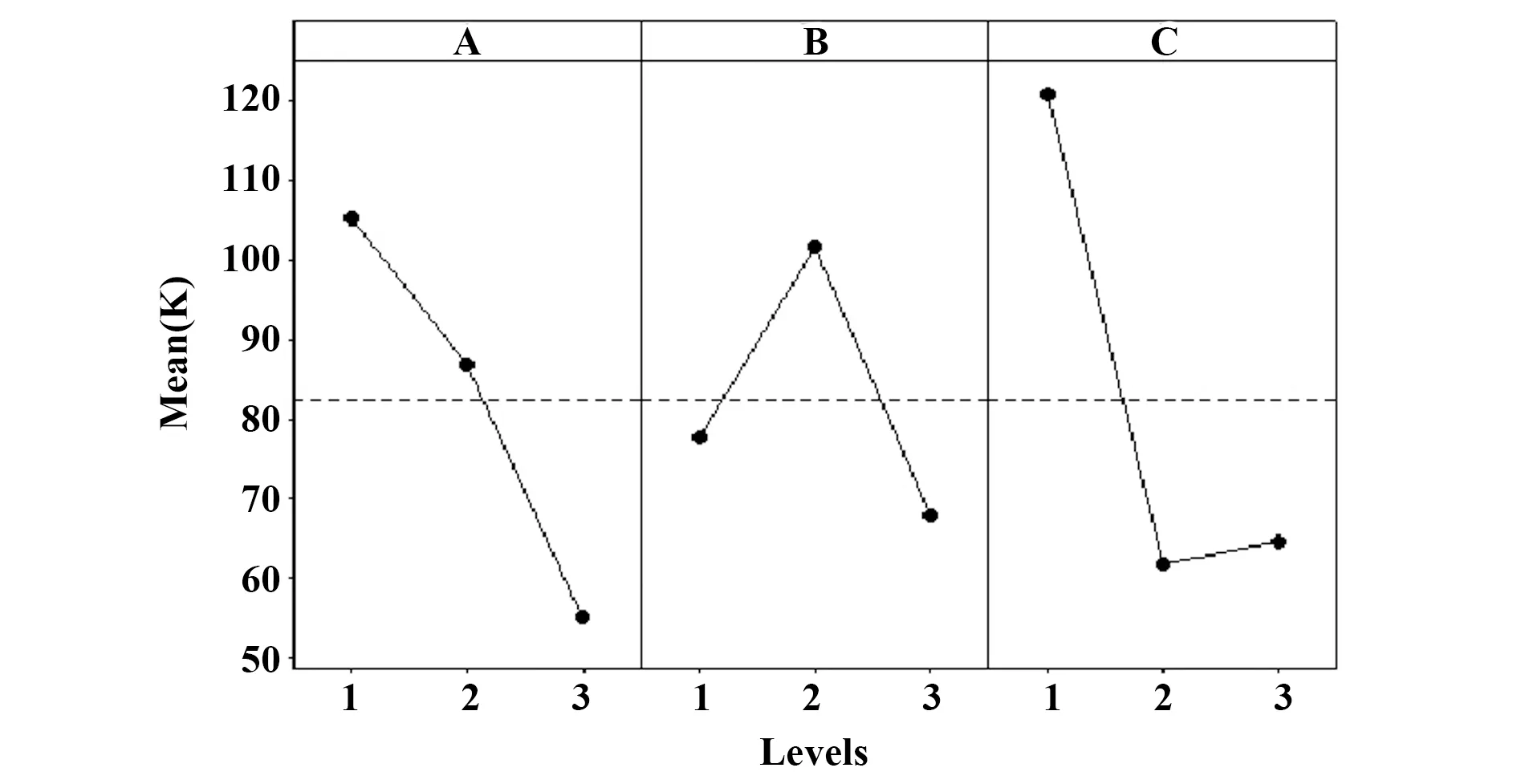
图2 三因子三水平正交实验的均值主效应图(n=3)Fig.2 Main effect map of mean of three-factor three-level orthogonal test(n=3)
无血清培养基作为空白对照组,将新鲜分离的PBMCs以1×106cells/ml的细胞密度接种于装有20 ml 添加甘露糖和葡萄糖醛酸的无血清培养基的T75方瓶中,并按1.2.1中所述的方法加入细胞因子刺激CIK细胞生成;培养4 d后细胞密度恢复至初始接种密度转移至细胞培养袋中,每天取样计数,隔天补入新鲜的培养基和细胞因子维持细胞密度为1×106cells/ml,总共培养14 d。
2.2.1CIK细胞的扩增 培养过程中细胞活性以及总细胞扩增倍数如图3所示。从中可以看出,无论是否添加甘露糖和葡萄糖醛酸,在整个培养过程中细胞活性均维持在80%以上(图3A),而培养14 d后添加甘露糖和葡萄糖醛酸组的总细胞扩增倍数为29.38±5.20,显著高于对照组的18.36±4.03(P<0.05)(图3B)。可见,甘露糖和葡萄糖醛酸组合应用可促进总细胞的扩增。
经过流式细胞仪检测可以得到培养物中CD3+、CD3+CD56+、CD3+CD8+细胞的比例,见表6。可以看出,PBMC中CD3+、CD3+CD56+、CD3+CD8+细胞的初始比例分别为(35.32±8.15)%、(4.42±0.65)%、(12.80±0.95)%,体外培养14 d后添加甘露糖和葡萄糖醛酸组中三类效应细胞的比例分别增至(91.67±2.57)%、(15.93±3.78)%、(57.47±3.81)%,与对照组无显著性差异(P>0.05)。可见,甘露糖和葡萄糖醛酸组合应用不影响各类效应细胞的比例。
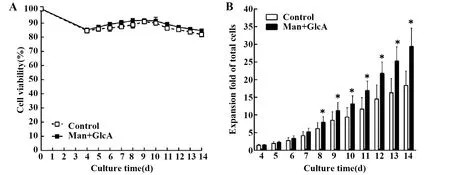
图3 甘露糖和葡萄糖醛酸组合应用对总细胞扩增的影响Fig.3 Effect of combined application of mannose and glucuronic acid on total cell expansionNote: A.Cell viability;B.Expansion fold of total cells;n=3.Compare with control,*.P<0.05.
表6 甘露糖和葡萄糖醛酸组合应用对各类效应细胞比例的影响(n=3)
Tab.6 Effect of combined application of mannose and glucuronic acid on percentage of effector cells (n=3)

Culturetime (d)The percentage of effector cells in the control group (%)CD3+cellsCD3+CD56+cellsCD3+CD8+cellsThe percentage of effector cells in the Man+GlcA group (%)CD3+cellsCD3+CD56+cellsCD3+CD8+cells035.32±8.154.42±0.6512.80±0.9535.32±8.154.42±0.6512.80±0.951489.80±3.2114.23±2.3754.63±6.0991.67±2.5715.93±3.7857.47±3.81
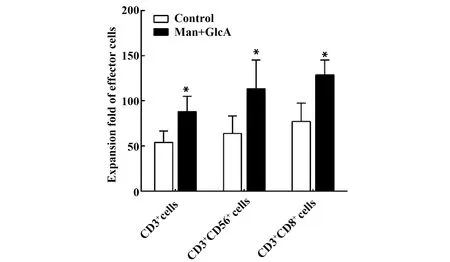
图4 甘露糖和葡萄糖醛酸组合应用对各类效应细胞扩增倍数的影响(n=3)Fig.4 Effect of combined application of mannose and glucuronic acid on expansion fold of effector cells (n=3)Note: Compare with control,*.P<0.05.

图5 甘露糖和葡萄糖醛酸组合对效应细胞中表达颗粒酶B和穿孔素的细胞比例的影响Fig.5 Effect of combined application of mannose and glucuronic acid on percentage of Granzyme B+ cells and Perforin+ cells in effector cellsNote: A.The percentage of Granzyme B+ cells in effector cells;B. The percentage of Perforin+ cells in effector cells;n=3.*. P<0.05.
各类效应细胞的扩增倍数如图4所示。培养14 d后添加甘露糖和葡萄糖醛酸组中CD3+、CD3+CD56+、CD3+CD8+细胞的扩增倍数分别为87.96±16.95、113.17±31.87、128.73±16.45,明显高于对照组的53.87±12.57、63.69±19.52、77.14±20.35(P<0.05)。可见,甘露糖和葡萄糖醛酸组合应用可促进各类效应细胞的扩增。
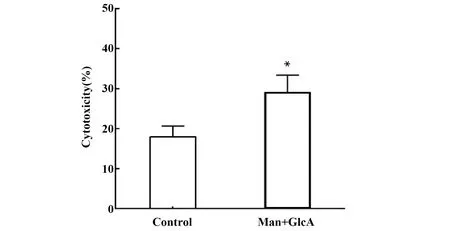
图6 甘露糖和葡萄糖醛酸组合对扩增后CIK细胞的杀伤活性的影响(n=3)Fig.6 Effect of combined application of mannose and glucuronic acid on cytotoxicity of expanded CIK cells (n=3)Note: Compare with control,*.P<0.05.
2.2.2CIK细胞的功能 CIK细胞可通过分泌颗粒酶B和穿孔素发挥杀伤肿瘤细胞的功效,检测各类效应细胞中表达颗粒酶B和穿孔素细胞的比例,结果见图5。培养14 d后,添加甘露糖和葡萄糖醛酸组的各类效应细胞中表达颗粒酶B和穿孔素的细胞比例均有所提高,其中CD3+CD8+细胞中表达颗粒酶B的细胞比例为(50.00±17.64)%,显著高于对照组的(40.87±19.48)%(P<0.05)(图5A);而 CD3+细胞和CD3+CD56+细胞中表达穿孔素的细胞比例分别为(57.00±7.50)%和(49.47±7.15)%,显著高于对照组的(28.60±6.27)%和(30.80±4.71)%(P<0.05)(图5B)。可见,甘露糖和葡萄糖醛酸组合应用可提高CIK细胞中表达颗粒酶B和穿孔素的细胞比例。
添加甘露糖和葡萄糖醛酸对扩增后CIK细胞肿瘤杀伤活性的影响见图6。当培养14 d后的CIK细胞与K562细胞以10∶1的效靶比共培养时,添加甘露糖和葡萄糖醛酸组所扩增的CIK细胞的杀伤活性为(29.03±4.34)%,显著高于对照组的(17.93±2.65)%(P<0.05)。可见,在无血清培养基中添加甘露糖和葡萄糖醛酸组合,有助于提高扩增后CIK细胞的杀伤活性。
3 讨论
已有文献报道,采用CIK细胞治疗有利于提高肝细胞癌、结直肠癌和胃癌等癌症患者的无进展生存期和总生存期[23],具有临床应用价值。而如何获取足够数量且具有功能的CIK细胞是细胞治疗领域所需要解决的关键技术问题之一。由于血清成分复杂,实际应用中血清培养存在诸多限制,因此,开发高效无血清培养基成了细胞治疗级效应细胞体外扩增领域的热点[24]。
本文在前期工作中发现CIK细胞在添加黄原胶的无血清培养基中具有较好的扩增效果的基础上,采用正交实验对组成黄原胶的葡萄糖、甘露糖、葡萄糖醛酸的最优组合和最适添加剂量进行了探索。研究发现利用添加2.20 mmol/L甘露糖、0.10 mmol/L葡萄糖醛酸的无血清培养基体外培养PBMCs时,总细胞数目在14 d内扩增了(29.38±5.20)倍,其中主要效应细胞CD3+CD56+细胞的比例可达到(15.93±3.78)%,扩增倍数为113.17±31.87,均明显高于不添加甘露糖、葡萄糖醛酸的对照组(P<0.05)。此外,效应细胞中表达颗粒酶B和穿孔素的细胞比例也明显高于对照组,且扩增后CIK细胞对K562细胞的杀伤活性也显著提高(P<0.05)。因此可以说明甘露糖和葡萄糖醛酸的组合应用可在促进CIK细胞有效扩增的同时提高CIK细胞的肿瘤杀伤能力。该结果可为CIK细胞体外扩增技术的优化提供技术支持。
然而,甘露糖和葡萄糖醛酸促进CIK细胞扩增的作用机理尚不明确。相关研究表明甘露糖可刺激巨噬细胞分泌IL-6、TNF-α等细胞因子,同时具有调节T细胞增殖和分化的功能[25-27]。Lewis等[28]发现葡萄糖醛酸可作用于免疫细胞表面的Toll样受体4(Toll-like receptor 4,TLR4),诱导TNF-α、IL-1、IL-6等促炎症因子的释放。因此,后续研究将从细胞因子分泌和信号通路激活的角度进一步探究甘露糖、葡萄糖醛酸促进CIK细胞体外扩增的机理。

