miR-92b-3p对结直肠癌细胞增殖的影响及其可能机制的初步探讨*
龚磊,彭洪,任明扬,张涛,田云鸿,彭明沙
1 南充市中心医院胃肠外科 四川南充 637000
2 南充市中心医院中西医结合肛肠科 四川南充 637000
3 南充市中心医院消化内科 四川南充 637000
结直肠癌在恶性肿瘤中死亡率较高[1]。目前采用的综合治疗策略已较前改善患者预后,但是复发及化疗抵抗的患者预后仍然较差[2],因此对结直肠癌发病机制的不断探究将有助于为临床治疗提供新的思考方向。微小RNA(microRNAs)是参与细胞中基因表达转录后调控的断链非编码RNA,影响着多种生物学过程,如细胞发育、增殖及分化等。有研究[3-4]表明,miRNA既可以扮演致癌基因又可以起到抑癌基因的作用来调节肿瘤的增殖及凋亡过程。miR-92b-3p与肿瘤相关,其过表达可抑制TGF-β/Smad3/p21信号通路增加胶质母细胞瘤的增殖活性,但亦可靶向PTEN/Akt信号通路抑制胶质瘤细胞的增殖、侵袭和迁移并刺激细胞凋亡[5-6]。有研究报道,miR-92b-3p与结直肠癌患者预后有关[7],然而miR-92b-3p与结直肠癌发生发展的关系尚不完全清楚。本研究旨在探讨miR-92b-3p在结直肠癌组织及细胞中的表达并探讨其可能的作用机制,现报告如下。
1 材料和方法
1.1 材料
人结直肠癌HCT116细胞株及人正常结直肠黏膜细胞(FHC)购自中科院上海细胞库。miR-92b-3p inhibitor(Cat.No.:MIH03934)购自加拿大ABM公司。
收集2017年1月至2018年4月年在南充市中心医院行根治性手术的30例结直肠癌患者组织标本(左半结肠癌8例、右半结肠癌6例、直肠癌16例)及匹配的癌旁黏膜组织(距肿瘤约3 cm),在标本离体后30 min以内将结直肠癌组织标本及癌旁组织切成直径为0.5 cm左右的组织块,装入灭菌冻存管中,迅速放入液氮罐中保存。病理切片证实结直肠癌组织标本为原发性结直肠癌,并且癌旁黏膜组织为正常黏膜组织。患者年龄40~89岁,术前经肠镜活检病理诊断为结直肠癌,且在接受肠镜检查后1个月内容接受结直肠癌根治术,排除既往有其他器官或组织恶性肿瘤病史、合并其他恶性肿瘤、术前接受其他抗肿瘤治疗情况。本研究经南充市中心医院伦理委员会审批通过。
1.2 方法
1.2.1 分析miR-92b-3p在结直肠癌组织、癌旁正常组织及细胞株中的表达 提取30例结直肠癌组织标本及癌旁正常组织标本的RNA并进行逆转录,合成cDNA第一链,然后进行扩增,40个循环后用Agilent Stratagene荧光定量PCR仪Mx3000P进行PCR实验,检测miR-92b-3p的表达。实验按照2-△△Ct方法处理数据。同时收集培养的HCT116及FHC细胞,提取RNA并进行逆转录,使用qPCR法检测miR-92b-3p的表达。引物序列:miR-92b-3p RT CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGGA -GGCC,miR-92b-3p F ACACTCCAGCTGGGTATTGCACTCGTCCCGGC。内参引物序列:U6 F CTCGCTTCGGCAGCACA,U6R AACGCTTCACGAATTTGCGT。
1.2.2 分析抑制miR-92b-3p表达对细胞增殖的影响 将106个HCT116细胞铺于6孔板中,将miR-92b-3p inhibitor转染至HCT116细胞中,并设置阴性对照组(NC,培养液中加入生理盐水)。培养48 h后将HCT116细胞接种于96孔板(每孔含104个细胞),然后将培养基与CCK-8按照10:1比例混合,每孔加入100 μL的CCK-8混合液,将96孔板放到培养箱内孵育4 h后将培养基移至酶标板,使用酶标仪检测24 h、48 h、72 h的OD值(450 nm)。
1.2.3 筛选和验证miR-92b-3p靶基因 使用生物信息学方法(Targetscan)对miR-92b-3p靶基因进行预测。Targetscan可预测miRNA种子区(miRNA上进化最为保守的片段)与mRNA 3’-UTR靶位点是否完全互补结合,根据预测结果选择候选靶基因(按照预测结果为FBXW7),并用双荧光素酶报告基因法进行验证,按照说明书进行操作。
1.2.4 分析FBXW7过表达对细胞增殖情况的影响 构建FBXW7过表达载体,引物由上海生工有限公司合成,序列如下:FBXW7-F1 GGGGTACCATGTCAAAACCGGGAAAAC,FBXW7-R1 ATTTGCGGCCGCTCACTTCATGTCCACATCAAA。在96孔板内接种100 μL密度为105/mL的细胞悬液,常规培养24 h后在25 μL的DMEM无血清培养基中加入0.4 μg pcDNA3.0-FBXW7质粒,并在25 μL的DMEM无血清培养基中加入0.4 μL lipofectamine 3000,混匀后将pcDNA3.0-FBXW7质粒与lipofectamine 3000混合,混合后室温放置20 min,然后将50 μL pcDNA3.0-FBXW7质粒/Lipofectamine 3000复合物加到培养板的孔中(含细胞和培养基)培养,并设置阴性对照组(NC,转染空载质粒)。使用CCK-8法检测HCT116细胞pcDNA3.0-FBXW7组及NC组在24 h、48 h、72 h的OD值。
1.2.5 分析沉默FBXW7对miR-92b-3p下调HCT116细胞增殖能力的影响 通过FBXW7 siRNA沉默FBXW7,设置空白组(blank,只加培养基),阴性对照组(NC,FBXW7无同源性无义序列),miR-92b-3p inhibitor组及miR-92b-3p inhibitor+FBXW7 siRNA组,检测各组HCT116细胞在24 h、48 h、72 h的OD值,探讨miR-92b-3p是否通过靶向FBXW7调控细胞增殖。
1.3 统计学分析
2 结果
2.1 miR-92b-3p在结直肠癌组织、癌旁正常组织及细胞株中的表达
miR-92b-3p在结直肠癌组织中的表达水平为(1.355±0.516),高于癌旁正常组织的(0.810±0.318),差异有统计学意义(P<0.001),见图1。miR-92b-3p在HCT116中表达水平为(9.055±0.157),高于FHC中的(1.010±0.173),差异有统计学意义(t=1448.266,P<0.001)。
2.2 NC组与miR-92b-3p inhibitor组细胞OD值比较
两组在24 h的OD值比较,差异无统计学意义(P>0.05)。miR-92b-3p inhibitor组在48 h、72 h的OD值低于NC组,差异均有统计学意义(均P<0.05)。见表1。
2.3 FBXW7是miR-92b-3p的靶基因
使用生物信息学方法对miR-92b-3p的靶基因进行预测,发现FBXW7是miR-92b-3p可能的靶基因,通过双荧光素酶报告基因法进行验证,引物序列FBXW7 WT 5-GACCAGUGAAUAAGGGGACGGGG-3,FBXW7 MUT 5-GACCAGUGAAUAAGGCCUGCCCG-3(在正常模板链上,加入突变引物进行扩增,引入突变位点),发现miR-92b-3p与野生型FBXW7 3’UTR结合,结果表现为相对荧光强度的下调,而当FBXW7 3’UTR与miR-92b-p结合位点被突变后,相对荧光强度与对照组间比较,差异无统计学意义,双荧光素酶报告基因法提示FBXW7可与miR-92b-3p靶向结合。见图2、图3。
2.4 NC组与FBXW7过表达组细胞OD值比较
在HCT116细胞中转染FBXW7过表达载体后,与NC组相比,FBXW7过表达组在24 h、48 h、72 h的OD值均降低,差异均有统计学意义(均P<0.05)。见表2。
2.5 NC组、blank组、miR-92b-3p inbibitror组与Inbibitror+siRNA组细胞OD值比较
在24 h、48 h、72 h四个时间点,四组间差异均有统计学意义(均P<0.05)。在24 h时,NC组、miR-92b-3p inbibitror组及miR-92b-3p inbibitror+siRNA组的OD值均低于blank组(均P<0.05);在48 h及72 h时,miR-92b-3p inbibitror组与miR-92b-3p inbibitror+siRNA组的OD值均低于NC组、Blank组,miR-92b-3p inbibitror组的OD值低于miR-92b-3p inbibitror+siRNA组(均P<0.05)。见表3。
3 讨论
既往研究发现血液中高表达的miR-92b-3p可以作为滑膜肉瘤新的肿瘤标志物,也有报道miR-92b-3p在原发性脑肿瘤中特异性高表达,并可调节小鼠胚胎脑中的中间皮层祖细胞的发育[8-9]。不仅如此,使用miR-92b-3p特异性抑制剂下调miR-92b-3p表达可通过靶向Dkk3基因及阻断Wnt/beta-catenin信号通路促进胶质瘤细胞的凋亡[10]。上述研究结果表明miR-92b-3p可以作为促癌miRNA发挥作用。本研究结果发现miR-92b-3p在结直肠癌组织中的表达水平高于癌旁正常组织,并且miR-92b-3p在结直肠癌细胞株HCT116细胞中的表达水平高于人正常结直肠黏膜细胞FHC,说明miR-92b-3p参与结直肠癌的发生发展。进一步的实验发现抑制miR-92b-3p表达可降低HCT116细胞增殖能力,表明miR-92b-3p可以作为癌基因促进结直肠癌的发生。
表1 NC组与miR-92b-3p inhibitor组细胞OD值比较(ˉ±s)
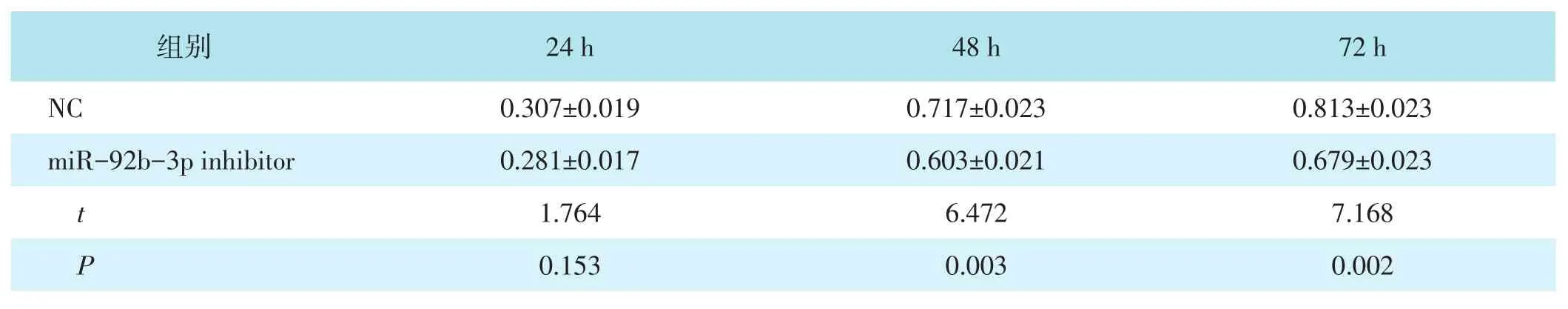
表1 NC组与miR-92b-3p inhibitor组细胞OD值比较(ˉ±s)
组别NC miR-92b-3p inhibitor t P 24 h 0.307±0.019 0.281±0.017 1.764 0.153 48 h 0.717±0.023 0.603±0.021 6.472 0.003 72 h 0.813±0.023 0.679±0.023 7.168 0.002

图1 miR-92b-3p在结直肠癌组织及癌旁正常组织中的表达

图2 miR-92b-3p和FBXW7可能结合位点
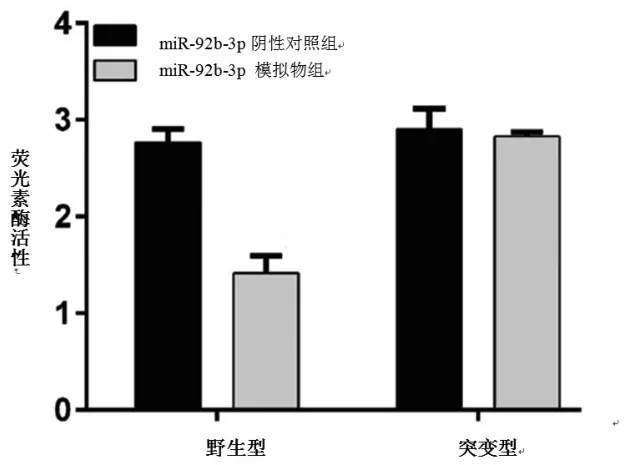
图3 荧光素酶活性比较
表2 NC组与FBXW7过表达组细胞OD值比较(±s)
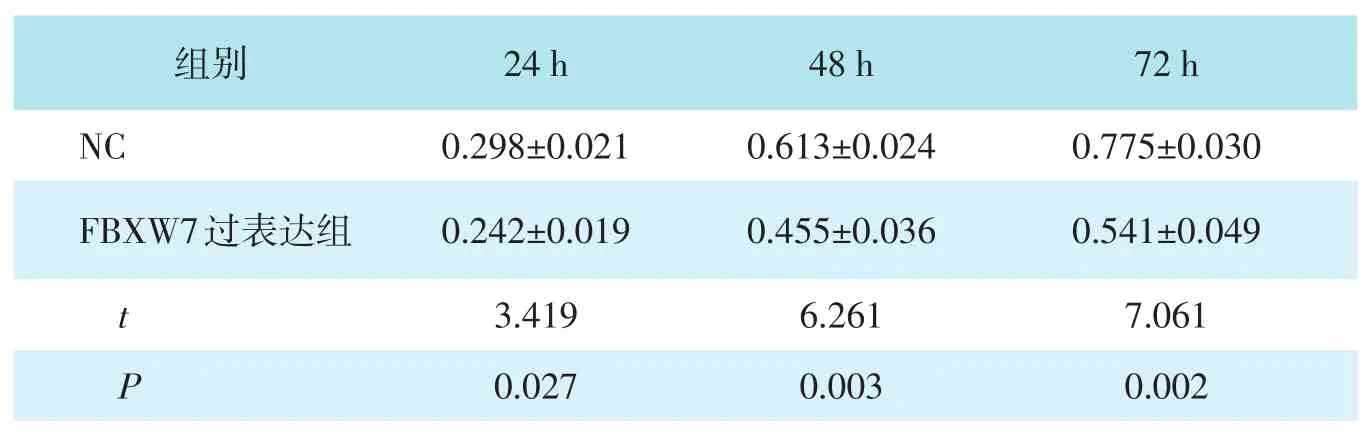
表2 NC组与FBXW7过表达组细胞OD值比较(±s)
组别NC FBXW7过表达组t P 24 h 0.298±0.021 0.242±0.019 3.419 0.027 48 h 0.613±0.024 0.455±0.036 6.261 0.003 72 h 0.775±0.030 0.541±0.049 7.061 0.002
表3 NC组、blank组、miR-92b-3p inbibitror组与Inbibitror+siRNA组细胞OD值比较(±s)

表3 NC组、blank组、miR-92b-3p inbibitror组与Inbibitror+siRNA组细胞OD值比较(±s)
与NC组相比,*P<0.05;与blank组相比,△P<0.05;与inhibitor组相比,▲P<0.05。
组别NC blank inbibitror inbibitror+siRNA F P 24 h 0.246±0.022 0.312±0.020*0.251±0.019△0.250±0.019△7.655 0.010 48 h 0.658±0.031 0.662±0.036 0.376±0.045*△0.533±0.051*△▲31.756<0.001 72 h 0.868±0.053 0.898±0.054 0.456±0.039*△0.708±0.039*△▲56.104<0.001
通过与靶基因3’-UTR直接结合,miRNA可以抑制细胞增殖和转移相关信号通路关键基因的表达[11]。为了探讨miR-92b-3p促进结直肠癌发生发展的机制,通过生物信息学方法对miR-92b-3p的靶基因进行预测,发现FBXW7可能是miR-92b-3p的靶基因,并经双荧光素酶报告基因法进行验证FBXW7可与miR-92b-3p靶向结合。FBXW7基因是F-box蛋白家族成员之一,其作为S期激酶相关蛋白1、Cullin1、F-box蛋白E3连接酶复合物的底物识别亚基,它可以降解促进细胞增殖、生长及调节细胞凋亡的多种肿瘤蛋白[12]。鉴于FBXW7降解癌蛋白的功能,FBXW7被认为是一种肿瘤抑制基因,它的表达缺失可以阻止细胞分裂和干细胞分化,增强染色体不稳定性,并可导致造血细胞肿瘤的形成[13-14]。既往研究发现FBXW7在肝癌、肺癌及胰腺癌等多种恶性中低表达,也包括结直肠癌[15-16]。含有FBXW7错义突变的转移性结直肠癌患者与含有野生型FBXW7的患者相比,其总体生存时间较短[17],并且结直肠癌患者FBXW7的表达缺失还与奥沙利铂的耐药有关[18]。本研究发现在HCT116细胞中过表达FBXW7对HCT116细胞增殖能力有影响,说明FBXW7可发挥抑癌基因的作用。为了探讨miR-92b-3p是否通过FBXW7调控HCT116细胞增殖,设置blank、NC、miR-92b-3p inbibitror组及miR-92b-3p inbibitror+FBXW7 siRNA组,发现相对于blank和NC组,miR-92b-3p inbibitror组HCT116细胞OD值下降,但是在miR-92b-3p inbibitror+FBXW7 siRNA组较miR-92b-3p inbibitror组HCT116细胞OD值有所提升,提示沉默FBXW7能够部分逆转miR-92b-3p下调引起的增殖能力下降,miR-92b-3p可能通过FBXW7发挥调控作用。
综上所述,miR-92b-3p在结直肠癌的发生发展过程中起到促癌基因的作用,其可能通过调控FBXW7影响结直肠癌细胞的增殖,其具体作用机制需要进一步的研究。

