糖尿病视网膜病变伴糖尿病肾病患者的血浆蛋白质组学研究
阎 利 刘 颖 张华北 陈建斌 李志琛 梅伟群 钱佳丽 欧阳建
糖尿病视网膜病变(DR)和糖尿病肾病(DN)是糖尿病的两个主要微血管并发症,严重影响患者的生活质量。糖尿病患者同时伴有DN的情况普遍,本研究应用Label-free蛋白质组定量技术,筛选DR伴DN患者血浆中差异表达蛋白,结合生物信息学分析,寻找DR、DN共病的机制和共同的干预靶点。
1 对象与方法
1.1 研究对象 本研究经解放军第903医院伦理委员会审查批准。选择2型糖尿病患者14例,其中8例伴DR和DN(DNDR组),6例不伴DN和DR(DM组),两组间患者的年龄、糖化血红蛋白、病程的差异均无统计学意义(P值均>0.05)。所有患者均符合1999年WHO糖尿病诊断标准,血糖控制稳定。DNDR组纳入标准:①依据2002年DR国际分期标准,双眼眼底彩色照相检查符合中度以上非增殖性DR(NPDR)或增殖性DR(PDR);②依据2012年美国糖尿病学会(ADA)筛查和诊断标准,测定即时尿白蛋白/肌酐(uACR)≥30 mg/g,3个月内3次ACR至少有2次升高。DM组纳入标准:眼底照相除外DR,uACR<30 mg/g。排除标准:①高血压病、冠状动脉性心脏病(简称冠心病)、慢性阻塞性肺疾病、恶性肿瘤、脑卒中;②1型糖尿病(T1DM)、妊娠糖尿病和特殊类型糖尿病;③严重角膜病变、白内障等影响眼底检查;④葡萄膜炎、闭角型青光眼;⑤除DR外的其他视网膜疾病;⑥剧烈运动、发热、尿路感染、肾病综合征等其他原因导致ACR升高。查肌电图、血糖、血脂、肝肾功能、纤维蛋白原、血压、心电图、心脏超声、颈动脉和下肢血管超声,两组患者上述检查结果的差异均无统计学意义(P值均>0.05)。所有入选患者均了解研究方案并签署知情同意书。
1.2 方法 由深圳华大基因公司对14例患者的血浆标本进行质检和Label-free定量蛋白组学质谱检测,每份标本检测2次,总蛋白、肽段、谱图数目均合格。
1.2.1 主要试剂和仪器 强阳离子交换柱(SCX)、Luna SCX购自美国Phenomenex公司;质谱仪(Triple TOF 5600)购自美国AB CSIEX公司。酶联免疫吸附Human PDI ELISA Kit(LM-PDI-Hu)购自上海联迈生物工程有限公司;KRT1 ELISA试剂盒(H-EL-KRT1)购自上海泽叶生物科技有限公司(ZYbscience)。
1.2.2 蛋白质提取和定量 取100 μg血浆,按蛋白质分离标准流程进行操作,考马斯亮蓝法(Bradford法)定量。
1.2.3 SD电泳 使用12% SDS-PAGE。14份血浆样本的电泳图均合格。
1.2.4 蛋白质酶解 每个样品取100 μg蛋白。按蛋白∶酶为20∶1的比例加入胰蛋白酶,37 ℃酶解4 h。按上述比例再补加胰酶1次,37 ℃继续酶解8 h。
1.2.5 SCX 应用岛津LC-20AB液相系统、UltremexSCX分离柱(4.6 mm×250 mm)对样品进行液相分离,经筛选得到12个组分。
1.2.6 液相串联质谱(LC-MS/MS) 通过岛津LC-20AD纳升液相色谱仪进行分离。扫描模式为反射模式,分辨率≥30 000,每次扫描的粒子信号以4个通道分别记录,共4次后合并转化成数据。
1.3 生物学信息分析
1.3.1 MS/MS质谱数据检索和定量 应用MASCOT搜索引擎检索,所用数据库为Swissprot人的蛋白质数据库,链接地址为http:∥www.uniprot.org。应用PeakView1.1中的Protein Quantitation 1.0 MicroApp软件进行定量,搜索相应的人数据库IPI_human_3.87.fasta,IPI数据库结果与Swissprot相匹配。
1.3.2 差异蛋白质界定 取DNDR、DM组样品丰度值的均数和中位数,分别计算两组间各个蛋白质相应的比值。设定均数和中位数差异倍数上下调均≥2.5倍为差异表达蛋白质。
1.3.3 基因本体(GO)、生化代谢和信号转导通路注释(Pathway) GO注释包括3个本体,分别描述分子功能(GO-F)、生物过程(GO-P)、细胞组分(GO-C)。
1.3.4 GO、Pathway功能显著性富集分析 应用超几何检验,找出与所有蛋白质背景相比,在差异蛋白质中显著富集的GO条目,明确差异蛋白质与哪些生物学功能显著相关。以京都基因与基因组百科全书(KEGG)中的Pathway为单位,找出与所有鉴定到的蛋白质背景相比,在差异蛋白质中显著性富集的Pathway,通过Pathway显著性富集确定差异蛋白质参与的最主要的生化代谢和信号转导通路。
1.3.5 蛋白质互作网络分析使用 应用Medusa.jar软件进行蛋白质互作网络分析,网址为http:∥ftp.ncbi.nlm.nih.gov/gene/GeneRIF/。
1.3.6 差异蛋白质验证 采用ELISA法检测两组血浆中角蛋白1(KRT1)和蛋白二硫键异构酶(PDI)的表达,按试剂盒说明在标准实验室完成,验证蛋白质组学分析结果。

2 结 果
2.1 Label-free血浆蛋白质谱检测和鉴定 比较DNDR组与DM组样品的丰度值,共筛选出差异表达蛋白质49个,其中上调35个,下调14个。见表1。

表1 差异表达蛋白质
2.2 GO注释和富集分析 GO富集分析显示,差异表达蛋白质涉及22种GO-P,包括生物粘连、生物调节、细胞成分组织或生物发生、细胞过程、发育过程、建立定位、生长、免疫系统过程、定位、运动、代谢过程、多生物过程、多细胞生物过程、生物过程的负调节、生物过程的正调节、生物过程的调节、再生、再生过程、对刺激的响应、韵律过程、信号传递、单一生物过程,其中单一生物过程占绝对优势;涉及13种GO-C,包括细胞、细胞部分、细胞外基质(ECM)、ECM部分、细胞外区域、细胞外区域部分、大分子复合物、膜、膜部分、腔上内膜、类核、细胞器、细胞器部分、抗氧化活性,其中细胞外区域占比最高;涉及9种GO-F,包括结合或催化活性、电子载体活性、酶调节剂活性、分子换能器活性、受体活性、结构分子活性、载体活性,其中结合蛋白占比最高。
2.3 Pathway注释和富集分析 Pathway富集到了多个代谢通路。Papilin(PAPLN)为上调最明显的蛋白质,但未富集到相关代谢通路。下调最明显的PDI在内质网蛋白质加工Pathway,PDI和内质网氧化还原酶1(ERO-1)驱动内质网中蛋白质二硫键的形成。ERO-l借助黄素腺嘌呤二核苷酸依赖性反应将电子从PDI经历几种硫醇-二硫化物交换反应转移到分子氧,氧的不完全还原导致超氧阴离子自由基形成,后者可以转化为过氧化氢或其他活性氧,引起内质网中蛋白质折叠诱发的氧化应激,进而在内质网的蛋白质加工中起作用。
2.4 差异蛋白质相互作用网络分析 APOC2、CST3、ADAMTSL4、KRT1、GP5、IGJ、ECM1、CPS1、GAPDH、SERPINA3之间有相互作用。
2.5 ELISA法验证血浆KRT1、PDI水平 DNDR组血浆KRT1水平显著高于DM组(P<0.05),血浆PDI水平显著低于DM组(P<0.05),见表2。ELISA法验证结果与Label-free蛋白组质谱检测结果基本一致。

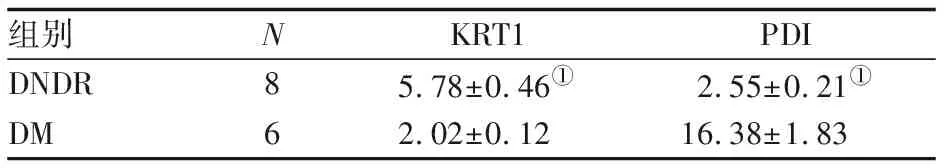
组别NKRT1 PDIDNDR85.78±0.46①2.55±0.21①DM6 2.02±0.1216.38±1.83
与DM组比较:①P<0.05
3 讨 论
Christensen等[1]报道215例伴微量白蛋白尿的糖尿病患者中80%伴DR,El-Asrar等[2]的研究发现,87%的PDR患者伴有DN,表明糖尿病患者中DR与DN共患病的比例很高。DR和DN是致盲和终末期肾病最重要的病因之一,严重影响患者的生活质量。研究[3]结果表明,严格控制血糖可降低DR和DN的发生风险,但并不能完全阻止其发生与进展。临床中也发现不少糖尿病患者持续高血糖却不发生微血管并发症。在单卵双生双胞胎中,DRDN有一致的患病率[4],表明两者的发生具有一定的遗传倾向和家族聚集性。Label-free蛋白质组定量技术根据质谱的丰度来对肽段或蛋白质进行相对定量,能够同时对多种蛋白质进行检测,血浆中特定蛋白质组及其浓度的变化对多基因病的发生和发展有着重要的预警作用。本研究以DR伴DN的患者作为研究对象,行血浆蛋白质组学检测,筛选DN伴DR的相关蛋白质,为进一步发现DR、DN共病的血浆标志物和新的治疗靶点提供依据。
本研究共筛选出49个DR伴DN差异表达蛋白质,以均数和中位数差异倍数作为筛选条件,避免了因样本量较少所致的数据偏倚。蛋白质组研究中一般以差异倍数1.2~3.0倍作为筛选条件,为了在大量蛋白质中过滤出差异显著的蛋白质,避免剔除有意义的蛋白质,本研究选择差异倍数上下调均≥2.5倍作为筛选标准[5]。本研究在GO功能富集的基础上,通过GO、Pathway显著性富集分析确定了相关蛋白质的功能和参与的生化代谢途径。差异表达蛋白质相互作用网络分析显示多个差异表达蛋白质有相互作用,富集性分析发现一种蛋白质可以参与多个GO或Pathway,也可以多种蛋白质属于一个GO或Pathway,表明DNDR的发生和发展是多种蛋白质相互作用的结果。在49个差异表达蛋白质中,少数蛋白质已有文献报道与DR、DN有关,如RBP4与DR发病有关[6], CysC与DN有关[7],S100A9与DR、DN有关[8],本研究也发现上述蛋白质存在差异表达。
除上述蛋白质以外,本研究还发现其他一些差异蛋白质,需要进一步验证。KRT1存在于表皮的上层、内皮细胞的表面和神经母细胞瘤NMB7的细胞膜中,与皮肤的结构完整性有关。KRT1可调节蛋白激酶C的活性,参与凝集素途径的补体激活、纤维蛋白溶解、血管生成和对氧化应激的反应。KRT1基因变异可引起表皮松解性鱼鳞病等皮肤病变。研究[9]发现,中国汉族人群KRT1的变异和KRT1的特异性多态性与系统性红斑狼疮和系统性硬化症有关。另有研究[10]发现,玻璃体内注射雷珠单抗治疗的PDR患者,玻璃体中KRT1水平升高。本研究发现DNDR组患者血浆中KRT1水平明显升高,可能通过炎性反应、纤维蛋白溶解、血管生成和对氧化应激等机制参与DR、DN的发病。
ECM1是一种糖蛋白,参与许多生物过程,与乳腺癌、肝细胞癌等肿瘤有关。有学者收集了10例2型糖尿病患者的尿液样本,分为正常、微量和大量白蛋白尿,将他们的尿蛋白质组与10名健康个体进行比较,在大量白蛋白尿患者尿液中检测到ECM1[11]。还有研究发现,ECM1可影响系膜细胞增殖,但其与DR的关系鲜见报道,本研究检测到DNDR组中ECM1上调,其在DN、DR中的作用机制有待进一步研究。
SERPINA3蛋白又名α1-抗胰蛋白酶,是人血浆中蛋白酶抑制剂——组织蛋白酶G的抑制剂,参与ECM蛋白质的降解。SERPINA3可降低细胞间的黏附,抑制细胞凋亡,因此与恶性肿瘤的发生密切相关, SERPINA3蛋白是典型的急性炎性反应蛋白质,在炎性反应时明显增加[12]。研究发现,炎性反应和ECM的重建在动脉瘤性蛛网膜下腔出血中起作用。本研究中,DNDR组SERPINA3表达上调,且差异表达蛋白质相互作用网络分析显示SERPINA3与ECM有相互作用。蛋白质相互作用网络分析提示,APOC2、CST3、ADAMTSL4、KRT1、GP5、IGJ、ECM1、CPS1、GAPDH、SERPINA3有相互作用,结合上述蛋白质的功能分析,推测在DR伴DN的发生和发展中,上述蛋白质可能通过致动脉粥样硬化、促进新生血管形成、影响凝血系统、炎性反应、免疫反应等机制共同作用导致DN伴DR的发生和发展。
本研究发现,上调最明显的蛋白质为Papilin,在Pathway富集性分析中未发现其参与代谢通路。目前对Papilin的研究较少,发现其主要存在于基底膜中。Papilins与几种ECM成分和ADAMTS酶相互作用,对胚胎发育至关重要。下调最明显的蛋白质PDI是普遍存在的氧化还原酶,主要定位于内质网,在蛋白质折叠中起关键作用。血小板和内皮细胞在血管损伤时分泌PDI,分泌的PDI激活脉管系统中的多个ECM,从而启动血栓形成[13]。PDI的过表达可以保护移植细胞免于缺氧和其他可能发生的内质网应激,并因此增强其再生特性[14]。本研究DNDR组患者PDI表达明显下调,其机制需进一步研究。
本研究基于Label-free定量技术,结合生物信息分析,筛选出血浆中49个DN伴DR差异表达蛋白质,这些差异蛋白质提供了DR伴DN候选血浆标志物,并可能成为干预的新靶点。DR伴DN的发生和发展是多种因素相互作用的结果,通过相互作用网络和GO、Pathway富集分析,挑选出KRT1、ECM1、SERPINA3、PAPLN、PDI等差异表达蛋白质可能在DR伴DN共同发病中发挥重要作用。本研究采用ELISA法对差异表达蛋白质KRT1、PDI进行验证的结果与质谱分析结果一致,提示采用Label-free定量技术寻找DR伴DN相关血浆标志物是有效和可行的。本研究样本量较少,差异表达蛋白质需要在扩大样本的患者中进行验证后确定其在DN伴DR发病中的作用。

