葡萄籽原花青素对缺血性心力衰竭大鼠心肌细胞凋亡及MAPK/ERK1/2通路的影响①
吴婷玉 周景芬
(武汉市第一医院老年病科,武汉430000)
缺血性心力衰竭(Ischemic heart failure,IHF)可导致心肌组织缺血缺氧,心肌细胞坏死,心肌间质纤维化等病变,影响心脏功能[1]。研究发现,缺血性心力衰竭的发生与心肌间质纤维化密切相关,细胞自噬是真核生物特有的一种自我保护机制,可消化大分子物质、受损细胞器等并进行循环利用,在心肌病变过程中具有重要作用[2]。随着分子生物学的进展,信号通路在疾病发展中的作用逐渐受到重视。有丝分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)系列通路,作为机体中重要的信号转导通路之一,参与调控细胞增殖、凋亡等生物学过程,其中MAPK磷酸化后可级联激活下游凋亡相关蛋白表达,促进心肌细胞凋亡[3]。研究表明,MAPK过度激活与缺血性心肌损伤密切相关,抑制MAPK活性可有效改善心脏功能[4]。据此推测,靶向MAPK的新药物开发可为缺血性心力衰竭的临床治疗提供新思路。近年研究表明,葡萄籽原花青素(Grape seed proanthocyanidin extract,GSPE)具有抗凋亡、抗氧化、抗心血管疾病等多种药理作用[5]。然而,GSPE对缺血性心力衰竭所致心脏损伤的保护作用及机制尚不明确。本研究构建缺血性心力衰竭大鼠模型,观察GSPE对缺血性心力衰竭大鼠心脏功能的保护作用并初步探讨其作用机制,试图为GSPE应用于缺血性心力衰竭的治疗提供一定理论支撑。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 清洁级SD大鼠,雌雄各半,体重170~200 g,许可证号:SCXK(沪)-2014-0001,购自上海邦耀生物公司。所有实验SD大鼠均于本院实验动物管理中心集中进行常规饲养,适应1周后随机选取一定数量大鼠用于研究。本研究成功复制IHF模型大鼠75只,随机分成5组:IHF组、低剂量GSPE组、中剂量GSPE组、高剂量GSPE组和阳性对照卡普托利组。自术后第一天起,分别给予各组大鼠相应药物(以生理盐水溶解)处理,低、中、高剂量GSPE组:给予50 mg/kg GSPE、100 mg/kg GSPE、200 mg/kg GSPE灌胃给药;卡普托利组:给予300 mg/kg卡普托利灌胃给药;对照组和模型组:给予等体积生理盐水灌胃处理。各组大鼠均每天定时灌胃给药1次,灌胃容积为1 ml/100 g,持续4周。
1.1.2 主要试剂及仪器 葡萄籽原花青素(GSPE)(含量≥95.0%,货号:hbyc1652)购自湖北远成科技生物公司;卡普托利(Captopril,CAPT)(规格:12.5 mg×100粒,货号:C14200011098)购自上海施贵宝制药有限公司;蛋白抽提试剂盒、戊二醛、戊巴比妥钠购自碧云天公司;DAB显色试剂盒购自中杉金桥公司;兔源一抗cleaved-caspase9抗体(货号:ab25758)、cleaved-caspase3抗体(货号:ab90437)、JNK抗体(货号:ab208035)、ERK1/2抗体(货号:ab115799)、p38MAPK抗体(货号:ab126425)、p-JNK抗体(货号:ab76572)、p-ERK1/2抗体(货号:ab200807)、p-p38MAPK抗体(货号:ab207483)、GAPDH抗体(货号:ab181602)、羊抗兔二抗抗体(货号:ab6721)均购于美国Abcam公司;蛋白电泳仪购自美国Bio-Rad公司;透射电子显微镜(H-7500)购自日本日立公司等。
1.2 方法
1.2.1 CHF模型的制备 参照文献[6]中方法复制缺血性心力衰竭模型大鼠。手术前,将2.5%戊巴比妥钠(50 mg/kg)注射进大鼠腹腔进行麻醉。彻底麻醉后,将大鼠固定在手术台上(仰卧位),沿腹部中线切开腹腔,暴露出腹主动脉和下腔静脉。在距大鼠髂骨动脉根部上方约3 mm处夹闭腹主动脉,并做U形缝合,将18G留置针于缝合处贴血管前壁向上穿刺进入腹主动脉,小心沿右上方向推行,至腹腔静-动脉联合壁时,刺破进入下腔静脉造瘘,拔除穿刺针,打紧U型缝合线,逐层缝合腹部肌肉并消毒,成功构造慢性心衰模型。对照组只穿刺腹主动脉不刺破下腔静脉,其余操作均同模型组。术后统一进行常规喂养。若造模大鼠数量不足预定数量,则通过随机原则取备用大鼠补足。
1.2.2 大鼠超声心脏血流动力学检测 GSPE作用4周后,采用上述方法麻醉各组大鼠,分别行多普勒彩色超声心脏血流动力学检测,在超声二维影像指导下,检测并记录大鼠心率(Heart rate,HR)、左心室收缩压(Left ventricular systolic pressure,LVSP)、平均动脉压(Mean arterial pressure,MAP)以及左心室舒张末压(Left ventricular end-diastolic pressure,LVEDP),连续检测3个心脏周期,计算平均值。
1.2.3 标本采集 心脏超声血流动力学检测完成后,处死各组大鼠(每组15只),迅速取出心脏,摘除非心肌其他组织,将心室直径最大处心肌组织剪切为1 cm×1 cm×1 cm组织,部分浸泡于福尔马林缓冲液(10%)固定24 h,制备石蜡切片备用,部分浸泡于4%戊二醛固定;另取部分心肌组织切碎,在液氮中迅速冷冻后保存于-80℃冰箱。
1.2.4 心肌组织形态学观察 将上述心肌组织切片脱蜡、乙醇水合、洗涤后,采用苏木精(Hematoxylin,H)-伊红(Eosin,E)逐步对切片染色,最后洗去多余染液,采用中性树胶封片,采用光学显微镜观察大鼠心肌组织形态并拍照记录。
1.2.5 TUNEL法检测细胞凋亡 将心肌组织制备冷冻切片(7 μm/片),采用TUNEL染色试剂盒(绿色荧光)处理切片,然后以4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(蓝色荧光)对细胞核染色,将切片置于激光共聚焦扫描显微镜下观察并拍照,以绿色荧光强度与蓝色荧光强度的比值表示TUNEL阳性细胞比例,即凋亡细胞比例。
1.2.6 蛋白免疫印迹分析 研磨大鼠心肌冷冻组织,提取组织中总蛋白,定量后,采用SDS-凝胶电泳分离分子量不同的蛋白质,转印至PVDF膜。首先加入5%脱脂奶粉,封闭PVDF膜1 h;然后分别加入兔源cleaved-caspase9抗体、cleaved-caspase3抗体、ERK1/2抗体、p38MAPK抗体、p-ERK1/2抗体、p-p38MAPK抗体、GAPDH抗体等一抗(1∶500),4℃孵育过夜;之后加入与HRP缀合的羊抗兔二抗(1∶5 000),室温孵育1 h;最后经增强型化学发光试剂处理后,采用Tanon软件采集图像并对蛋白条带灰度进行分析。
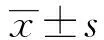
2 结果
2.1 大鼠心脏血流动力学的变化 与对照组比较,IHF组大鼠HR、LVEDP明显升高(P<0.05),MAP、LVSP明显降低(P<0.05)。与IHF组比较,低、中、高剂量GSPE组和卡普托利组大鼠HR、LVEDP均明显降低(P<0.05),MAP、LVSP均明显升高(P<0.05);与卡普托利组比较,高剂量GSPE组大鼠HR、LVEDP、MAP、LVSP均无明显差异(P>0.05),见表1。
2.2 大鼠心肌组织形态学改变 对照组心肌细胞排列规则、紧密,肌原纤维完整,组织结构正常。IHF组心肌细胞细胞破碎、排列疏松,肌原纤维破裂,组织中出现炎性细胞,呈现病理损伤状态。低、中、高剂量GSPE组和卡普托利组心肌细胞排列趋于规则,坏死细胞减少,肌原纤维逐渐完整。高剂量GSPE组与卡普托利组心肌组织形态趋于一致,见图1。
2.3 大鼠心肌细胞凋亡的比较 与对照组比较,IHF组大鼠TUNEL阳性心肌细胞比例明显升高(P<0.05);与IHF组比较,低、中、高剂量GSPE组大鼠TUNEL阳性心肌细胞比例明显降低(P<0.05);与卡普托利组比较,高剂量GSPE组大鼠TUNEL阳性心肌细胞比例无明显差异(P>0.05),见图2、表2。

图1 心肌组织HE染色结果(×200)Fig.1 HE staining results of myocardial tissue(×200)
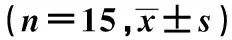
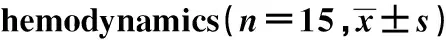

GroupsHR(beats/min)LVEDP(mmHg)MAP(mmHg)LVSP(mmHg)Ctrl487.75±24.327.75±1.03120.67±15.86146.25±13.78IHF559.27±29.141)16.28±3.351)93.53±13.791)108.76±12.351)CAPT495.64±30.861)2)6.57±1.161)2)119.21±10.571)2)133.74±11.481)GSPE-L543.14±26.781)2)3)12.58±1.961)2)3)108.13±13.951)2)3)116.51±13.161)2)3)GSPE-M522.06±26.171)2)3)8.06±1.231)2)3)115.34±12.141)2)3)128.31±10.171)2)3)GSPE-H490.27±25.211)2)6.34±1.091)2)121.03±9.631)2)132.56±9.761)2)
Note:Compared with the control group,1)P<0.05;compared with the IHF group,2)P<0.05;compared with the CAPT group,3)P<0.05.
2.4 大鼠心肌组织凋亡相关蛋白表达的比较 与对照组相比,IHF组大鼠心肌组织cleaved-caspase9、cleaved-caspase3蛋白水平明显增加(P<0.05)。与IHF组相比,低、中、高剂量GSPE组和卡普托利组大鼠心肌组织cleaved-caspase9、cleaved-caspase3蛋白表达量水平明显降低(P<0.05);与卡普托利组比较,高剂量GSPE组大鼠心肌组织cleaved-caspase9、cleaved-caspase3蛋白水平无明显差异(P>0.05),见图3、表3。

图2 TUNEL法观察心肌细胞凋亡(×100)Fig.2 Apoptosis of myocardial cell by TUNEL(×100)
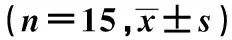

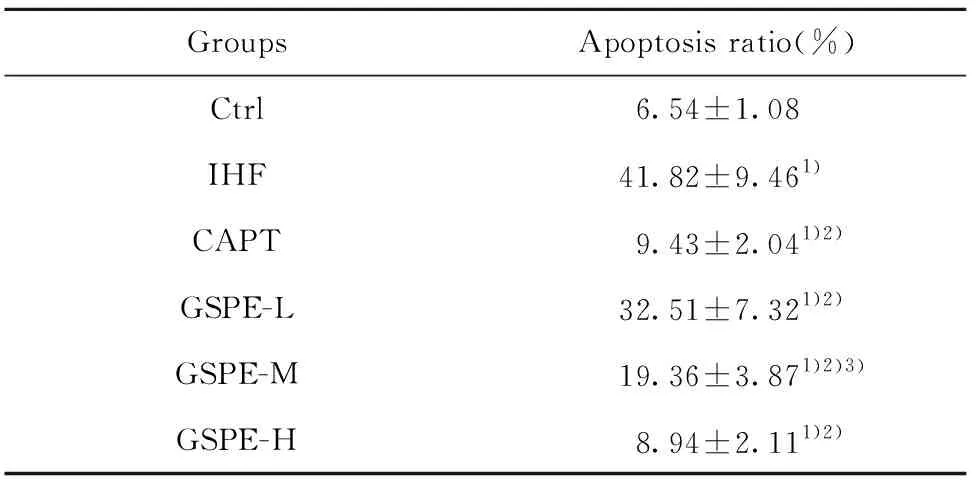
GroupsApoptosis ratio(%)Ctrl6.54±1.08IHF41.82±9.461)CAPT9.43±2.041)2)GSPE-L32.51±7.321)2)GSPE-M19.36±3.871)2)3)GSPE-H8.94±2.111)2)
Note:Compared with the control group,1)P<0.05;compared with the IHF group,2)P<0.05;compared with the CAPT group,3)P<0.05.
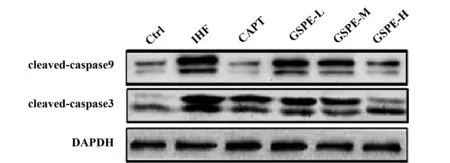
图3 WB检测凋亡蛋白表达情况Fig.3 Expression of apoptosis-rated protein detected by WB
2.5 大鼠心肌组织MAPK通路相关蛋白表达的比较 与对照组相比,低、中、高剂量GSPE组和卡普托利组大鼠心肌组织ERK1/2、MAPK、JNK蛋白总相对表达量均无显著差异(P>0.05)。与对照组相比,IHF组大鼠心肌组织ERK1/2、MAPK、JNK蛋白磷酸化水平明显增加(P<0.05)。与IHF组相比,低、中、高剂量GSPE组和卡普托利组大鼠心肌组织ERK1/2、MAPK、JNK蛋白磷酸化水平明显降低(P<0.05);与卡普托利组比较,高剂量GSPE组大鼠心肌组织ERK1/2、MAPK、JNK蛋白磷酸化水平无明显差异(P>0.05),见图4、表4。

Groupscleaved-caspase9/GAPDHcleaved-caspase3/GAPDHCtrl0.38±0.040.49±0.08IHF2.09±0.121)2.31±0.171)CAPT0.35±0.051)2)1.29±0.041)2)GSPE-L1.87±0.081)2)3)2.05±0.111)2)3)GSPE-M1.16±0.071)2)3)1.78±0.151)2)3)GSPE-H0.43±0.071)2)1.25±0.081)2)
Note:Compared with the control group,1)P<0.05;compared with the IHF group,2)P<0.05;compared with the CAPT group,3)P<0.05.

图4 WB检测各组大鼠心肌组织ERK1/2、MAPK、JNK蛋白表达情况Fig.4 Expression of ERK1/2,MAPK,JNK protein detected by WB
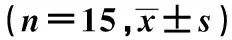
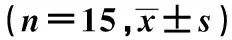

GroupERK1/2/GAPDHp-ERK1/2/GAPDHp38MAPK/GAPDHp-p38MAPK/GAPDHJNK/GAPDHp-JNK/GAPDHCtrl3.23±0.650.32±0.092.01±0.410.63±0.141.12±0.220.49±0.12IHF3.17±0.632.51±0.511)1.92±0.381.95±0.381.21±0.241.23±0.251)CAPT3.16±0.641.68±0.351)2)1.98±0.390.54±0.121)2)1.19±0.230.41±0.091)2)GSPE-L3.19±0.662.26±0.491)2)3)1.87±0.361.78±0.241)2)3)1.23±0.241.01±0.211)2)GSPE-M3.22±0.651.89±0.431)2)3)1.94±0.371.05±0.191)2)3)1.15±0.230.47±0.111)2)3)GSPE-H3.24±0.641.57±0.291)2)1.89±0.380.57±0.131)2)1.14±0.220.38±0.071)2)
Note:Compared with the control group,1)P<0.05;Compared with the IHF group,2)P<0.05;compared with the CAPT group,3)P<0.05.
3 讨论
心力衰竭是指由于心脏功能损伤导致静脉系统血液积滞、动脉系统血供不足,进而引起心脏循环障碍,是临床上多种心血管疾病的终末阶段,具有预后差、致残致死率高等特点,严重威胁人类生命安全,逐渐成为一种世界性健康问题[7,8]。本研究采用动脉-静脉造瘘法制备缺血性心力衰竭大鼠模型,结果显示,缺血性心力衰竭大鼠HR、LVEDP明显升高,MAP、LVSP明显降低,大鼠心肌细胞坏死、心肌纤维断裂,表明造模大鼠心脏收缩舒张功能降低、心肌组织出现明显损伤,提示造瘘法可成功复制缺血性心力衰竭模型。
GSPE是一种从葡萄籽提取分离的天然化合物,属于多酚类物质,可抑制氧化应激、细胞凋亡、炎症反应等,常用于抗氧化、抗衰老等[9,10]。研究表明,GSPE通过激活自发性高血压大鼠的抗氧化损伤系统,改善大鼠心脏收缩舒张功能,推测GSPE可增强高血压大鼠心脏功能[11]。Vijayakumar等[12]发现,GSPE可通过抑制氧化应激反应,有效抑制年龄相关性大鼠心肌细胞凋亡,保护大鼠心脏功能。本研究发现,GSPE作用4周后,IHF大鼠的HR、LVEDP显著降低,MAP、LVSP显著升高,心肌病理损伤程度明显减轻,与卡普托利作用效果一致,提示GSPE可改善缺血性心力衰竭大鼠心脏收缩舒张功能和减轻心肌组织损伤,但其作用机制尚不明确。
心脏损伤是一个多因素共同作用的复杂过程,其病理过程与细胞凋亡密切相关[13]。正常生理情况下,细胞凋亡一般在衰老或病变细胞中发生,是机体清除衰老或病变细胞,维持细胞动态平衡的自我保护机制;当机体受到外界凋亡刺激时,细胞失去对凋亡相关基因转录表达的控制,导致细胞凋亡出现异常,引起细胞坏死,进而引起机体发生病理性变化[14,15]。本研究发现,IHF大鼠凋亡心肌细胞比例及心肌组织cleaved-caspase9、cleaved-caspase3蛋白水平均显著高于对照组;GSPE作用4周后,IHF大鼠凋亡心肌细胞比例及心肌组织cleaved-caspase9、cleaved-caspase3蛋白水平明显下降,提示GSPE可抑制缺血性心力衰竭大鼠心肌细胞凋亡。进一步检测发现,细胞凋亡是生物体调节机体细胞平衡的一种自主死亡程序,研究表明MAPK信号通路与细胞凋亡密切相关。当机体受到外界刺激时,MAPK通路通过一系列级联激活,可将胞外信号传递至细胞内,激活下游靶基因转录和表达,参与调控细胞凋亡、炎症反应等多种生理过程[16]。据报道,三条MAPK信号通路并行存在于哺乳类动物细胞中,分别为细胞外信号调节激酶(Extracellular signal regulated protein kinase,ERK)、p38 MAPK和C-Jun N-末端激酶(C-Jun N-terminal kinase,JNK)通路,当细胞接收到外界刺激信号时,可激活ERK、p38 MAPK、JNK信号通路中的部分或全部,既可独立作用也可协调作用调节细胞功能[17,18]。多项研究证实,MAPK信号通路异常激活与心肌肥厚、急性心梗、心衰等多种心血管疾病的发生密切相关[19]。Cipolletta等[20]通过构建病理性心肌肥厚大鼠模型,发现ERK蛋白在模型大鼠心肌组织中高度磷酸化,抑制其磷酸化程度可有效降低模型大鼠心脏体积、减轻心脏质量和降低心肌壁厚度,减轻心肌肥厚病症。本研究发现,IHF组大鼠心肌组织ERK1/2、MAPK、JNK蛋白磷酸化水平程度明显高于对照组;GSPE作用4周后,IHF大鼠心肌组织ERK1/2、MAPK、JNK蛋白磷酸化程度降低,提示GSPE可抑制MAPK信号通路激活。
综上所述,葡萄籽原花青素可能通过调节MAPK通路抑制心肌细胞凋亡,为将葡萄籽原花青素应用于改善缺血性心力衰竭提供了一定理论基础。

