围产后期亚临床酮病对奶牛氧化应激、免疫功能和生产性能的影响
■宝 华 宋利文 张 航 杨阿日木扎 谢天明 马燕芬*
(1.内蒙古农牧业科学院动物营养与饲料研究所,内蒙古呼和浩特010031;2.内蒙古民族大学动物科学技术学院,内蒙古通辽028000)
围产期(即奶牛产前3 周至产后3 周)是奶牛整个泌乳周期中最为至关重要的一个阶段,对奶牛的健康和生产性能极为重要。奶牛在产前1~3 周内采食量下降,干物质摄入量减少,满足不了胎儿生长发育和自身能量代谢的需要;而奶牛在分娩后的1~3周内,由于泌乳高峰先于采食高峰到达,致使奶牛机体处于能量负平衡(negative energy balance,NEB)这样的一种营养应激状态[1-3]。NEB 启动机体脂肪动员,随后血液中非酯化脂肪酸(non-esterified Fatty Acids,NEFA)和β-羟丁酸(beta-hydroxybutyricacid,BHBA)浓度增加,葡萄糖(glucose,GLU)浓度下降[4],引发奶牛亚临床酮病(subclinical ketosis,SCK)、临床酮病(clinical ketosis)和脂肪肝等围产期能量代谢障碍性疾病,亚临床酮病长期不治疗就会转化为临床型酮病。以围产期能量代谢障碍为病理学基础的酮病和脂肪肝(妊娠毒血症、肥胖综合征)是奶牛重要的群发性常见多发病,且多发于日产奶30 kg 以上的高产牛。由于牧场一味的追求高产奶量、饲养管理程度低下等原因,使得该类疾病的发病率长期以来一直居高不下。据相关资料报道:我国奶牛亚临床和临床酮病的发病率约为15.0%~30.0%,印度为14.7%,美国为5.0%,而日本却高达43.1%;我国奶牛脂肪肝的发病率超过30%。一头患有酮病的奶牛其治疗费用和奶产量下降所造成的经济损失可达150~300 美元,若奶牛患有酮病不仅显著降低免疫性能和繁殖性能,还会提高奶牛治疗成本,显著降低整个泌乳期的生产性能、繁殖性能和健康状况,给奶牛业造成巨大的经济损失[5-6]。故奶牛亚临床酮病、临床酮病、脂肪肝一直被各国列为最重要的围产期奶牛代谢病而加以研究,而防治新技术和新方法是该研究领域的重点之一。本课题组近5 年来一直在研究围产期奶牛营养代谢病的发病机理[7-8]和防治技术[9-10],有效地提高了围产期奶牛的生产性能和健康状况。
奶牛亚临床酮病是目前奶牛养殖业中常见的一种由NEB 所致的营养代谢性疾病,主要发生在产后前3 周,主要由NEB 所致[11]。NEB 时,机体必然动员体脂弥补能量亏缺。在机体动员脂肪的同时将产生大量的NEFA,当产生的NEFA 超过肝脏的氧化能力时就会在肝脏以脂肪的形式蓄积。同时,由于NEFA氧化不完全会导致机体产生大量的BHBA 进而引起脂肪肝和SCK 的发生[12]。SCK 时奶牛机体会处于严重的NEB 状态,脂肪不断动员的过程使机体处于高代谢状态,产生的高浓度的NEFA 和BHBA 不仅能改变血液的酸碱度,影响抗氧化酶的活性,还具有脂毒性,影响线粒体的结构和功能,导致机体在生物氧化过程中产生大量的自由基(Free radical)。自由基是机体氧化反应过程中产生的活性物质,正常状态下机体内自由基的产生和清除处于一个动态的平衡状态,然而当机体内产生的多余自由基不能得到及时有效的清除时,具有强氧化性的自由基不仅会损害机体的组织和细胞,还会氧化其他生物基质,如脂质、DNA 和蛋白质,使机体处于氧化应激(oxidative stress,OS)状态[13],引起营养代谢性疾病和慢性疾病的发生。此外,高浓度的NEFA 和BHBA 可降低抗氧化酶活性,使自由基清除产生障碍,从而使亚临床酮病奶牛产生氧化应激。研究发现氧化应激是一个非常重要的潜在因素[8],能够干扰机体的宿主免疫和炎症反应过程,因此氧化应激增加了奶牛对各种疾病的易感性,特别是对于围产期奶牛更容易受到各种营养代谢性疾病和传染病的影响。围产期奶牛的氧化应激可能是引起炎性反应和免疫功能紊乱的主要原因,这一观点在奶牛的体外和体内研究中都得以证实[8]。
越来越多的研究表明围产期和泌乳早期奶牛的许多疾病的发生与氧化还原平衡呈显著相关。围产期奶牛由于分娩、泌乳启动和乳汁分泌增加了奶牛机体的代谢应激,奶牛自身抗氧化需求可能还会随着产奶量的增加而逐步增加。一旦机体组织不能充分清除机体内产生的多余的ROS,将不可避免地导致机体产生氧化应激,并增加高产奶牛的患病风险。因此,如何预防宿主组织的氧化损伤和免疫功能的紊乱,可能是更加有效地避免围产期奶牛代谢性疾病发生的有效策略。基于以上分析,本试验主要分析围产后期患有亚临床酮病奶牛的脂质动员与免疫紊乱和氧化损伤之间的关系,该研究可为提高亚临床酮病奶牛的生产性能和健康状况提供技术依据,同时对于揭示相关代谢性疾病的发生机制和制订有效的预防措施提供相关参考。
1 材料与方法
1.1 亚临床酮病奶牛筛选
在呼和浩特市一奶牛场选择(2~5 胎),体重(650±20)kg、上一胎次产奶量(30±2.45)kg接近的产前(5±2)d 的50 头临床检查健康的荷斯坦奶牛作为试验动物,产后第10、20 d早晨饲喂前用无抗凝真空采血管尾静脉采集血液,血液采集后立即放入冰盒保存,孵育后离心分离血清,分装于1.5 ml 离心管,-20 ℃保存待测血液中BHBA、NEFA 和GLU 浓度。根据产后10 d 血液生化指标和临床症状对所选择的牛只进行分组,其中亚临床酮病组奶牛10 头,血液指标为1.2 mmol/l<BHBA<3.0 mmol/l,NEFA>0.4 mmol/l,葡萄糖<3.0 mmol/l,并伴有精神萎靡,食欲低下,体重减轻,泌乳量下降等作为SCK 组;健康奶牛10 头,血液指标为BHBA<1.2 mmol/l,NEFA<0.4 mmol/l,葡萄糖>3.0 mmol/l,且食欲、体温、脉搏、泌乳量、呼吸正常的奶牛作为对照组。整个试验过程牛群统一饲养管理,自由采食,自由饮水。
1.2 试验日粮
所有奶牛均饲喂相同的基础日粮,泌乳前期奶牛日粮组成详见表1。
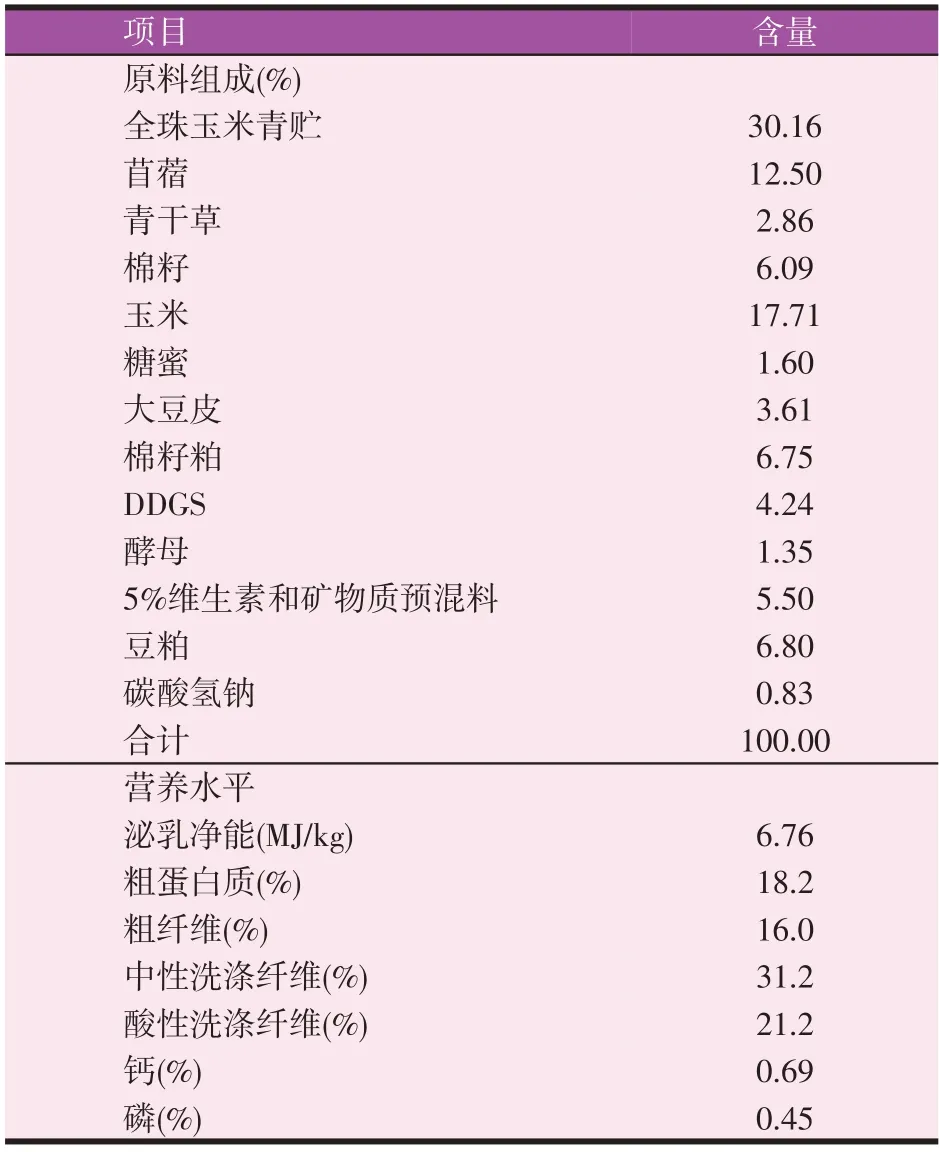
表1 泌乳前期奶牛日粮组成和营养水平(风干基础)
1.3 血液采集和测定
分别于产后第10、20 d 经尾静脉穿刺采集对照组和SCK组奶牛血样,室温下静置2 h后用LD-3离心机于4 ℃下3 500×g 离心15 min(常州亿能实验仪器厂,江苏,中国)。分离后的血清分装于1.5 ml离心管中保存于-80 ℃,用于测定酮体指标、生化指标、抗氧化酶活性及免疫指标。
血清中BHBA、NEFA和GLU含量,抗氧化指标总抗氧化酶(Total antioxidant capacity,TAC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,氧化指标丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)、过氧化氢(hydrogen peroxide,H2O2)采用试剂盒(Randox Laboratories,Crumlin,UK)和酶标仪(Hitachi,Tokyo,Japan)进行测定;血清中生化指标天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)、白蛋白(albumin,ALB)、胆固醇(Cholesterol,Chol)和甘油三酯(Triacylglycerol,TG)活性采用全自动生化分析仪(Sekisui Medical Co.,Ltd.,Tokyo,Japan)进行测定;血清中免疫指标免疫球蛋白G(Immunoglobulin G,IgG)和炎性因子肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1 beta,IL-1β)、白介素-2(interleukin-2,IL-2)、白介素-8(interleukin-8,IL-8)、干扰素-γ(interferon-gamma,IFN-γ)采用ELISA 试剂盒和酶标仪(Hitachi,Tokyo,Japan)进行测定。
1.4 乳样采集和测定
分别于产后第10、20 d左右连续3 d测定对照组和SCK组奶牛自由采食TMR的供给量、剩余量,计算出每组牛的平均采食量。
记录产后10、20 d 对照组和SCK 组奶牛的产奶量,分别将第10 d 和20 d 早、中、晚采集的奶样以4:3:3 混合后用乳成分分析仪LM2(北京英伟达科技有限公司,北京,中国)测定奶样中的乳成分含量和体细胞数。
1.5 数据统计
数据处理与分析采用SAS 9.4(SAS Institute Inc.,Cary,NC)进行统计检验。采用单因素方差分析(One-way ANOVA)和t 检验(Student's t-test)进行两组比较。与对照组相比,P<0.05 表示差异显著,P<0.01表示差异极显著。
2 试验结果
2.1 围产期亚临床酮病奶牛血液代谢参数(见表2)
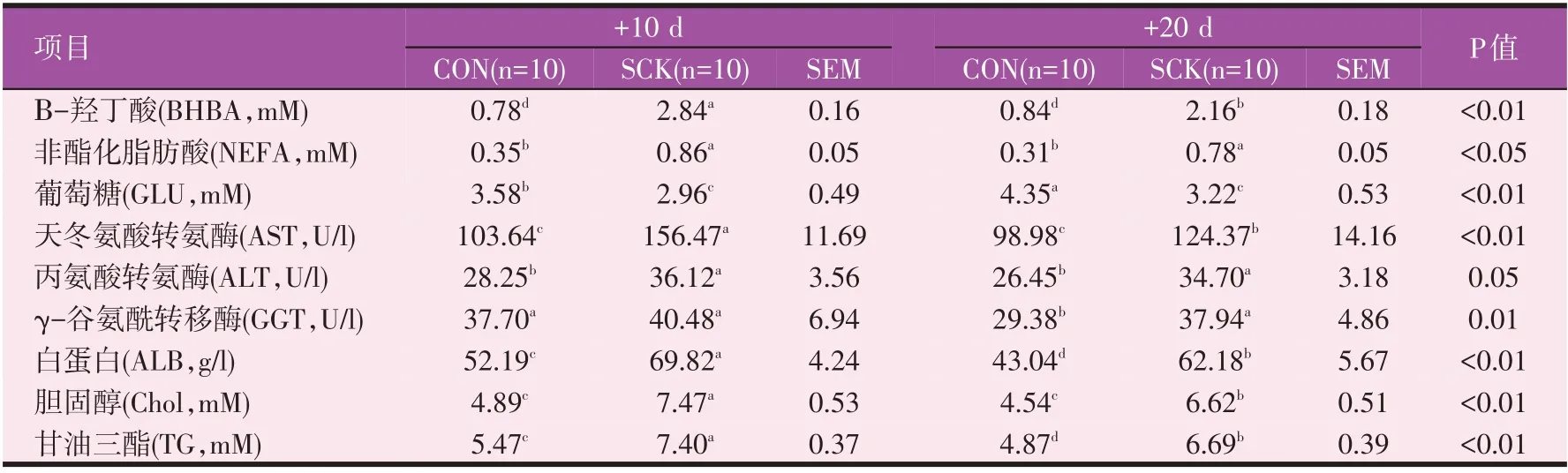
表2 对照组和亚临床酮病组奶牛产后10 d和20 d血液代谢参数
从表2 数据可知,在产后10 d 和20 d 时,SCK 组奶牛血液中BHBA 含量分别极显著(P<0.01)和显著(P<0.05)高于对照组,NEFA 含量均显著高于对照组(P<0.05),而GLU 含量在产后10 d(P<0.05)和20 d(P<0.01)时则显著和极显著低于对照组。且随着泌乳时间的延长,SCK组奶牛血液中BHBA 含量均呈下降趋势(P<0.05),但SCK组奶牛产后20 d时BHBA 含量仍显著高于对照组产后10 d 的奶牛(P<0.05)。从以上数据来看,在产后20 d内SCK组奶牛BHBA含量在1.2~3.0 mM之间,NEFA含量显著高于0.4 mM,葡萄糖含量则显著低于3.5 mM,说明奶牛在产后20 d内一直处于严重的能量负平衡状态,导致机体产生了严重的亚临床酮病。此外,我们测定了血液中生化指标,以此判定亚临床酮病奶牛的肝脏代谢情况。从表2 数据可知,在产后10 d 和20 d 时,SCK 组奶牛血液中AST、CHOL 含量分别极显著(P<0.01)和显著(P<0.05)高于对照组,ALT 含量均显著高于对照组(P<0.05),ALB和TG含量均极显著高于对照组(P<0.01);而SCK组奶牛血液中GGT 含量仅在产后20 d时显著高于对照组(P<0.05)。之后随着泌乳时间的增加,SCK 组奶牛血液中AST、ALB、CHOL 和TG 含量均呈下降趋势(P<0.05),但SCK 组奶牛产后20 d 时AST、ALT、ALB、CHOL 和TG 含量仍显著高于对照组产后10 d 的奶牛(P<0.05)。说明SCK 组奶牛肝脏功能在逐渐修复,但仍显著高于对照组产后10 d的奶牛(P<0.05)。以上数据进一步说明部分奶牛在围产后期由于较高的产奶量和较低的干物质采食量,导致机体产生了能量负平衡,进而导致机体产生了亚临床酮病,在围产期3周后机体自身仍不能进行自我修复,严重的有可能会导致临床酮病的发生,降低奶牛生产性能和健康状况,严重者可能会进一步影响奶牛的繁殖性能。
2.2 围产期亚临床酮病奶牛氧化还原状态分析(见表3)

表3 对照组和亚临床酮病组奶牛产后10 d和20 d氧化还原参数
从表3 氧化参数数据可知,在产后10 d 和20 d时,SCK组奶牛血液中ROS含量分别显著(P<0.05)和极显著(P<0.01)高于对照组奶牛,MDA含量分别极显著(P<0.01)和显著(P<0.05)高于对照组奶牛,而H2O2含量则均显著高于对照组奶牛(P=0.02);且随着泌乳时间的延长,SCK 组奶牛血液中MDA 含量呈下降趋势(P<0.05),但SCK 组产后20 d 奶牛血液中ROS、MDA 和H2O2含量仍显著高于对照组产后10 d 的奶牛(P<0.05)。从抗氧化参数数据可知,在产后10 d和20 d 时,SCK 组奶牛血液中TAC 和GPX 活性分别显著(P<0.05)和极显著(P<0.01)低于对照组奶牛,SOD 活性则均显著低于对照组奶牛(P<0.05);SCK 组产后20 d 奶牛血液中TAC、SOD 和GPX 活性仍显著低于对照组产后10 d 的奶牛(P<0.05)。综合以上数据可知,SCK 组奶牛在分娩后产生能量负平衡的同时伴随着氧化水平的增高,抗氧化酶活性的降低,说明分娩后奶牛机体确实产生了氧化应激。
2.3 围产期亚临床酮病奶牛免疫水平变化(见表4)

表4 对照组和亚临床酮病组奶牛产后10 d和20 d免疫参数
从表4 免疫因子参数数据可知,在产后10 d 和20 d 时,SCK 组奶牛血液中IgG 含量分别极显著(P<0.01)和显著(P<0.05)低于对照组奶牛,而TNF-α(P=0.03)、IL-1β(P=0.04)、IL-2(P=0.03)、IL-8(P=0.04)和IFN-γ(P<0.05)含量则均显著高于对照组奶牛;且随着泌乳时间的延长,SCK 组奶牛血液中IgG 含量呈下降趋势(P<0.05),而TNF-α、IL-1β、IL-2、IL-8 和IFN-γ含量则呈上升趋势(P<0.05),但SCK组产后20 d奶牛血液中IgG 含量仍显著低于对照组产后10 d 的奶牛(P<0.05),TNF-α、IL-1β、IL-2、IL-8 和IFN-γ含量仍显著高于对照组产后10 d 的奶牛(P<0.05)。综合以上数据可知,SCK组奶牛在分娩后产生能量负平衡的同时伴随着炎症反应的发生。
2.4 围产期亚临床酮病奶牛生产性能和健康状况(见表5)
从表5 中DMI 和产奶量数据可知,在产后10 d和20 d 时,SCK 组奶牛产奶量显著(P<0.05)和极显著(P<0.01)低于对照组奶牛,DMI 则均显著低于对照组奶牛(P<0.05),而SCC 则显著(P<0.05)和极显著(P<0.01)高于对照组奶牛;且随着泌乳时间的延长,SCK 组奶牛SCC 呈上升趋势(P<0.05),但SCK 组产后20 d 时DMI 和产奶量仍显著低于对照组产后10 d 的奶牛(P<0.05),SCC 仍极显著高于对照组产后10 d 的奶牛(P<0.01)。SCK 组奶牛DMI(P=0.03)和产奶量(P<0.01)显著低于对照组奶牛,SCK 奶牛分娩后20 d 内下降了9.13%~15.33%。从乳成分数据可知,SCK 组奶牛和对照组奶牛乳成分含量之间没有差异(P>0.05)。综合以上数据可知,SCK 组奶牛机体产生的氧化应激和炎症反应,显著降低了奶牛生产性能,并增加了乳中的SCC。
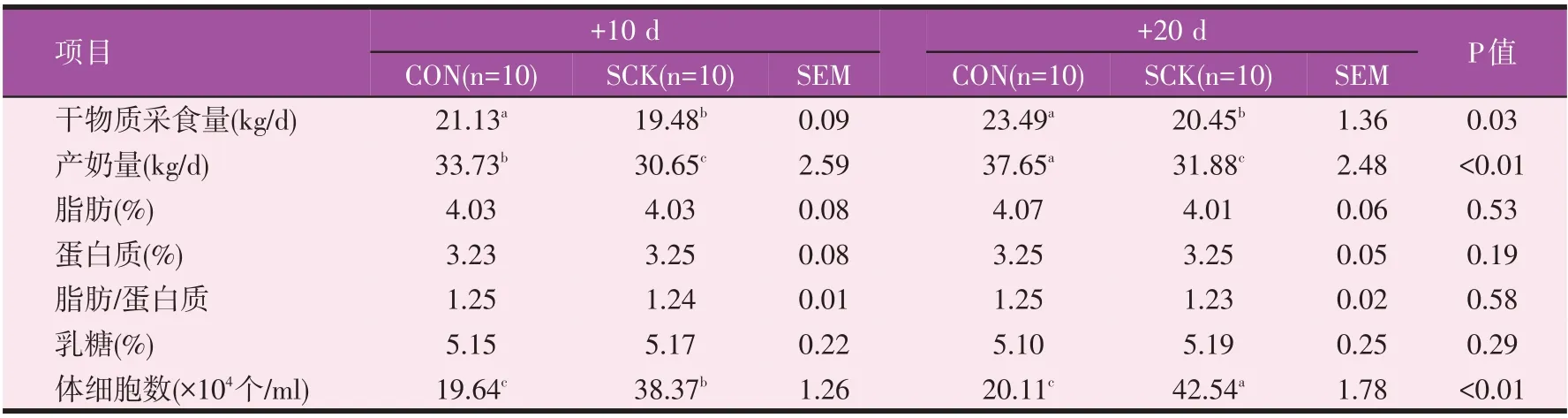
表5 对照组和亚临床酮病组奶牛产后10 d和20 d干物质采食量、产奶量、乳成分含量和体细胞数
3 讨论
3.1 亚临床酮病奶牛的氧化应激和炎性反应
奶牛妊娠晚期和泌乳早期之间的围产期无疑是营养介导的代谢性疾病(如酮病和脂肪肝)发病率较高的阶段。产后奶牛通常会处于NEB 状态,这是由于用以维持奶牛产奶性能的干物质摄入量低和对能量的需求增加而导致的[14]。当机体处于NEB 时,就会启动机体脂肪动员,随后增加血液中NEFA 和BHBA 的浓度[15]。本研究也得出相同的结果,围产后期SCK 奶牛血液中BHBA 和NEFA 浓度显著高于健康组奶牛。其他研究结果也得出,SCK奶牛血清中1.2 mM<BHBA<3.0 mM,葡萄糖浓度低于3.5 mM[16-17],本试验结果得出SCK 组奶牛BHBA浓度均在1.2~3.0 mM 之间,NEFA 浓度高于0.4 mM,而葡萄糖浓度均低于3.0~3.5 mM,说明奶牛产犊后的3 周内确实患有亚临床酮病,但还没有达到临床酮病。
患有SCK 的奶牛常常会表现出较高的脂肪酸水平和肝脏脂质积累。肝脏积累过多的脂质则会损害线粒体功能、能量代谢和细胞信号转导,以及其他途径[18]。此外,肝脏过量的NEFA 会酯化为TG,导致肝脏脂肪堆积[19]。在我们的研究中也发现,SCK 奶牛血液生化指标胆固醇和TG 含量显著增加,导致肝脏脂质积累。然而,过多的肝脏脂质积累可能会增加炎症反应。从我们所测得的数据发现,SCK 奶牛的炎症标志物TNF-α、IL-1β、IL-2、IL-8 和IFN-γ的浓度显著高于对照组,而IgG 含量显著低于对照组,说明SCK 奶牛表现为肝脏脂肪堆积和全身炎症反应。
此外,肝脏脂质积累也会导致机体产生过量的活性氧(ROS)。根据人类和小鼠的研究结果可知,高水平的ROS 通过改变细胞膜的完整性和功能来诱导脂质过氧化、蛋白质结构和核酸中的链断裂,损害细胞和细胞器,进而诱导“二次损伤”并导致细胞凋亡[20]。本课题组前期体外研究发现,围产期奶牛机体产生的氧化应激可通过降低核因子E2 相关因子2(nuclear factor erythroid 2 like 2,NFE2L2)的核易位和转录活性而增加乳腺上皮细胞(bovine mammary epithelial cells,BMEC)的氧化损伤,破坏蛋白质、脂质和DNA结构,诱导乳腺上皮细胞产生凋亡,并最终导致机体氧化还原状态不平衡[8]。
研究表明,过量的脂质积累可促进脂质毒性,并可通过产生氧化应激来诱导小鼠肝损伤和炎症反应[21-22]。本试验数据也得出,患有SCK 的奶牛表现出氧化应激,与对照组相比,SCK奶牛血液中ROS、MDA和H2O2含量显著升高,但TAC、SOD 和GPX 活性显著降低。基于以上数据分析,SCK 奶牛表现出严重的肝脏氧化应激,而严重的氧化应激则又会导致脂质过氧化、DNA 损伤、线粒体功能障碍,最终诱导细胞凋亡和组织损伤[17],这与本课题组在BMEC 上得出的结果一致[8]。
此外,从本试验所测试的SCK 奶牛肝功能指标发现,SCK 奶牛血清中AST、ALT、GGT、ALB、胆固醇和TG 浓度均显著高于对照组,说明SCK 奶牛表现出肝损伤,这与Li 等[23]和Du 等[19]得出的结果一致,这些结果也进一步支持了我们的研究结果。综上所述,围产后期SCK 奶牛表现出严重的肝氧化损伤和炎性损伤。
3.2 亚临床酮病奶牛的生产性能和健康状况
产奶量是衡量奶牛生产性能的重要指标。SCK奶牛血液或牛奶BHBA 水平升高显著影响产奶量的变化。部分研究发现SCK 奶牛日产奶量下降了1%~18%[24-25],但其他研究发现SCK 奶牛的日产奶量从5%增加到了11%[26-27],我们的研究发现患有SCK 奶牛的DMI 显著低于健康组奶牛,SCK 奶牛日产奶量下降了9%~15%,进一步证明了SCK 奶牛血液中BHBA 浓度与产奶量之间呈线性关系[17]。研究发现,SCK 对产后第一周奶牛的产奶量的影响显著低于第二周[17,25,28],从本试验所得数据可知,SCK均显著降低了产后10 d 和产后20 d 的产奶量,且产后10 d 和产后20 d 的产奶量之间无显著差异,说明奶牛患有SCK 期间显著降低了奶牛的产奶量,究其原因可能是与SCK 期间奶牛较低的干物质采食量和较高的产奶所需的能量之间的不平衡导致的NEB 有关。本研究中未发现SCK 对奶牛乳成分的影响,相关原因还需做进一步研究。
牛奶中的SCC 可用于确定奶牛是否患有隐性乳房炎,隐性乳房炎的特征是SCC 增加,而乳房或牛奶中没有任何视觉异常。一般牛奶中SCC 高于60×104个/ml 表示奶牛患有隐性乳房炎[29]。较高的隐形乳房炎发病率会对生产造成巨大的经济损失[30]。我们的研究结果发现SCK 奶牛乳中SCC 显著高于对照组,且均低于60×104个/ml,表明两组奶牛都未患有隐性乳房炎。但在SCC 较高的奶牛中,平均产奶量有所下降,进一步验证了SCK 显著降低了奶牛的生产性能。也有研究表明SCK 奶牛可降低奶牛的免疫性能[31],但不增加乳腺炎发病率[32],我们的研究也得出了相同的结果。Leblanc[33]研究表明产后前2 周的高BHBA 浓度不影响临床乳腺炎的发病率,但增加了临床乳腺炎的严重程度和持续时间,这与该研究中得出BHBA 会提高SCC 的结果是一致的。本研究未评估临床乳腺炎,从SCK 奶牛乳房来看,并没有发现红肿、乳房胀大等现象。
4 结论
围产后期亚临床酮病奶牛肝脏均产生了不同程度的氧化损伤和炎性损伤,显著降低了奶牛的生产性能和健康状况,且在围产后期3周内机体自身仍不能进行自我修复。

